Ljekovite supstance izvedene iz piridina. Heterociklična jedinjenja Izolacija kofeina iz čaja
Mol. m. 79,1; bezbojan tečnost sa specifičnim karakteristikama miris; m.p. -42,7 0 C, bp. 115,4°C/760 mm Hg. Art., 13,2°C/10 mmHg; 0,9819: 1,5095; m 7,30 x x 10 -30 C m; g 3,7 10 -2 N/m (25 0 C); h 0,885 mPa s (25 0 C); Sa str 135,62 kJ/mol K) (17 0 C), - 2783 kJ/mol. Može se mešati u svakom pogledu sa vodom i većinom org. r-trgovci na malo; formira azeotropnu smjesu s vodom (t.k. 94 0 C, 58% masenog udjela P.).
P.-baza (
R K a 5.20). From inorg. koji stvara stabilne soli sa alkil halogenidima -piridinijeve soli ,
sa metalnim halogenidima, SO 2, SO 3, Br 2, H 2 O-kompleksnim jedinjenjima. Karakteristični derivati: (C 5 H 5 N HCl) 2 PtCl 2 (t.t. 262-264 0 C, sa razgradnjom), C 5 H 5 N HCl 2HgCl 2 (t.t. 177-178 0 C).
Aromatičan je. sveti ti; sadrži 6p-elektrone, formirajući jedan zatvoreni sistem, u kojem je zbog negativnog indukcija efektom N atoma, elektronska gustina C atoma, posebno na pozicijama 2, 4 i 6, je smanjena (p-deficitarni heterocikl).
Electroph. supstitucija se odvija sa velikim poteškoćama (P. je blizak nitrobenzenu po svojoj sposobnosti za elektrof. supstituciju) i ide na poziciju 3. Većina ovih reakcija se odvija u kiseloj sredini, u kojoj je originalno jedinjenje. To više nije sam P., već njegova sol. P. se nitrira samo pod uticajem NaNO 3 ili KNO 3 u dimajućem H 2 SO 4 na temperaturi od 300 0 C, formirajući 3-nitropiridin sa malim prinosom; sulfoniran sa oleumom u prisustvu Hg sulfata na 220-270 0 C u piridin-3-sulfonsku kiselinu. Kada je P. izložen živinom acetatu na 155 0 C, formira se 3-piridil-živin acetat; na višim temperaturama, di- i polisupstituirani derivati. Djelovanje Br 2 u oleumu na 300 0 C dovodi do mješavine 3-bromo- i 3,5-dibromo-piridina. Na višoj temperaturi (približno 500 0 C), reakcija se odvija radikalnim mehanizmom; proizvodi rastvora su 2-bromo- i 2,6-dibromopiridin. Radikalne reakcije takođe uključuju interakciju P. sa fenildiazonijum hidratom (reakcija Gomberg-Bachmann-Hey), što rezultira formiranjem smeše koja sadrži 55% 2-fenil-, 30% 3-fenil- i 15% 4-fenil-piridina .
nukleofilna supstitucija u P. se dešava na pozicijama 2 i 4 i lakša je nego u benzenu, na primer, sinteza 2-aminopiridina kada P. reaguje sa natrijum amidom (vidi. Chichibabina reakcija
).
P. je u pravilu otporan na oksidirajuća sredstva, ali kada je izložen perkiselinama, lako stvara piridin N-oksid (vidi. Amin N-oksidi)
u kojoj je elektronska gustina na atomima C-2 i C-4 povećana u odnosu na P. Na 300 0 C pod uticajem FeCl 3 P. se oksidira u smešu izomernih dipiridila opšte formule C 5 H 4 N-C 5 H 4 N. Katalitički hidrogenacija u prisustvu Pt ili Ni, redukcija Na u alkoholu, kao i elektrohemijska. redukcija dovodi do piperidina (posljednja metoda se koristi u industriji). Ozbiljnije smanjenje P. je praćeno cijepanjem ciklusa i deaminacijom.
Dodatak karbena u P. ili deprotonacija N-alkilpiridinijum jona dovodi do piridinijum-ilida opšteg tipa I, interakcija P. sa nitrenima ili deprotonacija N-aminopiridinijumovih soli dovodi do piridinijum-imina opšteg tipa II.

Conn. Oba tipa lako ulaze u reakcije cikloadicije karakteristične za 1,3-dipolarne sisteme. P. izdvajaju uglavnom iz Kam.-ug. smola (sadržaj cca. 0,08%), proizvodi suhe destilacije od drveta, treseta ili kosti. Sintetički, mogao bi. trag primljen reakcije:

P. i njegovi derivati-baza piridin alkaloidi ,
kao i mnoge druge. medicinski srijeda u. P. se također koristi u sintezi boja i insekticida, a koristi se i za denaturaciju alkohola. P.-ov kompleks sa SO 3 - piridin sulfotrioksidom je blago sumporno sredstvo; C 5 H 5 NBr 2 HBr-bromirajući agens; C 5 H 5 N HCl je reagens za dehidrataciju epoksida i N-dealkilaciju, C 5 H 5 N H 2 Cr 2 O 7 je oksidant. P. je dobar rastvarač, uklj. za množinu inorg. soli (AgBr, Hg 2 Cl 2, itd.). MPC para P. u vazduhu ~ 0,005 mg/l, pa je zapaljivo. 23,3 0 C.
P. je prvi izolovao T. Andersen 1849. iz koštanog ulja; P. strukturu su osnovali J. Dewar i P. Kerner 1869. godine.
Za P. derivate, vidi
Ciklična jedinjenja u kojima cikluse formiraju ne samo atomi ugljenika, već i atomi drugih elemenata - heteroatomi (O, S, N) - nazivaju se heterociklični. Heterociklična jedinjenja se dele prema veličini prstena i broju heteroatoma u prstenu.
Među ovim jedinjenjima najveći značaj imaju peto- i šestočlana heterociklična jedinjenja. Tipična heterociklična jedinjenja su aromatična po prirodi. Međutim, prisustvo heteroatoma utiče na distribuciju elektronske gustine. Na primjer, u petočlanim heterociklima (furan, tiofen, pirol) elektronska gustina je pomjerena od heteroatoma prema prstenu i najveća je u a-položajima. Stoga se u a-pozicijama najlakše odvija reakcija elektrofilne supstitucije (S E).
U šesteročlanim prstenovima (na primjer, piridin), heteroatom povezan s ugljikom dvostrukom vezom oslanja se na gustoću p-elektrona prstena, stoga je gustoća elektrona u molekulu piridina smanjena na a i g pozicijama. Ovo je u skladu sa preferiranom orijentacijom reaktanata na ove pozicije nakon nukleofilne supstitucije (SN). Pošto je u piridinu gustina elektrona veća u b-položaju, elektrofilni reagens je orijentisan na b-poziciju.
Prilikom proučavanja heterocikla sa dva heteroatoma posebnu pažnju treba obratiti na pirimidin i njegove derivate: uracil, timin, citozin. Pirimidinsko jezgro se nalazi u brojnim prirodnim proizvodima: vitaminima, koenzimima i nukleinskim kiselinama:
Elektrofilna supstitucija za pirimidin se javlja na poziciji 5; nukleofilna (kao za piridin) je ometana i atom ugljika na pozicijama 4 i 6 je napadnut.
Složeni heterociklički sistem koji se sastoji od dva spojena heterocikla, pirimidina i imidazola, naziva se purinsko jezgro.
Purinska grupa leži u osnovi mnogih jedinjenja, prvenstveno nukleinskih kiselina, u koje ulazi u obliku purinskih baza: adenin (6-aminopurin) i gvanin (2-amino-6-hidroksipurin).
Od interesa je kisik derivat purina - mokraćna kiselina (2,6,8 - trioksipurin).
Laboratorijski rad br.8
Cilj rada: proučavanje hemijskih svojstava heterocikličnih jedinjenja
Reagensi i oprema:
1) antipirin,
2) FeCl 3 – 0,1 N,
3) amidopirin,
4) H 2 SO 4 – 2n,
5) NaNO 2 – 0,5n,
6) piridin, NaOH - 2n,
7) mokraćna kiselina, HCl - 2n,
8) NH 4 Cl zasićeni rastvor,
9) pikrinska kiselina zas. rješenje,
10) lakmus papir,
11) bromtimol plava,
12) mikroskop,
13) epruvete.
Iskustvo 8.1 Reakcije antipirina i amidopirina (piramidona)
Sa gvožđe(III) hloridom
Stavite nekoliko kristala antipirina u epruvetu, dodajte dvije kapi vode i kap od 0,1 N. FeCl3. Intenzivna i dugotrajna narandžasto-crvena boja se pojavljuje odmah i ne blijedi kada stojite. Za poređenje, stavite nekoliko kristala amidopirina (piramidona) u drugu epruvetu. Dodajte dvije kapi vode i jednu kap 0,1N. FeCl3. Pojavljuje se ljubičasta boja i brzo nestaje. Dodajte još tri kapi željeznog (III) hlorida odjednom. Boja će se ponovo pojaviti, potrajati malo duže, ali postepeno izblijediti. Bojenje antipirina iz željeznog (III) hlorida nastaje zbog stvaranja kompleksnog jedinjenja - feropirina.

Amidopirin je derivat antipirina. Mobilni atom vodika na poziciji 4 je u ovom slučaju zamijenjen dimetilamino grupom.
Pojava boje je posledica oksidacije amidopirina sa gvožđe (III) hloridom. Zbog toga je boja nestabilna, a višak gvožđe (III) hlorida šteti reakciji.
Gore navedene reakcije koriste se u farmaceutskoj praksi za prepoznavanje antipirina i amidopirina i njihovo međusobno razlikovanje. S obzirom na to, ove reakcije treba raditi paralelno u dvije epruvete radi poređenja.
Iskustvo 8.2 Reakcije antipirina i amidopirina sa azotnom kiselinom
Stavite nekoliko kristala antipirina u epruvetu, dodajte dvije kapi vode, jednu kap 2N. H 2 SO 4 i jedna kap 0,5n. NaNO2. Pojavit će se smaragdno zelena boja, koja postepeno nestaje, posebno brzo s relativnim viškom natrijum nitrita. Za poređenje, stavite nekoliko kristala amidopirina u drugu epruvetu, dodajte dvije kapi vode, jednu kap 2n. H 2 SO 4 i jedna kap 0,5n. NaNO2. Pojavljuje se vrlo nestabilna ljubičasta boja. Ako boja prebrzo nestane, dodajte još malo amidopirina. Reakcija s antipirinom se odvija prema jednadžbi:

Sa amidopirinom nastaju obojeni oksidacijski proizvodi.
Kao i gore navedene reakcije sa gvožđem (III) hloridom, obe reakcije se koriste u farmaceutskoj praksi za prepoznavanje antipirina i amidopirina i njihovo razlikovanje jedna od druge. Stoga ih treba raditi paralelno u dvije epruvete.
Iskustvo 8.3 Precipitacija gvožđe (III) hidroksida vodenim rastvorom
Piridin
Stavite dvije kapi vodenog rastvora piridina u epruvetu i dodajte kap 0,1N FeCl 3 . Smeđe pahuljice željeznog hidroksida Fe(OH) 3 se odmah talože i formiraju sol piridin hidrohlorida (piridin hidrohlorid), koja je lako rastvorljiva u vodi.
Formiranje željeznog (III) hidroksida potvrđuje osnovna svojstva piridina.
Napišite shemu stvaranja piridin hidrohlorida (piridinijum hlorida) tokom interakcije piridin oksid hidrata sa gvožđe (III) hloridom.
Iskustvo 8.4 Formiranje piridin pikrina
Pipetom stavite jednu kap vodenog rastvora piridina u epruvetu i dodajte tri kapi zasićenog vodenog rastvora pikrinske kiseline. Prilikom protresanja postepeno se ističu jasno izraženi igličasti kristali piridin pikrata. U višku piridina, kristali se rastvaraju.
Dio kristala stavite na staklo, pregledajte ih pod mikroskopom i u radnom listu nacrtajte oblik kristala dobivenog preparata.
Formiranje relativno teško rastvorljivog piridin pikrata takođe potvrđuje osnovni karakter piridina. Ova reakcija se koristi za identifikaciju piridina (piridin pikrat se topi na 167 0 C).
Napišite shemu za formiranje piridin pikrata.
Iskustvo 8.5Rastvorljivost mokraćne kiseline i njene prosječne natrijumove soli u vodi
Stavite malu količinu (na vrhu lopatice) mokraćne kiseline u epruvetu. Dodajte vodu kap po kap, svaki put protresite epruvetu.
Obratite pažnju na lošu rastvorljivost mokraćne kiseline u vodi. U hladnoj vodi, mokraćna kiselina je gotovo nerastvorljiva: 1 dio se rastvara u 39.000 dijelova vode.
Nakon dodavanja 8 kapi vode otapanje se i dalje ne primjećuje. Međutim, vrijedi dodati samo 1 kap 2N. NaOH, kao mutna otopina, trenutno se razbistri zbog stvaranja relativno lako topive prosječne disupstituirane natrijumove soli. Dobivenu otopinu sačuvajte za naredne eksperimente.
Mokraćna kiselina postoji u dva tautomerna oblika:

Iz laktim-enolnog oblika sa alkalijama nastaju takozvane soli mokraćne kiseline ili urati. Zapravo, to nisu soli, već enolati.
Vrlo slabo izražen kiseli karakter mokraćne kiseline određuje da se od tri atoma vodika teoretski mogućeg enolnog oblika, samo dva mogu zamijeniti natrijumom. Trisupstituirane soli mokraćne kiseline nisu poznate.
Iskustvo 8.6 Formiranje teško rastvorljivog amonijum urata
U četiri kapi bistrog rastvora prosečne disupstituisane natrijumove soli mokraćne kiseline (eksperiment 8.5) dodajte dve kapi zasićenog rastvora amonijum hlorida. Odmah se taloži bijeli talog amonijum urata. Sačuvajte ovaj talog za naknadni eksperiment izolacije slobodne mokraćne kiseline (eksperiment 8.7).
Napišite reakcijsku shemu, uzimajući u obzir da su oba natrijeva jona u natrijum uratu zamijenjena amonijevim ionima.
Iskustvo 8.7 Razgradnja urata pod uticajem mineralne kiseline (oslobađanje kristalne mokraćne kiseline)
Pomoću pipete nanesite jednu kap mutnog rastvora koji sadrži amonijum urat na predmetno staklo (eksperiment 8.6). Dodajte jednu kap od 2N u centar kapi. HCl. Uočeno je djelomično otapanje taloga.
Pregledom pod mikroskopom vidljive su žućkaste grudice amonijum urata koje se još nisu raspale i novonastali karakteristični kristali mokraćne kiseline u obliku izduženih prizmi, koje podsjećaju na brusne kamence. Nacrtajte oblik kristala dobivenog lijeka u radnom dnevniku.
Taloženje kristala mokraćne kiseline u organizmu (mokraćni kamenac, gihtni čvorovi i sl.) nastaje pod uticajem promene reakcije okoline na povećanje kiselosti.
Napišite dijagram za izolaciju mokraćne kiseline iz njene soli.
Laboratorijski rad broj 9.
Oslobađanje kofeina iz čaja
Cilj rada: izolovati i proučavati neka hemijska svojstva heterocikličkog jedinjenja – kofeina
Reagensi i oprema:
1) crni čaj
2) prah magnezijum oksida
4) porcelanska šolja
5) koncentrovani rastvor HNO 3
6) koncentrovani rastvor amonijaka
Eksperiment 9.1.Sublimacija kofeina.
Stavite 1 kašičicu mlevenog crnog čaja u tanjir i 2 g magnezijum oksida u porculanski ili metalni lončić. Pomiješajte obje supstance i stavite lonac na pločicu. Zagrijavanje treba biti umjereno. Porcelanska šolja sa hladnom vodom stavlja se na lončić. U prisustvu magnezijum oksida, kofein sublimira. Kada se nađe na hladnoj površini, kofein se taloži na dnu šoljice u obliku bezbojnih kristala. Prekinite zagrijavanje, pažljivo izvadite čašu iz lončića i ostružite kristale u čistu tikvicu.
Iskustvo 9.2Kvalitativna reakcija na kofein.
Nekoliko kristala kofeina se stavlja na porculanski tanjir i dodaje se jedna kap koncentrovane azotne kiseline. Zagrijte tanjir dok se smjesa na njemu ne osuši. Istovremeno, kofein oksidira i pretvara se u amaličnu kiselinu, narančaste boje. Dodajte deset kapi koncentriranog amonijaka, formira se crvena sol koja prelazi u ljubičastu. Ova sol se zove mureksid, a reakcija se naziva mureksid.
Napišite jednačinu reakcije.
Pitanja za kontrolu
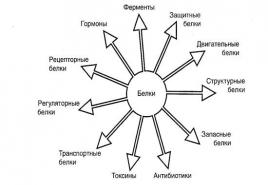
1. Koja jedinjenja se nazivaju heterociklična?
2. Klasifikacija heterocikličkih jedinjenja?
3. Kako se izražava aromatičnost heterocikličnih jedinjenja?
4. Napišite formule heterocikla koji čine aminokiseline.
5. Biološka uloga purina i pirimidina.
Piridin ješesteročlani aromatični heterocikl sa jednim atomom dušika, bezbojna tekućina jakog neugodnog mirisa; može se mešati sa vodom i organskim rastvaračima.
Piridin je slaba baza, daje soli sa jakim mineralnim kiselinama, lako stvara dvostruke soli i kompleksna jedinjenja.
Elektronska struktura molekula piridina slična je strukturi benzena. Atomi ugljika i dušika su u stanju sp2 hibridizacije. Sve σ veze C–C, C–H i C–N formirane su hibridnim orbitalama, uglovi između njih su približno 120°. Stoga ciklus ima ravnu strukturu. Šest elektrona u nehibridnim p orbitalama formiraju aromatični sistem π elektrona.

Od tri hibridne orbitale atoma dušika, dvije formiraju C–N σ veze, a treća sadrži usamljeni par elektrona koji ne učestvuju u π-elektronskom sistemu. Stoga, piridin, kao i amini, pokazuje svojstva baze. Njegov vodeni rastvor postaje lakmus plavi. Kada piridin reaguje sa jakim kiselinama, nastaju soli piridinijuma.

P iridin pokazuje svojstva karakteristična za tercijarne amine: formira N-okside, N-alkilpiridinijumove soli i može da deluje kao ligand sigma-donora.
Istovremeno, piridin ima očigledna aromatična svojstva. Međutim, prisustvo atoma dušika u konjugacijskom prstenu dovodi do ozbiljne preraspodjele elektronske gustoće, što dovodi do snažnog smanjenja aktivnosti piridina u reakcijama elektrofilne aromatske supstitucije. U takvim reakcijama pretežno reaguju meta pozicije prstena.
Osnovna razlika između piridina i benzena je u tome što, zbog veće elektronegativnosti dušika u odnosu na ugljik, u slučaju piridina, u skupu ograničavajućih struktura koje opisuju raspodjelu gustoće p-elektrona, doprinos struktura sa odvojenim negativnim a pozitivni naboji su značajni:

Iz njihovog ispitivanja je jasno da je negativni naboj lokaliziran na atomu dušika, a pozitivan naboj raspoređen uglavnom između atoma ugljika na pozicijama 2,4 i 6 (a- i g-položaji). S tim u vezi, piridin je klasifikovan kao aromatični heterocikl s nedostatkom elektrona, za razliku od furana, pirola i tiofena o kojima je gore raspravljano. To znači da je piridinski prsten kao aromatski sistem deaktiviran u odnosu na elektrofilni napad i, obrnuto, aktiviran u odnosu na nukleofilni napad u odnosu na benzen.
Međutim, prisustvo usamljenog para elektrona i viška gustoće p-elektrona na atomu dušika čini ga vrlo aktivnim centrom napada od strane elektrofila, pogotovo jer formiranje s-veze ne utiče na aromatični sistem. Dakle, piridin je aktivan N-nukleofil, a ovo svojstvo se uvijek inicijalno ostvaruje tokom elektrofilnog napada.

Drugi mogući pravci reakcije povezani sa ispoljavanjem C-nukleofilnosti piridinom - elektrofilni napad na atome ugljenika - izuzetno su teški i zahtevaju veoma stroge uslove za njihovu realizaciju. Pored gore navedene prirode p-elektronskog sistema sa nedostatkom elektrona, u okviru opšteg pristupa kvalitativnom objašnjenju obrazaca elektrofilne supstitucije u aromatičnom prstenu, ovo treba povezati sa činjenicom da prisustvo azota u ciklusu, koji je elektronegativniji od atoma ugljika, destabilizira međuformirani kationski s-kompleks.
Dakle, piridin kombinuje svojstva visoko aktivnog n-nukleofila i značajno deaktiviranog p-nukleofila. Kao što će se vidjeti iz primjera u nastavku, proizvod koji se lako formira kao rezultat elektrofilnog napada na atom dušika je često nestabilan i njegovo stvaranje, iako je kinetički poželjno, je reverzibilan proces. Nasuprot tome, elektrofilni napad na atome ugljika je mnogo teži, ali dovodi do stvaranja stabilnijih supstitucijskih proizvoda koji su termodinamički poželjniji. Kao rezultat toga, mnoge reakcije derivata piridina mogu se odvijati u uvjetima kinetičke, odnosno na heteroatomu, ili termodinamičke, odnosno na atomima ugljika u prstenu, kontrolne, što ih čini sličnim sličnim reakcijama oksiarena. i aromatični amini.
Kao što je ranije navedeno, piridin je baza i protonira se kako bi se formirale stabilne soli piridinijuma. N-alkilacija piridina sa alkil halogenidima se dešava slično, što dovodi do alkilpiridinijumovih soli. Slične reakcije s elektrofilima na usamljenom paru elektrona atoma dušika uključuju oksidaciju perkiselinama uz stvaranje piridin N-oksida.

Na sličan način, piridin stupa u interakciju sa bromom i formira N-bromopiridinijumovu so - piridinijum bromid perbromid, a sa oleumom nakon hlađenja formira piridin sulfotrioksid.

Reakcija klorida karboksilne kiseline sa piridinom odvija se na sličan način. Međutim, rezultirajuća sol N-acilpiridinijuma je toliko aktivan elektrofilni, u ovom slučaju acilirajući, reagens da se ne može izolovati u slobodnom stanju.

Piridin karakteriziraju aromatične nukleofilne supstitucijske reakcije koje se javljaju pretežno na orto-para pozicijama prstena. Ova reaktivnost ukazuje na prirodu piridinskog prstena sa nedostatkom elektrona, što se može sažeti u sljedeće pravilo: reaktivnost piridina kao aromatičnog jedinjenja otprilike odgovara reaktivnosti nitrobenzena.
Piridin pokazuje svojstva aromatičnog spoja, ali, za razliku od benzena, teško je podvrgnut reakcijama elektrofilne supstitucije - nitriran je, sulfoniran i bromiran samo na oko 300 ° C uz formiranje pretežno b-derivata. Nukleofilna supstitucija se događa lakše nego u benzenu.
Dakle, piridin sa NaNH2 daje a-aminopiridin, sa KOH - a-hidroksipiridin. Piridin se redukuje natrijumom u alkoholu ili H2 preko Ni na 120 °C u piperidin. Kada je izložen, na primjer, bazama soli piridinijuma, piridinski prsten se razbija da bi se formirao glutakon dialdehid HOCCH = CHCH2COH ili njegovi derivati.

Sa neorganskim kiselinama formira stabilne soli, sa alkil halogenidima - piridinijeve soli, sa metalnim halogenidima SO2, SO3, Br2, H2O - kompleksna jedinjenja.
Elektrofilna supstitucija se dešava sa velikim poteškoćama (piridin je blizak nitrobenzenu po svojoj sposobnosti da se podvrgne elektrofilnoj supstituciji) i ide na poziciju 3. Većina ovih reakcija se odvija u kiseloj sredini, u kojoj polazno jedinjenje nije sam piridin, već njegova so.
Uz svoja osnovna svojstva, piridin ispoljava svojstva aromatičnog jedinjenja. Međutim, njegova aktivnost u reakcijama elektrofilne supstitucije je niža od aktivnosti benzena. To se objašnjava činjenicom da dušik, kao elektronegativniji element, vuče elektrone prema sebi i smanjuje gustoću elektronskog oblaka u prstenu, posebno na pozicijama 2, 4 i 6 (orto i para položaji).
Stoga se, na primjer, reakcija nitriranja piridina odvija u teškim uvjetima (na 300 °C) i sa malim prinosom. Orijentacijski utjecaj atoma dušika na ulazak novog supstituenta tokom elektrofilne supstitucije u piridinu sličan je utjecaju nitro grupe u nitrobenzenu: reakcija se nastavlja na poziciju 3.
Kao i benzen, piridin može dodati vodonik u prisustvu katalizatora da bi se formirao zasićeno jedinjenje piperidin.

Piperidin pokazuje svojstva sekundarnog amina (jaka baza).
Piridin se nitrira samo pod uticajem NaNO3 ili KNO3 u dimajućem H2SO4 na temperaturi od 300 0C, formirajući 3-nitropiridin sa malim prinosom; sulfoniran sa oleumom u prisustvu Hg sulfata na 220-270°C u piridin-3-sulfonsku kiselinu.
Kada živin acetat deluje na piridin na 1550C, formira se 3-piridilmerkur acetat; na višim temperaturama - di- i polisupstituisani derivati.
Djelovanje Br2 u oleumu na 3000C dovodi do mješavine 3-bromo- i 3,5-dibromo-piridina. Na višim temperaturama (oko 5000C) reakcija se odvija radikalnim mehanizmom; produkti reakcije su 2-bromo- i 2,6-dibromopiridin.
Radikalne reakcije takođe uključuju interakciju piridina sa fenildiazonijum hidratom (Gomberg-Bachmann-Hay reakcija), što rezultira formiranjem smeše koja sadrži 55% 2-fenil-, 30% 3-fenil- i 15% 4-fenil-piridin.
Nukleofilna supstitucija u piridinu se javlja na pozicijama 2 i 4 i lakša je nego u benzenu, na primjer, sinteza 2-aminopiridina reakcijom piridina sa natrijum amidom. (Chichibabina reakcija).
Piridin je, u pravilu, otporan na oksidirajuća sredstva, ali kada je izložen perkiselinama, lako stvara piridin N-oksid, u kojem je elektronska gustoća na atomima C-2 i C-4 povećana u odnosu na piridin.
Na 300 0C, pod uticajem FeCl3, piridin se oksidira u smešu izomernih dipiridila opšte formule C5H4N-C5H4N.
Katalitička hidrogenacija u prisustvu Pt ili Ni, redukcija Na u alkoholu, kao i elektrohemijska redukcija dovodi do piperidina (posljednja metoda se koristi u industriji). Ozbiljnija redukcija piridina je praćena cijepanjem prstena i deaminacijom.
Nitracija piridina nastaje pod dejstvom kalijum nitrata i sumporne kiseline na 370 °C, što dovodi do b-nitropiridina. Sulfoniranje piridina se vrši oleumom u prisustvu živinog sulfata na 220 °C, bromiranje se može izvršiti djelovanjem otopine broma u oleumu na 300 °C. Na ovaj način nije moguće uvesti drugi supstituent u prsten. Piridin ne podliježe Friedel-Craftsovim reakcijama.

U hemiji piridina uopšte, kao i u delu koji se tiče njegove funkcionalizacije primenom reakcija elektrofilne supstitucije, od velike je važnosti mogućnost njegove transformacije u N-oksid. Razmotrimo elektronsku strukturu ovog spoja.

Analiza ovih rezonantnih struktura dovodi do iznenađujućeg zaključka da N-oksidna grupa može djelovati u odnosu na p-elektronski sistem prstena i kao donor (gornji red struktura) i kao akceptor elektrona, odnosno može doprinose nastanku i reakcija elektrofilne supstitucije na a i g-položajima, kao i dodavanju nukleofila na istim pozicijama! Šta se zapravo posmatra?
Stvarni elektronski uticaj koji pokazuje ova grupa zavisi od prirode reagensa. Nitracija piridin N-oksida se odvija mnogo lakše nego za sam piridin - pod dejstvom mešavine dimeće azotne kiseline i sumporne kiseline na 90°C, što dovodi do g-nitro derivata sa prinosom od 90%, što je u skladu sa sa aktivirajućim efektom N-oksidne grupe. Nasuprot tome, reakcija sulfoniranja odvija se pod uvjetima sličnim onima za sulfoniranje samog piridina, što rezultira b-sulfonskom kiselinom. Ovaj smjer reakcije sulfoniranja objašnjava se koordinacijom SO3 na atomu kisika N-oksidne grupe, pretvarajući ovu grupu u akceptor i, prema tome, meta-orijentant.
Pretvaranje piridina u njegov N-oksid, podvrgavanje reakcijama elektrofilne supstitucije i naknadno reduktivno uklanjanje atoma kisika N-oksida je opći pristup sintezi širokog spektra funkcionalno supstituiranih derivata piridina koji se ne mogu dobiti direktno iz piridina. Dakle, redukcija g-nitropiridin N-oksida sa trifenilfosfinom dovodi do uklanjanja atoma kiseonika N-oksida, što omogućava da se dobije 4-nitropiridin u dobrom prinosu. Kada se g-nitropiridin N-oksid redukuje gvožđem u sirćetnoj kiselini, nitro grupa i N-oksidna grupa se istovremeno redukuju, što dovodi do 4-aminopiridina. Kao što je ranije navedeno, N-oksidna grupa također olakšava pojavu reakcija nukleofilne supstitucije. Dakle, kada N-oksid g-nitropiridina reaguje sa hlorovodonikom ili bromovodikom, nastaje N-oksid g-halogeniranog piridina (predložite mehanizam ove reakcije), naknadna reakcija sa PCl3 dovodi do eliminacije N-oksidna grupa.

Kada piridin N-oksid reaguje sa organometalnim jedinjenjima, adicija se dešava pretežno na poziciji 2, odnosno u ovoj reakciji N-oksidna grupa zapravo aktivira ovu poziciju u odnosu na nukleofilni napad. Nakon tretiranja reakcione smjese vodom, formiraju se 2-supstituirani derivati piridina sa visokim prinosom.

Kada piridin N-oksid reaguje sa alkalijama u prisustvu atmosferskog kiseonika (oksidacionog sredstva), nastaje a-hidroksipiridin oksid. Zanimljivo je napomenuti da ovo jedinjenje postoji u tautomernoj ravnoteži sa N-hidroksipiridonom.
Alkilpiridinijumove soli još lakše reaguju sa nukleofilnim reagensima.

Interakcija soli piridinijuma sa nukleofilnim reagensima takođe može dovesti do otvaranja prstena. Dakle, reakcija metilpiridinijum jodida sa anilinom dovodi do acikličkog konjugovanog heterotrienskog sistema. Ova reakcija ima preparativnu vrijednost.
Sam piridin je takođe sposoban da se podvrgne reakcijama nukleofilne adicije, ali, naravno, pod strožim uslovima. Od ovih transformacija, Chichibabin reakcija je od najveće preparativne važnosti - interakcija sa natrijum amidom na 130°C. Ova reakcija se odvija mehanizmom adicije-eliminacije i njen proizvod je a-aminopiridin. Kada piridin reaguje sa kalijum amidom, zajedno sa a-aminopiridinom nastaje i g-aminopiridin.

Kada se zagrije na 400 °C, piridin reaguje sa KOH i formira a-hidroksipiridin, reakcija sa fenillitijumom se odvija na 110 °C tokom 8 sati i nakon tretmana vodom dovodi do a-fenilpiridina.

Do redukcije piridina i njegovih derivata dolazi ili pod dejstvom metalnog natrijuma u alkoholu ili u uslovima katalitičke hidrogenacije. U tom slučaju nastaju heksahidro derivati piridina, au slučaju samog piridina piperidin.
b-Aminopiridin, kada se diazotizira, formira prilično stabilne diazonijumove soli, koje se mogu podvrgnuti uobičajenim transformacijama za ovu klasu jedinjenja, sa i bez oslobađanja dušika. Nasuprot tome, a- i g-aminopiridini sa poteškoćama formiraju diazonijumove soli, a te soli su same po sebi vrlo nestabilne.
Zanimljivo je povući paralelu između sposobnosti hidroksipiridina i hidroksiarena da postoje u tautomernom okso obliku. Formalno, proces uspostavljanja takve ravnoteže u derivatima piridina i benzena trebao bi se odvijati po istom mehanizmu i sastoji se u prijenosu protona iz hidroksi grupe u aromatični ili heteroaromatični prsten. Ovaj proces nije sinhroni, već se odvija u dvije faze, od kojih je prva deprotonacija, odvija se uz učešće rastvarača ili nekog drugog molekula arena i, prirodno, teče lakše što je kiselina jača hidroksilna grupa. Uzimajući u obzir elektron-deficijentnu prirodu piridinskog jezgra, može se tvrditi da je kiselost hidroksipiridina primjetno viša od kiselosti hidroksiarena i da će stoga aktivacijska barijera u slučaju derivata piridina biti niža. Drugi korak je protonacija. Budući da je usamljeni par elektrona atoma dušika u piridinskom prstenu dostupan za elektrofilni napad, posebno za protonaciju, i da postoji djelomični negativni naboj na samom atomu dušika (usp. str. 43), može se pretpostaviti da ovu fazu treba lakše provesti u slučaju derivata piridina. Razmotrimo do čega bi ove transformacije trebale dovesti u zavisnosti od položaja hidroksi grupe u piridinskom prstenu.




Kao što se može vidjeti iz prikazanog dijagrama, u slučaju a- i g-hidroksipiridina, slijed faza protonacije-deprotonacije dovodi do keto forme, a kod b-položaja hidroksi grupe takva transformacija je nemoguća - tj. rezultira formiranjem zwitteriona. Zaista, b-hidroksipiridin postoji u ovom obliku, o čemu svjedoči njegova abnormalno visoka tačka topljenja i niska rastvorljivost u organskim rastvaračima. Naravno, i u slučaju hidroksiarena i u slučaju hidroksipiridina, dotična transformacija dovodi do gubitka aromatičnosti od strane molekule, ali iz gore navedenih razloga ova tautomerna ravnoteža je mnogo karakterističnija za derivate piridina.
Treba napomenuti da kada se u aromatični prsten uvedu dodatne donorske grupe koje olakšavaju protonaciju, keto-enol tautomerna ravnoteža se ostvaruje i za hidroksiarene. Dakle, fleroglucinol - 1,3,5-trihidroksibenzen - postoji uglavnom u keto obliku.

Piridin je slabija baza od alifatskih amina (Kb = 1.7.10-9). Njegov vodeni rastvor postaje lakmus plavi:

Kada piridin reaguje sa jakim kiselinama, nastaju soli piridinijuma:

Aromatična svojstva. Kao i benzen, piridin prolazi kroz reakcije elektrofilne supstitucije, ali je njegova aktivnost u tim reakcijama niža od benzena zbog visoke elektronegativnosti atoma dušika. Piridin se nitrira na 300 °C sa malim prinosom:
Atom dušika u reakcijama elektrofilne supstitucije ponaša se kao supstituent 2. vrste, pa se elektrofilna supstitucija javlja u meta poziciji.
Za razliku od benzena, piridin je sposoban da se podvrgne reakcijama nukleofilne supstitucije, budući da atom azota crpi elektronsku gustinu iz aromatskog sistema, a orto-para pozicije u odnosu na atom azota su osiromašene elektronima. Dakle, piridin može reagirati s natrijum amidom, formirajući mješavinu orto- i para-aminopiridina (Chichibabin reakcija):

Hidrogenacijom piridina nastaje piperidin, koji je ciklički sekundarni amin i mnogo je jača baza od piridina:

Homolozi piridina su po svojstvima slični homolozima benzena. Dakle, kada se bočni lanci oksidiraju, nastaju odgovarajuće karboksilne kiseline:

Predavanje br. 9
Odnos strukture i biološkog djelovanja
Piridin: visoko toksična supstanca. Ima usamljeni par elektrona, tercijarni atom azota, ima jaka osnovna svojstva
Dihidropiridin: koronarni dilatator
Piridin-3-karboksilna kiselina: antipelagričko sredstvo
Piridin-4-karboksilna kiselina: ima antituberkulozno dejstvo
Derivati piridin metanola imaju aktivnost vitamina B6.
Ljekovite tvari dobivene od piridin metanola
Pyridoxine Hydrochloride
Metil 3-hidroksi-4,5 dioksimetil-piridin hidrohlorid
Vitamin B 6 je bijeli, fino-kristalni prah bez mirisa, gorko-kiselog okusa. T pl. - 204 - 206 °C (sa raspadanjem). Lako rastvorljiv u vodi, teško - u alkoholu i acetonu.
piridoksalfosfat
Fosforni estar 2-metil-3-hidroksi 4-fornil 5-hidroksimetil piridina.
Fizička svojstva: Svjetložuti kristalni prah. Slabo rastvorljiv u vodi, nestabilan na svetlosti.
Emoxupine
Etil 3-hidroksi-6-metil-piridin hidrohlorid
Fizička svojstva: bijeli, fino-kristalni prah bez mirisa. Lako rastvorljiv u vodi.
Autentičnost:
Opće reakcije
Reakcija sa 2,6-diklorokinon hlorimidom - nastaje plava indofenolna boja
3. Reakcija stvaranja azo boje (svi lijekovi). Reakcija na fenolni hidroksil.
4. Reakcija sa FeCl 3 do fenolnog hidroksila
Reakcija sa opštim alkaloidnim reagensima (silikonvolframna i fosfovolframska kiselina stvaraju bele taloge).
Reakcije diferencijacije
1. Piridoksin hidrohlorid i Emoksipin daju reakciju na Cl - .
HCl + AgNO 3 AgCl + HNO 3
2. Piridoksal fosfat sadrži aldehidnu grupu, koja se nalazi:
A- reakcija sa Fellingovim reagensom 1 i 2
B- reakcija s amonijačnom otopinom srebrnog nitrata
Piridoksal fosfat, nakon hidrolize, reaguje sa fosfornom kiselinom. Nastaje žuti talog srebrnog fosfata.
H 3 RO 4 + 3AgNO 3 Ag3PO4 + 3HPO4
Piridoksin hidrohlorid pokazuje plavu fluorescenciju pod UV svetlom
5. Spektrofotometrijska metoda (za sve lijekove). Uzmite UV spektar ispitivane supstance Uzmite UV spektar standardne supstance. Moraju biti identični.
kvantitacija
Za piridoksin hidrohlorid i emoksipin
Metoda nevodene titracije
Metoda: direktna titracija
Metoda se zasniva na kiselo-baznoj reakciji u nevodenom mediju
Medij: glacijalna octena kiselina, dodati Hg(CH 3 COO) 2 - za vezanje hlorovodonične kiseline koja se oslobađa tokom titracije
hemija
R 3 N HCl + HClO 4 R 3 NH ClO 4 + HCl
HCl+ Hg(CH 3 COO) 2 →HgCl 2 +CH 3 COOH
Piridoksal fosfat
Spektrofotometrijski u UV području, kroz standardno rješenje.
Alkalometrijska metoda
Metoda direktne titracije za ostatak fosforne kiseline. Metoda se zasniva na kiselo-baznoj reakciji.
Argentometrija
Mercuro- i mercurimeria
Aplikacija
Piridoksin 0,02 i 0,1 g
Piridoksal fosfat 0,01-0,02 g za toksikozu u trudnica, razne vrste parkinsonizma, pelagru i hronični hepatitis
Emoksipin je antioksidans i ima angioprotektivnu aktivnost.
Dostupan u obliku 3% rastvora od 5 ml u ampulama.
pirikarbat (prodektin) 2,6-piridinidetanolabismetilkarbamat
Fizička svojstva: bijeli kristalni prah, bez mirisa. Slabo rastvorljiv u vodi.
T topljenja = 137 – 140 o C
Autentičnost
1. Sa anhidrinom sirćetne kiseline u prisustvu limunske kiseline kada se ne zagreva → žuta boja koja prelazi u trešnje crvenu.
Reakcija piridinskog prstena sa 2,4-dinitrohlorobenzenom. Formira se piridinska boja.
Izvodi se alkalna hidroliza. Oslobađa se metilamin. Crveni lakmus papir postaje plav.
| parmidin |
Metode UV i IR spektroskopije
A. Metoda UV spektroskopije.
Uzima se UV spektar ispitivane supstance.
Uzima se UV spektar standardne supstance. Moraju biti identični.
U UV spektroskopiji, elektromagnetno zračenje apsorbuju elektroni čitavog molekula, a na spektrogramu se uočava jedan maksimum apsorpcije svjetlosti.
λ, nm
B. Metoda IR spektroskopije.
kvantitacija
Metoda nevodene titracije
Metoda: direktna titracija
Derivati dihidropiridina
nifedipin (Corinfar)
2,6-dimetil-4-(2/-nitrofenil)-1,4-dihidropiridin-3,5-dikarboksilna kiselina dimetil estar
Fizička svojstva: Zelenkasto-žuti kristalni prah. Praktično nerastvorljivo u vodi, teško u alkoholu. Raspada se u svijetu. T topljenje \u003d 169-174 o C.
Autentičnost
Metoda UV spektroskopije
Metoda IR spektroskopije
kvantitacija
Uzmi hromatograme.
H ,mm h ,mm
t,min t,min
Autentičnost
kvantitacija
Autentičnost
UV i IR spektroskopija
2. reakcija na alifatsku NH 2 - grupu sa ninhidrinom. Formira se plavo-ljubičasta boja.
kvantitacija
Predavanje br. 9
Ljekovite supstance derivati piridina