Reakcija razgradnje nahco3. Karbonati
Ponekad se sasvim obična i poznata supstanca iz djetinjstva pokaže gotovo panacejom za mnoge bolesti i tegobe. Samo to ne znaju svi. Jedan od ovih spojeva je onaj uobičajeni koji se čuva u svačijem kuhinjskom ormariću. Ispostavilo se da služi ne samo kao sredstvo za poboljšanje kvalitete pečenja, već i kao lijek, odmašćivač, izbjeljivač, pa čak i dezinficijens. Upoznajmo se s ovom tvari detaljnije.
Hemijska baza sode
Tačan naziv za ovo jedinjenje u smislu hemije je natrijum bikarbonat. Postoji niz naziva koji se koriste u svakodnevnom životu i hemiji za označavanje ove supstance:
- sode bikarbone;
- soda bikarbona;
- soda za piće;
- soda bikarbona;
- aditiv E 500.
Međutim, bilo koji od njih odražava jedinu pravu suštinu - ovo je soda.
Empirijska formula
Formula za sodu bikarbonu je NaHCO 3 . Odnosno, po svojoj prirodi, ova tvar se odnosi na kategoriju kiselih. Pošto je jedinjenje formirano od jake alkalije i slabe kiseline, tokom hidrolize (u vodenom rastvoru) doći će do alkalne reakcije medija. Otopina sode bikarbone u vodi ima pH 8,1. lako nastaje interakcijom ugljične kiseline, proces se izražava sljedećom jednadžbom reakcije:
NaOH + H 2 CO 3 \u003d NaHCO 3 + H 2 O
Empirijska formula sode bikarbone pokazuje kvantitativni i kvalitativni sastav jedinjenja, na osnovu čega je moguće izvesti zaključak o prostornoj strukturi molekule: pozitivno nabijeni kation Na + u vanjskoj sferi i negativno nabijen kation. HCO 3 hidrokarbonat jon u unutrašnjem.
Atom ugljika koordinira oko sebe tri atoma kisika, s jednim od kojih formira dvostruku vezu. Takođe, jedan od atoma kiseonika se kombinuje sa katjonom vodonika, formirajući hidrokso grupu. Treći atom kisika u obliku jona povezan je u blizini kationa natrijuma. Tako se kompenziraju valencije svakog elementa koji je dio ovog spoja.
Fizička svojstva
Kakvo god ime dali ovoj tvari - soda bikarbona, piće, karbonat, natrijev bikarbonat - njena formula je i dalje ista i daje predstavu o tome, dakle, izgled sode je fini prah. Boja mu je bijela. Dobro se otopi u vodi i praktično je nerastvorljiv u organskim rastvaračima (na primjer alkohol). Ne raspada se na otvorenom. Počinje da se raspada pri visokoj vlažnosti okoline. Proizvodi potpune razgradnje s povećanjem temperature su natrijev karbonat (srednja sol), ugljični dioksid i voda:
NaHCO 3 \u003d Na 2 CO 3 + CO 2 + H 2 O

Natrijum bikarbonat je bez mirisa, blago slanog ukusa, sa primesama lužine. Kada se otopi u vodi, daje alkalne otopine različitih koncentracija.
Kratke informacije o povijesti otkrića i upotrebe sode
Prve informacije o natrijum bikarbonatu pojavile su se u drevnoj civilizaciji Egipta. Upravo u tim krajevima bilo je raspoređeno nekoliko jezera sa prirodnim izvorima sode. Kada su ova jezera presušila, davali su sodu u obliku bijelog praha, a ljudi su je skupljali. Egipćani su ga koristili kao jednu od komponenti u proizvodnji alata za mumificiranje. Formula za sodu bikarbonu tada još nije bila poznata.
Konkretno, kao hemijsko jedinjenje, supstanca je proučavana mnogo kasnije, oko 18. veka. Tada su se naučnici zainteresovali za ovaj prah, nastao prirodnim putem. Temeljna analiza sastava omogućila je određivanje kvalitativnih i kvantitativnih komponenti jedinjenja. Tako je nastala moderna formula sode bikarbone.
Veliki doprinos razvoju ideja o supstanci i njenim svojstvima dao je italijanski lekar Tullio Simoncini. Posjeduje eksperimente prema čijim rezultatima je soda moguća opcija liječenja kanceroznih tumora. Međutim, do danas ne postoje tačni podaci koji to potvrđuju.

Područja upotrebe
Zbog svoje sposobnosti da se dobro otapa u vodi, kao i interakcije s kiselinama, stvarajući kao rezultat reakcije ugljični dioksid, soda se koristi u nekoliko područja industrije i svakodnevnog života. Naime, kao što su:
- farmaceutika i medicina;
- hemijska industrija;
- laka industrija;
- prehrambena industrija.
Razmotrimo detaljnije svaki od pravaca.
Primjena u medicini
Glavna stvar na kojoj se zasniva upotreba supstance u medicini je njena sposobnost da obnovi vodno-alkalnu ravnotežu u gastrointestinalnom traktu. Jedinjenje NaHCO 3 odnosi se na antacidne tretmane. Formula sode bikarbone ukazuje na prisustvo hidroksidnih jona, koji obavljaju funkciju neutralizacije visoke kiselosti u organizmu. Zbog toga se najčešće za uklanjanje simptoma žgaravice koristi otopina natrijevog bikarbonata u vodi. Međutim, ovo nije jedino područje bolesti gdje se supstanca može koristiti.
- U liječenju prehlade, soda bikarbona ublažava kašalj, jer pomaže u razrjeđivanju i uklanjanju sluzi iz pluća i bronha. Također s njim možete raditi inhalaciju sa SARS-om.
- Soda bikarbona se također koristi kao baktericidno i protuupalno sredstvo. Njegova formula odražava prisustvo vodonikovih katjona H+, koji pružaju ovaj efekat.
- Za liječenje kardiovaskularnih bolesti (aritmije i hipertenzije) koristi se slaba otopina natrijum bikarbonata u vodi.
- Uz proljev i povraćanje, upotreba sode zajedno sa soli omogućava vam da napunite zalihe vode u tijelu i vratite potrebnu ravnotežu.
- Supstanca je sposobna uništiti gljivične bolesti, pa se koristi za uklanjanje gljivica stopala, ispiranje otopinom za drozd i pranje očiju kod upale konjunktive.
- Zbog svojih svojstava izbjeljivanja, soda bikarbona se koristi za pranje zuba.
- Slabo rješenje omogućuje vam da se riješite svrbeža s osipom na koži (ili ubodom insekata).
- Liječenje primarnih opekotina.
- Oslobađanje organizma od soli teških metala.
- Tu je i umor, kao i oslobađanje od viška kilograma pri korištenju tople kupke sa NaHCO 3 i eteričnim uljima.

Mnogo se može reći o prednostima i štetnosti sode bikarbone kada se koristi u medicinske svrhe, uključujući i kozmetologiju. Glavno pravilo korištenja ovog lijeka, kao i svakog drugog lijeka, je da ne zanemarite preporuke o doziranju. Nepravilna upotreba može biti štetna po zdravlje.
Soda bikarbona: formula i upotreba u hemijskoj industriji
Glavna oblast u kojoj se koristi natrijum bikarbonat je kućna hemikalija. Soda bikarbona može djelovati kao blagi abraziv za čišćenje i odmašćivanje površina. Također se koristi kao sirovina u proizvodnji boja, pjena i jedinjenja fluora. Osim toga, sredstva za gašenje požara izrađuju se na bazi NaHCO 3.
Nemoguće je zamisliti kako bi se kućna hemikalija razvila bez natrijum bikarbonata. Soda bikarbona je važna i neophodna komponenta za mnoge hemijske sinteze.
Laka industrija
Soda bikarbona se koristi za površinsku obradu u proizvodnji gume, gumenih potplata i proizvoda. Formula, primjena, šteta i prednosti natrijum bikarbonata u lakoj industriji posebna je tema za proučavanje. Ukratko, uloga NaHCO 3 svodi se na upotrebu u proizvodnji tekstila i umjetne kože. U ovom slučaju šteta se očituje pojavom opekotina ako je kontakt sa supstancom trajao predugo, a ruke nisu bile zaštićene. Prednost je u tome što je soda odličan aditiv i odmašćivač u štavljenju i proizvodnji kože, kao i dobar izbjeljivač tkanina u tekstilnom poslu.
prehrambena industrija
Formula sode bikarbone u hemiji odražava suštinu procesa u reakcijama sa kiselinama. Na primjer, s octenom kiselinom, interakcija će biti opisana sljedećom jednadžbom:
NaHCO 3 + CH 3 COOH \u003d CH 3 COONa + H 2 CO 3
U ovom slučaju nastala ugljena kiselina, kao vrlo nestabilna, odmah se raspada na CO 2 i H 2 O. Upravo na ovoj osobini toka reakcija zasniva se upotreba natrijum bikarbonata u prehrambenoj industriji. Zaista, za proizvodnju pečenja potrebno je sodu ugasiti octom, dodati dobivenu smjesu u tijesto zbog njegove poroznosti i bolje strukture. Reakcija gašenja sode je tipa i praćena je spektakularnim efektom pjene i šištanja.

Upotreba sode čini pečenje vrlo mekim, mirisnim i lijepim, pa je prehrambena industrija jedna od glavnih industrija u kojoj se ova tvar koristi u velikim razmjerima. Natrijum bikarbonat se takođe koristi u pekarstvu, u proizvodnji raznih konditorskih proizvoda. Osim toga, koristi se i za stvaranje mjehurića plina u gaziranim pićima (gazirana voda, šampanjac i pjenušava vina, mineralna voda).
Soda bikarbona: svojstva i liječenje. Šteta i kontraindikacije za upotrebu
Zapravo, upotreba sode je prilično široka u raznim industrijama i domaćinstvima, kao što smo ranije mogli vidjeti. Njegova neobična ljekovita, antibakterijska, izbjeljujuća, umirujuća i ljekovita svojstva koriste se u liječenju raznih tegoba. Međutim, kao i svaki drugi lijek, soda ima i suprotnu stranu. Može biti štetno i vrlo opasno po zdravlje. Njegove indikacije za upotrebu su očigledne, ali ne manje važne su kontraindikacije, koje ćemo detaljnije razmotriti.

Šteta i kontraindikacije za upotrebu
Nekoliko je glavnih razloga zašto soda može postati neprijatelj, a ne prijatelj i pomagač.

Stoga je očigledno da soda bikarbona igra ne samo pozitivnu ulogu za osobu. Korist i šteta, liječenje su dvosmisleni aspekti. Prije nego što svugdje koristite natrijum bikarbonat da biste se riješili raznih tegoba, trebate se posavjetovati sa svojim ljekarom. Ako se soda koristi u svakodnevnom životu (čišćenje površina, izbjeljivanje tkanina i tako dalje), onda ne biste trebali zanemariti najjednostavniji način zaštite za beskontaktno korištenje tvari.
Proizvođač: Rusija, Türkiye
Paket:
Vreće 25kg
vreće od 40 kg
Dodatne informacije o dostavi:
Soda bikarbona (natrijum bikarbonat, natrijum bikarbonat, natrijum bikarbonat) se prevozi svim vidovima transporta (osim vazdušnim) u natkrivenim vozilima. Dozvoljen je transport natrijum bikarbonata cestom u rasutom stanju koristeći specijalizovani transport (kao što je kamion za brašno) ili u posebno napravljenim kontejnerima od nerđajućeg čelika. Specijalizovani fleksibilni kontejneri se prevoze željeznicom otvorenim voznim parkom u vagonskim pošiljkama bez pretovara, sa utovarom i istovarom na kolovozima pošiljaoca (primatelja). Soda bikarbona se čuva u zatvorenim skladištima. Napunjeni specijalizovani mekani kontejneri se skladište kako u natkrivenim skladištima tako i na otvorenim prostorima, u 2-3 nivoa visine.
Preporuke:
Soda bikarbona je fino mljeveni kristalni prah, bijele boje, bez mirisa. Posebnost su blaga alkalna svojstva koja nemaju štetan učinak na životinjska i biljna tkiva. Tačka ključanja - 851 ° C, tačka topljenja - 270 ° C. Gustina - 2,159 g / cm³. Dizajniran za hemijsku, prehrambenu, laku, medicinsku, farmaceutsku industriju, obojenu metalurgiju i trgovinu na malo. Hemijska formula: NaHCO3.
Tehnologija proizvodnje:
Soda se sada vadi industrijskom metodom amonijaka (Solvay metoda). Ekvimolarne količine gasovitog amonijaka i ugljen-dioksida prelaze u zasićeni rastvor natrijum hlorida, odnosno kao da se uvodi amonijum bikarbonat NH4HCO3: NH3 + CO2 + H2O + NaCl → NaHCO3 + NH4Cl. Taloženi ostatak slabo rastvorljivog (9,6 g na 100 g vode na 20 °C) natrijum bikarbonata se filtrira i kalcinira (dehidrira) zagrevanjem na 140 - 160 °C, dok prelazi u natrijum karbonat: 2NaHCO3 → (t) Na2CO3 + CO2 + H2O Nastali ugljen dioksid i amonijak koji se odvajaju od matične tečnosti u prvoj fazi procesa prema reakciji: 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O vraćaju se u proizvodni ciklus. Amonizacija otopine je neophodna da bi se u nju uveo ugljični dioksid, koji je slabo topiv u zasićenoj otopini. Precipitirani natrijum bikarbonat u obliku kristala se filtrira iz rastvora koji sadrži amonijum hlorid i neizreagovani NaCl i kalciniše (kalcinira). U tom slučaju dolazi do stvaranja sode pepela. Za karbonizaciju se koriste plinovi koji se oslobađaju prilikom kalcinacije, a koji sadrže ugljični dioksid CO2. Tako se dio istrošenog ugljičnog dioksida regenerira. Ugljični dioksid neophodan za proces dobiva se pečenjem krečnjaka ili krede. Sagoreni kreč CaO se gasi vodom. Gašeno vapno Ca(OH)2 se pomeša sa vodom. Dobiveno vapneno mlijeko koristi se za regeneraciju amonijaka iz otopine (filterske tekućine) dobivene nakon odvajanja bikarbonata i koja sadrži amonijum hlorid. Za proizvodnju sode koristi se otopina kuhinjske soli (salamuri) koncentracije oko 310 g/l, dobijena u prirodnim uvjetima podzemnim ispiranjem naslaga soli. Osim NaCl, prirodna slana otopina obično sadrži soli kalcija i magnezija. Prilikom amonizacije i karbonizacije slane vode, kao rezultat interakcije ovih nečistoća sa NH3 i CO2, doći će do taloženja, što će dovesti do kontaminacije aparata, poremećaja prijenosa topline i normalnog toka procesa. Stoga se slana otopina prethodno čisti od nečistoća: one se talože dodavanjem strogo određene količine reagensa u salamuru - suspenzije sode u pročišćenoj salamuri i vapnenom mlijeku. Ova metoda čišćenja se naziva soda-vapno. Nastali precipitati magnezijum hidrata i kalcijum karbonata se odvajaju u taložnicima. Prečišćena i bistrena slana sol se šalje u apsorpcionu kolonu sa mehurićima. Gornji dio kolone služi za ispiranje slanom otopinom plina koji vakuum pumpa odsisava iz vakuum filtera i plina iz kolona za karbonizaciju. Ovi plinovi sadrže malu količinu amonijaka i ugljičnog dioksida, koje je preporučljivo oprati svježim slanim rastvorom i tako ih potpunije iskoristiti u proizvodnji. Donji dio kolone služi za zasićenje slane otopine amonijakom koji dolazi iz destilacijske kolone. Rezultirajuća slana otopina amonijaka i soli se zatim šalje u kolonu za karbonizaciju s mjehurićima, gdje se odvija glavna reakcija konverzije sirovine u natrijum bikarbonat. Ugljični dioksid CO2 potreban za ovu svrhu dolazi iz osovinske peći za krečenje i kalcinatora natrijum bikarbonata i ubrizgava se u kolonu odozdo. Karbonizacija amonijačno-solne soli je najvažnija faza u proizvodnji sode. Formiranje natrijum bikarbonata tokom karbonizacije nastaje kao rezultat složenih hemijskih procesa koji se odvijaju u koloni karbonizacije. U gornjem dijelu kolone, amonijev karbonat se formira od amonijaka sadržanog u slanoj otopini i ugljičnog dioksida koji se dovodi u kolonu. Kako slana voda prolazi kroz kolonu od vrha do dna, amonijum karbonat, reagujući sa viškom ugljen-dioksida koji dolazi sa dna kolone, prelazi u amonijum bikarbonat (amonijum bikarbonat). Otprilike u sredini gornjeg nehlađenog dijela kolone počinje reakcija razmjene razgradnje, praćena taloženjem kristala natrijum bikarbonata i stvaranjem amonijum hlorida u rastvoru. U srednjem delu kolone, gde usled egzotermne reakcije dolazi do formiranja kristala natrijum bikarbonata, temperatura slane vode blago raste (do 60 - 65°C), ali je nije potrebno hladiti, jer se temperatura doprinosi stvaranju većih, dobro filtriranih kristala natrijum bikarbonata. Na dnu kolone je neophodno hlađenje da bi se smanjila rastvorljivost natrijum bikarbonata i povećao njegov prinos. U zavisnosti od temperature, sadržaja NaCl u salamuri, stepena zasićenosti amonijakom i ugljen-dioksidom i drugih faktora, prinos bikarbonata je 65-75%. Praktično je nemoguće potpuno pretvoriti kuhinjsku sol u talog natrijum bikarbonata. Ovo je jedan od značajnih nedostataka proizvodnje sode metodom amonijaka.
primjena:
Natrijum bikarbonat (bikarbonat) se koristi u hemijskoj, prehrambenoj, lakoj, medicinskoj, farmaceutskoj industriji, obojenoj metalurgiji, a isporučuje se za trgovinu na malo. Registrovan kao aditiv za hranu E500. Široko se koristi u: - hemijskoj industriji - za proizvodnju boja, pjenaste plastike i drugih organskih proizvoda, fluornih reagensa, kućnih hemikalija, punila u aparatima za gašenje požara, za odvajanje ugljičnog dioksida, sumporovodika iz gasnih smjesa (gas se apsorbira u rastvor bikarbonata na visokom pritisku i niskoj temperaturi, rastvor se redukuje zagrevanjem i sniženim pritiskom). - laka industrija - u proizvodnji gume đona i vještačke kože, proizvodnji kože (štavljenje i neutralizacija kože). - tekstilna industrija (dorada svilenih i pamučnih tkanina). Upotreba natrijevog bikarbonata u proizvodnji gumenih proizvoda također je posljedica oslobađanja CO2 pri zagrijavanju, što doprinosi da guma dobije potrebnu poroznu strukturu. - prehrambena industrija - pekarska, konditorska, pića. - medicinska industrija - za pripremu rastvora za injekcije, antituberkuloznih lekova i antibiotika. - metalurgija - u taloženju retkih zemnih metala i flotaciji ruda.
Pakovanje i skladištenje:
Soda bikarbona pakuje se u četveroslojne, petoslojne papirne vrećice, kao i u specijalizirane mekane posude za jednokratnu upotrebu sa polietilenskom oblogom. Rok trajanja proizvoda. 1 godina od datuma proizvodnje.
Kvalitativni pokazatelji:
Natrijum bikarbonat je bijeli kristalni prah prosječne veličine kristala od 0,05 - 0,20 mm. Molekularna težina jedinjenja je 84,01, gustina je 2200 kg/m³, nasipna gustina je 0,9 g/cm³. Toplota rastvaranja natrijum bikarbonata izračunata je kao 205 kJ (48,8 kcal) po 1 kg NaHCO3, toplotni kapacitet dostiže 1,05 kJ/kg K (0,249 kcal/kg °C). Natrijum bikarbonat je termički nestabilan i pri zagrevanju se raspada da bi formirao čvrsti natrijum karbonat i oslobađao ugljen-dioksid, kao i vodu u gasnu fazu: kJ (- 30 kcal) Vodeni rastvori natrijum bikarbonata se razlažu slično: 2NaHCO3 (r.) ↔ Na2CO3 (r.) + CO2 (g.) + H2O (para) - 20,6 kJ (- 4,9 kcal) Vodeni rastvor natrijum bikarbonata ima blago alkalni karakter, te stoga ne deluje na životinjska i biljna tkiva. Rastvorljivost natrijum bikarbonata u vodi je niska i sa porastom temperature blago raste: sa 6,87 g na 100 g vode na 0 °C na 19,17 g na 100 g vode na 80 °C. Zbog niske rastvorljivosti, gustina zasićenih vodenih rastvora natrijum bikarbonata relativno se malo razlikuje od gustine čiste vode. Tačka ključanja (raspada): 851° C; Tačka topljenja: 270°C; Gustina: 2,159 g/cm³; Rastvorljivost u vodi, g/100 ml na 20°C: 9.
Funkcionalna svojstva:
Hemijska svojstva. Natrijum bikarbonat je kisela natrijumova so ugljene kiseline. Molekularna težina (prema međunarodnim atomskim masama 1971) - 84,00. Reakcija sa kiselinama. Natrijum bikarbonat reaguje sa kiselinama i formira so i ugljenu kiselinu, koja se odmah razlaže na ugljen-dioksid i vodu: NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2 pri kuvanju, takva reakcija sa sirćetnom kiselinom je češća, pri čemu nastaje natrijum acetata: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2 Soda se dobro otapa u vodi. Vodeni rastvor sode bikarbone ima blago alkalnu reakciju. Šištanje sode bikarbone rezultat je oslobađanja ugljičnog dioksida CO2 kao rezultat kemijskih reakcija. Termička razgradnja. Na temperaturi od 60°C, natrijum bikarbonat se razlaže na natrijum karbonat, ugljen-dioksid i vodu (proces razlaganja je najefikasniji na 200°C): 2NaHCO3 → Na2CO3 + H2O + CO2 natrijum karbonat se razlaže na ugljen-dioksid i natrijum oksid: Na2CO3 → Na2O + CO2.
Soda bikarbona ili soda za piće je spoj koji je nadaleko poznat u medicini, kulinarstvu i potrošnji u domaćinstvu. Ovo je kisela sol, čiju molekulu čine pozitivno nabijeni ioni natrija i vodika, anion kiselinskog ostatka ugljične kiseline. Hemijski naziv za sodu je natrijum bikarbonat ili natrijum bikarbonat. Formula jedinjenja prema Hill sistemu: CHNaO 3 (opšta formula).
Razlika između kisele soli i srednje
Ugljena kiselina formira dvije grupe soli - karbonate (srednje) i bikarbonate (kiseline). Trivijalno ime karbonata - soda - pojavilo se u antici. Potrebno je razlikovati prosječne i kisele soli po nazivima, formulama i svojstvima.
Na 2 CO 3 - natrijum karbonat, dinatrijeva so ugljene kiseline, soda za pranje. Služi kao sirovina za proizvodnju stakla, papira, sapuna, koristi se kao deterdžent.
NaHCO 3 - natrijum bikarbonat. Sastav sugerira da je tvar mononatrijeva sol ugljične kiseline. Ovaj spoj se odlikuje prisustvom dva različita pozitivna jona - Na + i H +. Izvana su kristalno bijele tvari slične, teško ih je razlikovati jedna od druge.
Supstanca NaHCO 3 se smatra sodom za piće, a ne zato što se unosi da bi se utažila žeđ. Iako uz pomoć ove supstance možete napraviti gazirano piće. Otopina ovog bikarbonata se uzima oralno uz povećanu kiselost želudačnog soka. U tom slučaju neutralizira se višak H+ protona, koji iritiraju zidove želuca, uzrokuju bol i peckanje.
Fizička svojstva sode bikarbone
Bikarbonat je bijeli monoklinski kristal. Ovo jedinjenje sadrži atome natrija (Na), vodika (H), ugljenika (C) i kiseonika. Gustina supstance je 2,16 g/cm3. Temperatura topljenja - 50-60°C. Natrijum bikarbonat je mlečno-beli prah, čvrsto fino kristalno jedinjenje, rastvorljivo u vodi. Soda bikarbona ne gori, a kada se zagrije iznad 70°C, razlaže se na natrijum karbonat, ugljični dioksid i vodu. U proizvodnim uvjetima češće se koristi granulirani bikarbonat.

Sigurnost sode bikarbone za ljude
Jedinjenje nema miris, okus mu je gorko-slan. Međutim, nije preporučljivo njušiti i kušati supstancu. Udisanje natrijum bikarbonata može izazvati kihanje i kašalj. Jedna upotreba se oslanja na sposobnost sode bikarbone da neutralizira neugodne tvari. Puder se može nanijeti na sportsku obuću kako biste se riješili neugodnih mirisa.
Soda bikarbona (natrijum bikarbonat) je bezopasna u dodiru sa kožom, ali u čvrstom obliku može iritirati sluzokožu očiju i jednjaka. U niskim koncentracijama otopina je netoksična, može se uzimati oralno.
Natrijum bikarbonat: formula jedinjenja
Empirijska formula CHNaO 3 rijetko se nalazi u jednadžbama kemijskih reakcija. Činjenica je da ne odražava odnos između čestica koje formiraju natrijum bikarbonat. Formula koja se obično koristi za karakterizaciju fizičkih i hemijskih svojstava supstance je NaHCO 3 . Međusobni raspored atoma odražava se modelom molekula sa sfernim štapićem:

Ako iz periodnog sistema saznate vrijednosti atomskih masa natrijuma, kisika, ugljika i vodika. tada možete izračunati molarnu masu supstance natrijum bikarbonata (formula NaHCO 3):
Ar(Na) - 23;
Ar(O) - 16;
Ar(C) - 12;
Ar(H) - 1;
M (CHNaO 3) \u003d 84 g / mol.
Struktura materije
Natrijum bikarbonat je jonsko jedinjenje. Sastav kristalne rešetke uključuje natrijev kation Na +, koji zamjenjuje jedan atom vodika u ugljičnoj kiselini. Sastav i naboj anjona - HCO 3 -. Kada se rastvori, dolazi do djelomične disocijacije na jone koji formiraju natrijum bikarbonat. Strukturna formula izgleda ovako:

Rastvorljivost sode bikarbone u vodi
7,8 g natrijum bikarbonata se rastvara u 100 g vode. Supstanca se podvrgava hidrolizi:
NaHCO 3 \u003d Na + + HCO 3 -;
H 2 O ↔ H + + OH -;
Prilikom zbrajanja jednadžbi ispada da se hidroksidni ioni akumuliraju u otopini (slabo alkalna reakcija). Tečnost postaje fenolftalein ružičasta. Boja univerzalnih indikatora u obliku papirnatih traka u otopini sode mijenja se od žuto-narančaste do sive ili plave.
Reakcija zamjene s drugim solima
Vodeni rastvor natrijum bikarbonata ulazi u reakcije jonske izmene sa drugim solima, pod uslovom da je jedna od novo dobijenih supstanci nerastvorljiva; ili se formira gas koji se uklanja iz reakcione sfere. Prilikom interakcije sa kalcijum hloridom, kao što je prikazano na donjem dijagramu, dobijaju se i bijeli talog kalcijum sarbonata i ugljični dioksid. Joni natrijuma i klorida ostaju u otopini. Jednačina molekularne reakcije:

Interakcija sode za piće sa kiselinama
Natrijum bikarbonat je u interakciji sa kiselinama. Reakcija ionske izmjene je praćena stvaranjem soli i slabe ugljične kiseline. U trenutku prijema se razlaže na vodu i ugljični dioksid (ispari).
Zidovi ljudskog želuca proizvode hlorovodoničnu kiselinu koja postoji u obliku jona.
H + i Cl - . Ako se natrijum bikarbonat uzima oralno, u rastvoru želučanog soka javljaju se reakcije uz učešće jona:
NaHCO 3 \u003d Na + + HCO 3 -;
HCl \u003d H + + Cl -;
H 2 O ↔ H + + OH -;
HCO 3 - + H + \u003d H 2 O + CO 2.
Liječnici ne preporučuju stalnu upotrebu natrijum bikarbonata za hiperaciditet želuca. U uputama za preparate navode se različiti neželjeni efekti svakodnevne i dugotrajne upotrebe sode za piće:
- povišen krvni pritisak;
- podrigivanje, mučnina i povraćanje;
- anksioznost, loš san;
- gubitak apetita;
- bol u stomaku.

Dobivanje sode bikarbone
U laboratoriji se natrijum bikarbonat može dobiti iz sode pepela. Ista metoda je ranije korištena u hemijskoj proizvodnji. Moderna industrijska metoda temelji se na interakciji amonijaka s ugljičnim dioksidom i niskoj topljivosti sode bikarbone u hladnoj vodi. Amonijak i ugljični dioksid (ugljični dioksid) prolaze kroz otopinu natrijum hlorida. Nastaju amonijum hlorid i rastvor natrijum bikarbonata. Prilikom hlađenja, rastvorljivost sode bikarbone se smanjuje, tada se tvar lako odvaja filtriranjem.
Gdje se koristi natrijum bikarbonat? Upotreba sode bikarbone u medicini
Mnogi ljudi znaju da atomi metalnog natrijuma snažno stupaju u interakciju s vodom, čak i s njenom parom u zraku. Reakcija počinje aktivno i praćena je oslobađanjem velike količine topline (sagorijevanje). Za razliku od atoma, joni natrija su stabilne čestice koje ne oštećuju živi organizam. Naprotiv, oni aktivno učestvuju u regulisanju njegovih funkcija.
Kako se koristi supstanca koja je netoksična za ljude i korisna u mnogim aspektima - natrijum bikarbonat? Aplikacija se temelji na fizičkim i kemijskim svojstvima sode bikarbone. Najvažnije oblasti su potrošnja domaćinstava, prehrambena industrija, zdravstvo, tradicionalna medicina i pića.
Među glavnim svojstvima natrijum bikarbonata su neutralizacija povećane kiselosti želudačnog soka, kratkoročno otklanjanje bolova kod hiperacidnosti želudačnog soka, čira na želucu i dvanaestopalačnom crevu. Antiseptički učinak otopine sode bikarbone koristi se u liječenju upale grla, kašlja, intoksikacije, bolesti kretanja. Isperite ih ustima i nosom, sluzokožom očiju.

Široko se koriste različiti oblici doziranja natrijevog bikarbonata, na primjer, prašci koji se otapaju i koriste za infuziju. Dodijeliti otopine za oralnu primjenu od strane pacijenata, oprati opekotine kiselinama. Natrijum bikarbonat se takođe koristi za pravljenje tableta i rektalnih supozitorija. Upute za pripravke sadrže detaljan opis farmakološkog djelovanja, indikacije. Lista kontraindikacija je vrlo kratka - individualna netolerancija na supstancu.
Upotreba sode bikarbone kod kuće
Natrijum bikarbonat je "hitna pomoć" za žgaravicu i trovanje. Uz pomoć sode za piće kod kuće, izbijelite zube, smanjite upale kod akni, obrišite kožu kako biste uklonili višak masnih sekreta. Natrijum bikarbonat omekšava vodu, pomaže u čišćenju prljavštine sa raznih površina.
Prilikom ručnog pranja vunene trikotaže u vodu možete dodati sodu bikarbonu. Ova tvar osvježava boju tkanine i uklanja miris znoja. Često se prilikom peglanja svilenih proizvoda pojavljuju žuti tragovi opekotina od glačala. U ovom slučaju pomoći će vam kaša od sode bikarbone i vode. Supstance treba pomiješati što je prije moguće i nanijeti na mrlju. Kada se kaša osuši, treba je četkati, a proizvod isprati hladnom vodom.
U reakciji sa sirćetnom kiselinom dobija se natrijum acetat i brzo se oslobađa ugljični dioksid koji pjeni cijelu masu: NaHCO 3 + CH 3 COOH = Na + + CH 3 COO - + H 2 O + CO 2. Ovaj proces se dešava kad god se u proizvodnji gaziranih pića i konditorskih proizvoda soda bikarbona "gasi" sirćetom.

Okus pečenja bit će nježniji ako koristite ne sintetičko sirće iz trgovine, već limunov sok. U ekstremnim slučajevima možete ga zamijeniti mješavinom od 1/2 žličice. limunske kiseline u prahu i 1 žlica. l. vode. U testo se među zadnjim sastojcima dodaje soda bikarbona sa kiselinom, tako da možete odmah staviti pecivo u rernu. Osim natrijum bikarbonata, amonijum bikarbonat se ponekad koristi kao sredstvo za dizanje.
Vazduh, filtrirana tečnost i voda za pranje iz unutrašnjosti bubnja 7 idu u separator 11, gde se vazduh odvaja od tečne faze i odlazi u PVFL.
Filtrat iz separatora 11 ide kroz barometarsku cijev 12 u sakupljanje filterske tekućine 13, odakle se pumpom 14 ispumpava radi destilacije.
Kada se bubanj okreće, sloj natrijum bikarbonata koji je prianjao na površinu filtera pada ispod valjka za ceđenje 6 kako bi se eliminisale pukotine nastale na površini sedimenta, kroz koje vazduh i voda za pranje mogu da uđu u bubanj. Nakon valjka za cijeđenje, talog se ispere slabom tekućinom ili vodom koja dolazi iz tlačnog rezervoara 4 za vodu za pranje u korito 3, čime se voda ravnomjerno raspoređuje po širini bubnja. Količina vode koja se isporučuje za pranje reguliše se slavinom postavljenom između rezervoara pod pritiskom 4 i korita 3. Voda za pranje se meša sa tečnošću filtera unutar bubnja i sa njom odlazi u separator 11.
Isprani natrijum bikarbonat se ponovo sabija drugim valjkom za ceđenje 6 u smeru rotacije bubnja, suši se vazduhom usisanim kroz sloj sedimenta, dovodi kroz cevovod 5 i nožem 8 odseca od filterske tkanine do transporter 10, koji dovodi sirovi natrijum bikarbonat u pećnicu za soda.
Kalcinacija natrijum bikarbonata
Kalcinacija - termička razgradnja natrijum bikarbonata - je završna faza u proizvodnji sode pepela. Glavna svrha odjela za kalcinaciju je dobivanje određene količine sode pepela u obliku kontinuiranog protoka materijala.
Tehnički natrijum bikarbonat treba da bude bele boje. Pojava boje ukazuje na koroziju čeličnih posuda u dijelu apsorpcije i karbonizacije. Talog je obojen oksidom željeza, koji ulazi u njega kao rezultat korozije.
Proces kalcinacije može se prikazati jednadžbom:
2 NaHCO3 (čvrsta) \u003d Na2CO3 (čvrsta) + CO2 (gas) + H2O (para).
Pored ove glavne reakcije, kada se tehnički bikarbonat zagrijava, mogu se javiti dodatne reakcije:
(NH4)2CO3↔2NH3(plin)+CO2(plin)+H2O(para),
NH4 HCO3↔2NH3(gas)+CO2(gas)+H2O(para).
Amonijum hlorid reaguje kada se zagreje sa natrijum bikarbonatom u skladu sa reakcijom
NH4Cl (sol.) + NaHCO3 (čvrsto stanje) ↔NaCl (čvrsto) + NH3 (gas) + CO2 (gas) + H2O.
Natrijum karbamat u prisustvu vode, kada se zagrije, prema reakciji prelazi u sodu
2NaCO2NH2 + H2O ↔ Na2CO3 (čvrsta) + CO2 (gas) + 2NH3 (gas).
Tako, kao rezultat kalcinacije, Na2CO3 i NaCl ostaju u čvrstoj fazi, dok NH3, CO2 i H2O prelaze u gasnu fazu.
Prisustvo vlage u bikarbonatu otežava instrumentaciju, budući da vlažni natrijum bikarbonat slabo teče, nakuplja se i lijepi se za zidove aparata. Ovo posljednje se objašnjava činjenicom da vlaga, koja je zasićena otopina NaHCO3, brzo isparava nakon kontakta s vrućom površinom. Taložena čvrsta faza, kristalizirajući, formira koru koja čvrsto prianja uz površinu.
Čvrsti sloj sode, koji ima nisku toplotnu provodljivost, otežava prenos toplote, a u soda pećima koje se zagrevaju izvana dimnim gasovima dovodi do pregrijavanja i izgaranja zida peći. Za suzbijanje ove pojave, vlažni natrijum bikarbonat se pomeša sa vrelom sodom (retur). U tom slučaju nastaje nova čvrsta faza - trona (NaHCO3 Na2CO3 2 H2O). Slobodna vlaga se vezuje za kristalizaciju i proizvod postaje slobodno tečan.
Prilikom kalcinacije natrijum bikarbonata i trona, CO2, NH3 i vodena para se oslobađaju u gasnu fazu. Amonijak i ugljični dioksid treba vratiti u proizvodnju. Ugljični dioksid se koristi u procesu karbonizacije amonizirane otopine soli, za koju je korisno imati plin s visokim sadržajem CO2.
Proces kristalizacije se može podijeliti u tri vremenska perioda. Prvi period karakteriše brz porast temperature. Raspadanje bikarbonata se ne primećuje, a sva toplota se troši na zagrevanje materijala, uklanjanje kristalizacione vode iz trona i razgradnju ugljikovih amonijum soli. Drugi period karakteriše konstantnost temperature materijala (t~125°C). Dovedena toplota se troši na termičku razgradnju NaHCO3. treći period, temperatura reakcione mase počinje naglo da raste. To ukazuje da je proces razgradnje bikarbonata završio i dovedena toplina se troši na zagrijavanje nastale sode. U praksi, da bi se ubrzao proces razgradnje NaHCO3, temperatura sode na izlazu iz peći održava se unutar 140–160°C.
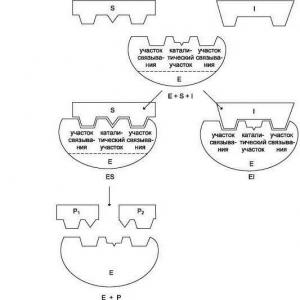
Tehnološka shema procesa kalcinacije
Rice. 11. Šema odvajanja kalcinacije:
1- kondenzator pare; 2- mikser za hranu; 3.15 - hranilice ćelija; 4.10 - trakasti transporteri; 5 - vibrirajuća hranilica, 6 - bunker; 7-plužni izbacivač; 8,9,14,16 transportera; 11-ciklon; 12-kolektor plina za kalcinaciju; 13-separator 17-kolektor kondenzata; 18 centrifugalnih pumpi; 19-sakupljač slabe tečnosti; 20-kalcinacijski plinski hladnjak 21-redukciona rashladna jedinica (ROU); 22-kalcinacijski plin za pranje 23-sabirnik tekućine za pranje.
Vlažni natrijum bikarbonat ispran na filterima sa zajedničkog trakastog transportera 10 sa plugom ejektorom 7 ubacuje se u kantu 6 vibracionog dodavača 5, odakle se vibracionim dozatorom i trakastim transporterom 4 dovodi u mešalicu 2. hranilica ćelija 3. u ciklonu 11.
Tron pripremljen u mikseru šalje se u prstenasti prostor bubnja kalcinatora 1. Kao rezultat termičke obrade, tronovi dobijaju soda pepel i gasove kalcinacije. Soda pepeo se kroz ćelijski dozator 15 uklanja iz kalcinatora i ulazi u sistem transportera 8, 9, 16. Soda se iz kosog transportera 8 uzima kroz hranilicu u mikser. Ostatak sode transportera 9, 14 se dovodi u skladište.
Kalcinacijski plinovi se uklanjaju iz kalcinatora preko miješalice 2, u kojoj se pomoću kompresora stvara vakuum. Na putu do kompresora gasovi se podvrgavaju hemijskom čišćenju u ciklonima 11 i mokrom čišćenju u radnom kolektoru kalcinacionog gasa 12 i peraču 22. Pre mašine za pranje, kalcinacioni gasovi se hlade u frižideru 20.
Za navodnjavanje se takozvana slaba tečnost dovodi u kolektor kalcinacionog gasa, koji nastaje pri kondenzaciji vodene pare u hladnjaku kalcinacionog gasa. Ova tečnost, u kontaktu sa gasom, delimično apsorbuje amonijak i prašinu sode, a zatim se odvodi u zbirku 19.
U hladnjaku 20, plin prolazi odozgo prema dolje kroz prstenasti prostor, a rashladna voda se kreće u protustruji u cijevima. Da bi se spriječila kristalizacija cijevi hladnjaka i da bi se plin bolje isprao od prašine sode, prstenasti prostor se navodnjava slabom tekućinom. U mašini za pranje gasa se navodnjava vodom, dok se dodatno hladi i potpuno ispere od sode i amonijaka.
Para visokog pritiska se dovodi za zagrijavanje kalcinatora. Prije nego što se unese u kalciner, prolazi kroz redukcijsku rashladnu jedinicu (ROU), gdje se njegova temperatura snižava na 270°C i pritisak na 3 MPa. U cijevima kalcinatora para se kondenzira, odajući toplinu kalciniranom materijalu. Kondenzat iz kalcinatora se ispušta u kolektor kondenzata 17 i dalje u ekspandere, gdje se pretvara u paru niskog pritiska.
Natrijum karbonat Na 2 CO 3. soda pepela. Bijeli, topi se i raspada kada se zagrije. Osjetljiv na vlagu i ugljični dioksid u zraku. Formira dekahidrat ( kristalna soda). Dobro se rastvori u vodi, hidrolizira se na anjonu, stvara jako alkalnu sredinu u rastvoru. Razloženo jakim kiselinama. Restaurirano koksom. Ulazi u reakcije jonske izmjene.
Kvalitativna reakcija na CO 3 2- ion - stvaranje bijelog taloga barij karbonata, razloženog jakim kiselinama (HCl, HNO 3) uz oslobađanje ugljičnog dioksida.
Koristi se za sintezu jedinjenja natrijuma, otklanjanje "trajne" tvrdoće slatke vode, u proizvodnji stakla, sapuna i drugih deterdženata, celuloze, mineralnih boja i emajla. U prirodi se nalazi u mlevenim salamuri, salamuri slanih jezera.
Jednačine najvažnijih reakcija:

Potvrda V industrija (solva način, 1861–1863):
a) mješavina NH 3 i CO 2 propušta se kroz zasićeni rastvor NaCl:
NaCl + NH 3 + H 2 O + CO 2 = NH 4 Cl + NaHCO 3 ↓
(pod ovim uslovima, soda bikarbona je slabo rastvorljiva);
b) Talog NaHCO 3 je podvrgnut dehidraciji ( kalcinacija):
2NaHCO 3 = Na2CO3+ H 2 O + CO 2
Kalijum karbonat K 2 CO 3. Oksosol. tehnički naziv potash. Bijela, higroskopna. Topi se bez raspadanja, razgrađuje se daljim zagrijavanjem. Osjetljiv na vlagu i ugljični dioksid u zraku. Vrlo dobro se rastvara u vodi, hidrolizira se na anjonu, stvara jako alkalno okruženje u rastvoru. Razloženo jakim kiselinama. Ulazi u reakcije jonske izmjene.
Koristi se u proizvodnji optičkog stakla, tečnog sapuna, mineralnih boja, mnogih jedinjenja kalijuma, kao sredstvo za dehidrataciju.
Jednačine najvažnijih reakcija:

Potvrda V industrija :
a) zagrevanje kalijum sulfata [prirodne sirovine - minerali Cainite KMg(SO 4)Cl 3H 2 O i shönite K 2 Mg (SO 4) 2 6H 2 O] sa gašenim vapnom Ca (OH) 2 u atmosferi CO (pritisak = 15 atm):
K 2 SO 4 + Ca (OH) 2 + 2CO \u003d 2K (HCOO) + CaSO 4
b) kalcinacija kalijum formata K(HCOO) na vazduhu:
2K(HCOO) + O 2 \u003d K 2 CO 3 + H 2 O + CO 2
Natrijum bikarbonat NaHCO 3 . Kiseli oksosol. tehnički naziv soda za piće. Bijeli puder u prahu. Razgrađuje se bez topljenja kada se lagano zagrije; kada je vlažan, počinje da se raspada na sobnoj temperaturi. Umjereno rastvorimo u vodi, u maloj mjeri se hidrolizira na anjonu. Razloženo kiselinama, neutralizovano alkalijama. Ulazi u reakcije jonske izmjene.
Kvalitativna reakcija na HCod ion - formiranje bijelog taloga barij karbonata pod djelovanjem baritne vode i razlaganje taloga jakim kiselinama (HCl, HNO 3) uz oslobađanje ugljičnog dioksida. Koristi se u prehrambenoj industriji kao lijek.
Jednačine najvažnijih reakcija:

Potvrda: zasićenje otopine Na 2 CO 3 (vidi) ugljičnim dioksidom.
Kalcijum karbonat CaCO 3. Oksosol. Uobičajena prirodna supstanca, glavna komponenta sedimentne stijene je krečnjak (njegove sorte su kreda, mermer, krečnjak, lapor), čisti CaCO 3 u prirodi je mineral kalcit. Bijela, raspada se pri paljenju, topi se pod pritiskom CO2. Nerastvorljivo u vodi (= 0,0007 g/100 g H 2 O).
Reaguje sa kiselinama, amonijum solima u vrućem rastvoru, koksom. Prebacuje se u rastvor dejstvom viška ugljen-dioksida uz stvaranje bikarbonata Ca (HCO 3) 2 (postoji samo u rastvoru), koji određuje „privremenu“ tvrdoću slatke vode (zajedno sa solima magnezijuma i gvožđa). Otklanjanje tvrdoće (omekšavanje vode) vrši se kuhanjem ili neutralizacijom gašenim vapnom.
Koristi se za proizvodnju CaO, CO 2, cementa, stakla i mineralnih đubriva [uključujući kreč nitrat Ca (NO 3) 2 4H 2 O], kao punilo za papir i gumu, građevinski kamen (lomljeni kamen) i komponentu betona i škriljevca, u obliku istaloženog praha - za izradu školskih bojica, praha za zube i paste, mješavine za krečenje prostorija.
Jednačine najvažnijih reakcija: