Mehanizam mišićnih kontrakcija. Funkcije i svojstva skeletnih mišića
Želudac i crijeva, promjene u tonusu krvnih žila, održavanje tonusa mjehura - uzrokovani su kontrakcijom glatkih mišića. Rad srca se osigurava kontrakcijom srčanih mišića.
Enciklopedijski YouTube
1 / 3
Tropomiozin i troponin i njihova uloga u kontroli kontrakcije mišića
Kontrakcija mišića (aktinski i miozinski filamenti)
Struktura mišićne ćelije
Titlovi
U prošloj lekciji naučili smo kako miozin – ili bolje rečeno miozin II, koji ima dvije glave na dva lanca isprepletena jedna s drugom – kako miozin II stupa u interakciju sa ATP-om i zatim nekako gura ili klizi duž aktinskih filamenata. Na početku se vezuje miozin. ATP se zatim vezuje za miozinsku glavu. Miozin se odvaja od aktina. ATP se hidrolizira u ADP i fosfate. Ovo oslobađa energiju. Dovodi miozin u stanje visoke energije. Zahvaljujući ovoj energiji, miozin se vezuje za sledeći deo aktinskog filamenta; fosfatna grupa se tada oslobađa, uzrokujući da protein promijeni oblik. U tom slučaju, energija akumulirana miozinom usmjerava se da djeluje na aktinska vlakna. Miozin se pomera ulevo ili aktin udesno, u zavisnosti od ugla gledanja. U narednim lekcijama ćemo govoriti o tome za šta su vezani aktin i miozin. Vjerovatno imate nekoliko pitanja. Glava miozina je potrošila toliko energije da potisne aktinsko vlakno. A u isto vrijeme vjerovatno je bila izložena otporu ili drugim silama. Šta se dešava kada se prekine? U sljedećoj fazi ciklusa, kada se ATP ponovo veže za njega, hoće li se aktinski filament vratiti u prvobitni položaj? Posebno pod uticajem napetosti. Morate shvatiti da na aktin ne utiče samo ova glava miozina. Ima mnogo drugih. Nalaze se duž cijelog aktinskog lanca. I tu i tamo. I svi rade u svom ritmu. A kada su neki od njih odvojeni, drugi su u fazi „pokretanja snage“, a treći su pričvršćeni. Ne radi se o tome da se jedna glava miozina odvoji - i aktinski filament se vraća u prvobitni položaj. Drugo pitanje: šta pokreće i zaustavlja ovaj proces? Na kraju krajeva, mi kontrolišemo svoje mišiće. Dakle, šta pokreće proces klizanja miozina duž aktinskih vlakana? Dva druga proteina obavljaju ovu ulogu. Tropomiozin i troponin. Zapisaću to. Tropomyosin. I to u drugoj boji - troponin. Sada ću shematski prikazati aktinski filament. Evo ga. Ovo je moj aktinski filament. To je zapravo spiralna struktura. Dodaću drugi red. To je poput udubljenja spirale; tačnost slike nam sada nije važna. U prošloj lekciji pogledali smo djelovanje miozinskih glava. Oni prolaze kroz određeni ciklus, u različitim fazama kojih primaju i odaju energiju, mijenjaju oblik i vraćaju se u prvobitno stanje. Ali postoji i protein povezan s aktinom - tropomiozin. Čini se da je omotan oko aktina. Ja ću crtati. Ovo je aktin. Ovo je jedna od glava miozina II. Myosin. A evo i tropomiozina. Umotana je oko aktina. Šematski ću prikazati - ovako je namotan - isprekidanom linijom označit ću nevidljivi dio lanca tropomiozina. Puna linija - vidljiva i tako dalje. Tropomiozin se obavija oko aktinskog lanca. Tropomiozin je vezan za aktin pomoću drugog proteina koji se zove troponin. Recimo da se prilaže ovdje - ovo je, naravno, shematski dijagram - ovdje i ovdje ... uz pomoć troponina. Zapisaću to. Tropomiozin je označen svijetlozelenom bojom. A troponin je poput noktiju koji pričvršćuje tropomiozin za aktin. Kada se mišić ne kontrahira, tropomiozin ne proizvodi miozin... Zapravo, proces još nije u potpunosti shvaćen. Istraživanja se nastavljaju. Ali izgleda da tropomiozin sprečava da se miozinska glava veže za aktinski lanac i klizi duž njega; a kada je glava već pričvršćena za aktinski lanac, tropomiozin sprečava njeno odvajanje i time eliminiše mogućnost takvog klizanja. Dakle, tropomiozin blokira miozinsku glavu, blokira miozinsku glavu - ovdje imamo miozinsku glavu - i sprječava je da klizi duž aktinskih vlakana... ne dozvoljava joj da klizi duž aktinskih vlakana... Ili fizički blokira mjesto za vezivanje, ili - glava je već pričvršćena - eliminiše mogućnost njenog odvajanja. U oba slučaja, interakcija sa aktinom je nemoguća; Da bi deblokirali glavu, troponini moraju promijeniti oblik. A mogu promijeniti oblik samo uz visoku koncentraciju kalcija. Ako imamo dovoljan broj iona kalcija visoke koncentracije, neki od ovih jona će se pridružiti troponinu; zbog toga će se promijeniti konformacija, odnosno oblik troponina. To će zauzvrat promijeniti oblik tropomiozina. Zapisaću to. Tropomyosin ima funkciju blokiranja; ali pri visokoj koncentraciji kalcijevih jona, takvi se ioni vezuju za troponin, što mijenja konformaciju troponina i „isključuje“ blokirajuću funkciju tropomiozina. ... "isključuje" blokirajuću funkciju tropomiozina... Dakle, visoka koncentracija jona kalcijuma, vezujući se za troponin, "isključuje" tropomiozin... I sada su se pojavili uslovi sa kojima smo započeli prošlu lekciju: miozin i aktin mogu uticati jedni na druge - guranje, klizanje... mogu se nazvati drugačije. A ako se koncentracija kalcija smanji - niska koncentracija kalcijevih jona - takve ione oslobađa troponin. Ako ioni kalcija postanu oskudni, ioni koje drži troponin se oslobađaju. Kao rezultat, troponin se vraća u svoju prvobitnu konformaciju. ...troponin se vraća... I tropomiozin ponovo počinje da blokira miozin. ...dopušta tropomiozinu da ponovo blokira miozin... Naravno, ovaj mehanizam se ne može nazvati jednostavnim. Otkriven je nedavno - prije 50-60 godina. Zamislite koliko je eksperimenata već provedeno i još će biti potrebno... Ali sama shema nije komplikovana. Kada postoji nedostatak kalcijuma, tropomiozin blokira sposobnost miozina da se veže za aktinski lanac i stupi u interakciju s njim. Pri dovoljno visokoj koncentraciji kalcija, njegovi ioni se vezuju za troponin, koji usidri tropomiozin za aktinski lanac, joni kalcija mijenjaju konformaciju troponina, tropomiozin se odvaja - i miozin može obaviti svoj posao. Možete shematski zamisliti mehanizam kontrakcije mišića i kontrolu takve kontrakcije. Ako je u ćeliji visoka koncentracija kalcija, mišić će se kontrahirati. Ako je koncentracija kalcija niska, troponin će osloboditi ione, miozin će biti blokiran, a mišić će se opustiti. Titlovi Amara.org zajednice
Uvod
Osnova svih vrsta mišićne kontrakcije je interakcija aktina i miozina. U skeletnim mišićima, miofibrili (oko dvije trećine suhe težine mišića) su odgovorni za kontrakciju. Miofibrile su strukture debljine 1 - 2 µm, koje se sastoje od sarkomera - struktura dužine oko 2,5 µm, koje se sastoje od aktinskih i miozinskih (tankih i debelih) filamenata i Z-diskova povezanih sa aktinskim filamentima. Do kontrakcije dolazi povećanjem koncentracije Ca 2+ jona u citoplazmi kao rezultat klizanja miozinskih filamenata u odnosu na aktinske filamente. Izvor energije kontrakcije je ATP. Efikasnost mišićne ćelije je oko 50%, mišić u cjelini ne više od 20%. Maksimalna mišićna snaga se ne postiže u stvarnim uslovima; Ne koriste se sve mišićne ćelije u isto vrijeme i kontrahiraju se maksimalnom snagom, u suprotnom, kada se mnogi skeletni mišići stežu, tetive ili kosti će biti oštećene (što se ponekad opaža kod jakih grčeva). Efikasnost mišića zavisi i od spoljašnjih uslova; na primjer, na hladnoći se značajno smanjuje, jer je tijelu važnije održavati tjelesnu temperaturu.
Klizanje miozina u odnosu na aktin
Glave miozina razgrađuju ATP i zbog oslobođene energije mijenjaju konformaciju, klizeći duž aktinskih filamenata. Ciklus se može podijeliti u 4 faze:
- Slobodna glava miozina se veže za ATP i hidrolizira ga u ADP i fosfat i ostaje povezana s njima. (Reverzibilni proces - energija oslobođena kao rezultat hidrolize pohranjuje se u promijenjenoj konformaciji miozina).
- Glave se slabo vežu za sljedeću aktinsku podjedinicu, fosfat se oslobađa, a to dovodi do snažnog vezivanja miozinske glave za aktinski filament. Ova reakcija je već nepovratna.
- Glava prolazi kroz konformacijsku promjenu koja povlači debelu nit prema Z-disku (ili, ekvivalentno, slobodne krajeve tankih filamenata jedan prema drugom).
- ADP se oslobađa, zbog čega se glava odvaja od aktinskog filamenta. Spoji se novi ATP molekul.
Ciklus se zatim ponavlja sve dok se koncentracija Ca 2+ jona ne smanji ili se zalihe ATP-a ne iscrpe (kao rezultat ćelijske smrti). Brzina klizanja miozina duž aktina je ≈15 μm/sec. U filamentu miozina ima mnogo (oko 500) molekula miozina i, stoga, tokom kontrakcije, ciklus se ponavlja stotinama glava odjednom, što dovodi do brze i snažne kontrakcije. Treba napomenuti da se miozin ponaša kao enzim - aktin zavisna ATPaza. Pošto je svako ponavljanje ciklusa povezano sa hidrolizom ATP-a, a samim tim i sa pozitivnom promjenom slobodne energije, proces je jednosmjeran. Miozin se kreće duž aktina samo prema plus kraju.
Izvor energije za smanjenje
Za kontrakciju mišića koristi se energija hidrolize ATP-a, ali mišićna ćelija ima izuzetno efikasan sistem za regeneraciju zaliha ATP-a, tako da je u opuštenom i radnom mišiću sadržaj ATP-a približno jednak. Enzim fosfokreatin kinaza katalizuje reakciju između ADP i kreatin fosfata, čiji su produkti ATP i kreatin. Kreatin fosfat sadrži više uskladištene energije nego ATP. Zahvaljujući ovom mehanizmu, tokom naleta aktivnosti u mišićnoj ćeliji, sadržaj kreatin fosfata opada, ali se količina univerzalnog izvora energije – ATP – ne mijenja. Mehanizmi za regeneraciju rezervi ATP-a mogu varirati u zavisnosti od parcijalnog pritiska kiseonika u okolnim tkivima (videti Anaerobni organizmi).
Regulatorni mehanizam
U regulaciji mišićne aktivnosti uglavnom su uključeni neuroni, ali postoje slučajevi kada hormoni (na primjer, adrenalin i oksitocin) kontroliraju i kontrakciju glatkih mišića. Signal kontrakcije se može podijeliti u nekoliko faza:
Od stanične membrane do sarkoplazmatskog retikuluma
Učinak transmitera koji se oslobađa iz motornog neurona uzrokuje akcioni potencijal na ćelijskoj membrani mišićne ćelije, koji se dalje prenosi pomoću posebnih membranskih invaginacija zvanih T-tubule, koje se protežu od membrane u ćeliju. Iz T-tubula signal se prenosi u sarkoplazmatski retikulum - poseban odjeljak spljoštenih membranskih vezikula (endoplazmatski retikulum mišićne ćelije) koji okružuje svaku miofibrilu. Ovaj signal uzrokuje otvaranje Ca 2+ kanala u membrani retikuluma. Povratni Ca 2+ joni ulaze u retikulum uz pomoć membranskih kalcijum pumpi - Ca 2+ -ATPaze.
Od oslobađanja Ca 2+ jona do kontrakcije miofibrila
Da bi se kontrolisala kontrakcija, protein tropomiozin i kompleks od tri proteina - troponin (podjedinice ovog kompleksa nazivaju se troponini T, I i C) su vezani za aktinski filament. Troponin C je blizak homolog drugog proteina, kalmodulina. Postoji samo jedan troponinski kompleks koji se nalazi na svakih sedam aktinskih podjedinica. Vezivanje aktina za troponin I pomera tropomiozin u položaj koji ometa vezivanje miozina za aktin. Troponin C se vezuje za četiri Ca 2+ jona i slabi efekat troponina I na aktin, a tropomiozin zauzima poziciju koja ne ometa vezu aktina sa miozinom. Izvor energije za kontrakciju mišićnih vlakana je ATP. Kada se troponin veže za jone kalcija, aktiviraju se katalitički centri za cijepanje ATP-a na glavama miozina. Zbog enzimske aktivnosti miozinskih glava, ATP koji se nalazi na glavi miozina se hidrolizira, što daje energiju za promjenu konformacije glava i klizanje filamenata. ADP molekul i neorganski fosfat koji se oslobađaju tokom hidrolize ATP-a koriste se za naknadnu resintezu ATP-a. Novi ATP molekul se veže za glavu miozina. U ovom slučaju, poprečni most sa aktinskim filamentom je isključen. Ponovno spajanje i odvajanje mostova se nastavlja sve dok se koncentracija kalcija unutar miofibrila ne smanji na vrijednost ispod praga. Tada se mišićna vlakna počinju opuštati.
Književnost- B. Alberts, D. Bray, J. Lewis, M. Reff, K. Roberts, J. Watson, Molekularna biologija ćelije - U 3 toma - Trans. sa engleskog - T.2. - M.: Mir, 1994. - 540 str.
- M. B. Berkinblit, S. M. Glagolev, V. A. Furalev, Opća biologija - U 2 dijela - 1. dio. - M.: MIROS, 1999. - 224 str.: ilustr.
A. Sistem sarkoplazmatskih tubula miocita (mišićna vlakna)
Stimulacija mišićnih vlakana
Oslobađanje u blizini rezultira strujom završne ploče koja se propagira elektrotonički i aktivira brze naponsko ograničene Na + kanale u sarkolemi. To dovodi do pojave (PD), koja se odvija brzinom od 2 m/s duž sarkoleme cijelog mišićnog vlakna i brzo prodire u dubinu vlakna duž T-sistema (A).
Genetski defekti u strukturi natrijevih kanala usporavaju njihovu deaktivaciju, što dovodi do povećane ekscitabilnosti uz produženo trajanje kontrakcije i odgođeno opuštanje skeletnih mišića (miotonija). Povećanje mišićne aktivnosti je praćeno masivnim oslobađanjem kalijevih jona iz vlakana. To dovodi do hiperkalemije, pri čemu mišić dostiže vrijednosti pri kojima se natrijevi kanali više ne mogu aktivirati i mišić postaje privremeno paraliziran: obiteljska hiperkalemijska periodična paraliza.

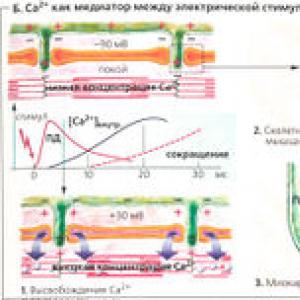
B. Ca 2+ kao posrednik između električne stimulacije i kontrakcije
Prijelaz iz ekscitacije u se naziva (B). U skeletnim mišićima, ovaj proces počinje akcionim potencijalom koji pobuđuje naponsko zavisne dihidropiridinske receptore (DHPR) u sarkolemi u regiji trijade. Ovi receptori su organizovani u redove, a naspram njih u susednoj membrani sarkoplazmatskog retikuluma su redovi Ca 2+ kanala koji se nazivaju rijanodinski receptori (RYR; u skeletnim mišićima, rijanodinski receptor tip 1 - skraćeno RYR1). Svaki drugi RYR1 povezan je sa DHPR (B2). RYR1 se otvaraju kada mehanički "osete" promjenu u DHPR konformaciji pod akcionim potencijalom. U miokardu, svaki DHPR je dio naponsko-zavisnog sarkolemalnog Ca 2+ kanala koji se otvara kao odgovor na akcioni potencijal. Male količine ekstracelularnog Ca 2+ ulaze u ćeliju kroz ovaj kanal, što dovodi do otvaranja RYR2 kanala miokarda (tzv. Ca 2+ inducirajući efekat, ili “Ca 2+ burst”, BZ). Ca 2+ joni pohranjeni u SR oslobađaju se kroz otvoreni RYR1 ili RYR2 u citoplazmu, povećavajući citoplazmatsku koncentraciju Ca 2+ na više od 1 μmol/L u poređenju sa koncentracijom u mirovanju od -0,01 μmol/L (B1). U skeletnim mišićima, stimulacija DHPR-a na jednom mjestu je dovoljna da pokrene “koherentno” otvaranje cijele RYR1 grupe. Ovo povećava pouzdanost impulsa. Povećana koncentracija Ca 2+ u citoplazmi zasićuje Ca 2+ -vezna mjesta troponina C, ukidajući inhibitorni učinak tropomiozina na klizanje filamenta (G), što sprječava snažno (visokog afiniteta) vezivanje aktina i miozina II .
Kod pacijenata s genetskim defektima RYR1, opća anestezija može dovesti do masivnog oslobađanja kalcija, što uzrokuje snažne mišićne kontrakcije praćene brzim i po život opasnim povećanjem tjelesne temperature: maligna hipertermija (=fulminantna hiperpireksija).

B. Klizna filamenta
Molekuli ATP-a su neophodni za klizanje filamenata, a samim tim i za kontrakciju mišića. Zbog svoje aktivnosti ATPaze, miozinske glave djeluju kao motori (motorni proteini) za ovaj proces. Filamenti miozina-ll i aktina u sarkomeru su organizovani na takav način da mogu da klize jedan preko drugog. Glave miozina se povezuju sa aktinskim filamentima pod posebnim uglom, formirajući takozvane poprečne mostove (B1). Zbog konformacijskih promjena u području nukleotidnog vezivnog mjesta miozina-ll, čije se prostorne dimenzije povećavaju koordinisanim kretanjem regije vrata, glava miozina se naginje, istiskujući tanke filamente u dva uzastopna „koraka“ za ukupni od 4-12 nm (radni sat). Druga glava miozina također može djelovati na susjedni aktinski filament, uzrokujući njegovo kontrakciju. Glava se tada odvaja i „napreže“ pripremajući se za sledeći „udar“ kada se ponovo veže za aktin (V3).
Kinezin, još jedan motorni protein, kreće se nezavisno duž mikrotubule tako što "korača" njene dvije glave (8 nm po ciklusu), kao u potezanju konopa. U ovom slučaju, 50% ciklusa je “radno vrijeme” (faktor efikasnosti 0,5). U skeletnim mišićima, između dvije uzastopne interakcije s aktinom, sam miozin-ll pravi "skok" od 36 nm (ili višekratnik od 36, kao što je brza kontrakcija od 396 nm ili više) kako bi stigao do sljedećeg (ili 11.). zgodno locirano mjesto vezivanja aktina (V3, skok od a do b). U isto vrijeme, druge miozinske glave koje rade na datom aktinskom filamentu moraju napraviti najmanje 10 do 100 poteza od približno 4 nm svaka. Efikasnost glave miozina-ll je stoga između 0,1 i 0,01. Ova "podjela rada" između miozinskih glava osigurava da je određeni dio miozinskih glava uvijek spreman za brzu kontrakciju.
Kako filamenti klize, Z-diskovi se približavaju jedan drugom, a područja gdje se tanki i debeli slojevi preklapaju postaju šira, ali njihova ukupna dužina ostaje ista. To dovodi do skraćivanja 1-pojasa i H-zone. Kada krajevi debelih filamenata "kliznu" na Z-disk, dolazi do maksimalnog skraćivanja mišića i krajevi tankih filamenata se preklapaju. Do skraćivanja sarkomera dolazi na oba kraja miozinskih snopova, ali u suprotnim smjerovima.

D. Radni ciklus kliznih filamenata
Mehanizam kontrakcije mišića
Svaka od dvije glave molekula miozina-ll (M) vezuje jedan ATP molekul na mjestu vezanja nukleotida uz pomoć Mg2+ jona. Rezultirajući M-ATP kompleks nalazi se pod uglom od približno 45° u odnosu na ostatak molekula (G4). U ovom stanju, miozin ima vrlo mali afinitet za aktin. Zbog efekta povećane koncentracije Ca 2+ u citoplazmi na troponin-tropomiozin kompleks, aktin (A) aktivira miozin ATPazu, što dovodi do hidrolize ATP (ADP + Fn) i stvaranja aktin-miozina -ADP-Fn kompleks (G1). Nakon toga, glave miozina-ll se ponovo ispravljaju - rezultat ove konformacijske promjene je da se konstanta asocijacije aktina sa miozinom povećava za četiri reda veličine (B1, D1). Fn (anorganski fosfat) se odvaja od kompleksa, što uzrokuje odstupanje glave miozina za 40° (G2a). Ovo uzrokuje da filamenti aktina i miozina klize jedan pored drugog (prva faza snažnog udara). Naknadno oslobađanje ADP-a uzrokuje drugu fazu kontrakcije skeletnih mišića, koja se jedinstveno završava konačnim položajem miozinskih glava (G2b). Zadržani kompleks aktin-miozin (rigidni kompleks) je stabilan i može se konvertovati u prisustvu ATP-a u novi kompleks u kojem su glave miozina labavo vezane za ATP [efekat „omekšavanja“ ATP-a] G4). Veća pokretljivost mišića u mirovanju važna je za procese kao što je punjenje srca ili opuštanje mišića ekstenzora tokom brzog pokreta fleksije. Ako koncentracija Ca 2+ >10-6 mol/l ostane u citoplazmi, ciklusi I i G4 počinju iznova. To uglavnom ovisi o tome hoće li doći sljedeći akcioni potencijal. Da bi se osigurala glatka kontrakcija, samo dio miozinskih glava koje povlače miozinski filament su istovremeno „zauzeti“ (niska efikasnost).
Ca 2+ joni koji se oslobađaju iz sarkoplazmatskog retikuluma (SR) kontinuirano se pumpaju nazad kroz aktivni transport pomoću Ca 2+ -ATPaze, koja se također naziva SERCA. Dakle, ako se RYR-posredovano oslobađanje Ca 2+ iz sarkoplazmatskog retikuluma prekine, koncentracija Ca 2+ u citoplazmi pada ispod 10-6 mol/L i klizanje filamenta prestaje (stanje mirovanja, D, gornji lijevi kut).
Parvalbumin, protein prisutan u citoplazmi (F-vlakna), ubrzava opuštanje mišića nakon kratke faze mišićne kontrakcije izdvajanjem Ca 2+ iz citoplazme u zamjenu za Mg 2+. Afinitet parvalbumina za Ca 2+ je veći od afiniteta troponina, ali niži od afiniteta Ca 2+ -ATPaze sarkoplazmatskog retikuluma. Dakle, parvalbumin djeluje kao “spori” Ca 2+ pufer.
Tok ciklusa klizanja filamenta, kako je gore opisano, uglavnom se odnosi na izotonične kontrakcije, odnosno kontrakcije tokom kojih se skeletni mišić skraćuje. Tokom striktno izometrijske kontrakcije, kada se napetost mišića povećava, ali dužina mišića ostaje nepromijenjena, ne može doći do otklona miozinskih glava i međusobnog klizanja filamenata. Umjesto toga, tokom izometrijske kontrakcije, sila se postiže deformacijom miozinskih glava (MH).
Mišićna vlakna mrtvog tijela ne proizvode ATP. To znači da se nakon smrti Ca 2+ više ne pumpa natrag u SR i rezerve ATP-a potrebne za razgradnju stabilnog kompleksa aktin-miozin se ubrzo iscrpljuju. Ovo rezultira rigidnošću mrtvog tijela (rigor mortis), koja se povlači tek nakon što se aktin i miozin u mišićnom vlaknu razgrađuju.
Mehanika skeletnih mišića

A. Snaga mišića sa povećanjem i smanjenjem učestalosti stimulacije
Akcijski potencijali koji se stvaraju u mišićnom vlaknu povećavaju unutarćelijsku koncentraciju Ca 2+, [Ca 2+ ]intracelularno, inicirajući kontrakciju (skeletni mišić; miokard). U skeletnim mišićima regulacija sile kontrakcije postiže se učešćem različitog broja motoričkih jedinica i promjenom frekvencije akcionog potencijala. Pojedinačni stimulans, ako je iznad nivoa praga, uvijek dovodi do maksimalnog oslobađanja Ca 2+, a time i do maksimalno intenzivne pojedinačne kontrakcije (odgovor sve ili ništa). Međutim, takav jedan stimulus ne izaziva maksimalno skraćivanje mišićnih vlakana jer je prekratak da bi se klizni filamenti održavali u pokretu dok se ne dostigne konačna pozicija. Skraćivanje mišića nastavlja se samo ako drugi podražaj stigne prije nego što se mišić potpuno opusti nakon prvog stimulusa. Ovo ponavljanje stimulusa dovodi do sve veće mehaničke sumacije, ili superpozicije, pojedinačnih kontrakcija (A). Ako frekvencija stimulacije postane toliko visoka da se mišić više ne može opustiti između podražaja, tada dolazi do produžene maksimalne kontrakcije motoričkih jedinica, odnosno tetanusa (A). To se događa, na primjer, na 20 Hz kod sporih mišića i na 60-100 Hz kod mišića koji se brzo trzaju. Mišićna snaga tokom tetanusa može biti četiri puta veća nego tokom jedne kontrakcije skeletnih mišića. Koncentracija Ca 2+ blago se smanjuje između sumativnih stimulusa, ali ostaje visoka tokom tetanusa.
Rigor, kao i kontraktura, karakterizira uporno skraćivanje mišića. Ovo stanje se mora razlikovati od tetanusa. Kontraktura nije uzrokovana akcionim potencijalom, već upornom lokalnom depolarizacijom, na primjer zbog povećane unutarćelijske koncentracije K + (K + kontraktura) ili induciranog oslobađanja Ca 2+, na primjer, kao odgovor na kofein. Kontrakcija takozvanih izotoničnih vlakana (posebna vlakna vanjskih mišića oka i mišićnih vretena; str. 326) je također oblik kontrakture. Izotonična vlakna ne reaguju na podražaje po zakonu „sve ili ništa“, već se skupljaju proporcionalno veličini depolarizacije. Stepen kontrakcije izotoničnih vlakana reguliše se promenama koncentracije Ca 2+ u citoplazmi (a ne akcionim potencijalom!).
Nasuprot tome, opći tonus mišića (refleksni tonus), ili trajna napetost skeletnog mišića u mirovanju, odnosi se na razvoj normalnih akcionih potencijala u pojedinačnoj motoričkoj jedinici. Pojedinačne kontrakcije se ne mogu zabilježiti jer motorne jedinice rade asinhrono. Na primjer, kičmeni mišići (koji podržavaju držanje), dok su očigledno u mirovanju, u nevoljnoj su napetosti. Tonus mišića u mirovanju regulira se refleksima i povećava se s povećanom pažnjom.
Vrste skraćenica

B. Vrste skraćenica
Postoje različite vrste mišićnih kontrakcija. Tokom izometrijske kontrakcije, mišićna sila (napetost) se mijenja, ali dužina mišića ostaje konstantna. (Kod srčanog mišića ovaj tip je predstavljen izovolumetrijskom (izovolumetrijskom) kontrakcijom, jer dužina mišića određuje volumen pretkomora i ventrikula.) Kod izotonične kontrakcije dužina mišića se mijenja pod utjecajem konstantne mišićne sile. (Kod srčanog mišića, ovaj tip je predstavljen izobaričnom kontrakcijom (pri konstantnom pritisku) - mišićna sila određuje pritisak u atrijumu ili ventrikulu.) Kod auksotonične kontrakcije, dužina i snaga mišića se istovremeno mijenjaju. Izotonična ili auksotonična kontrakcija, koja se formira na osnovu izometrijske, naziva se kontrakcija sa naknadnim opterećenjem.
Rastezljivost mišića

B. Izometrijska snaga mišića na različitim dužinama sarkomera
Mišić u mirovanju koji sadrži ATP može se istegnuti kao da je guma. Sila potrebna za pokretanje relaksacije mišića (R, D, sila mirovanja) je vrlo mala, ali raste eksponencijalno u slučaju elastičnog mišića (vidi krivulju mirovanja, D). Otpor mišića na istezanje, koji sprečava odvajanje kliznih filamenata u sarkomeru, u određenoj mjeri zavisi od fascije (vlaknastog tkiva). Glavni faktor je, međutim, džinovska elastična molekula u obliku niti nazvana titin (ili konektin; dugačak 1000 nm, težak 3 do 3,7 MDa), koji je uključen u sarkomer (6 molekula titina po filamentu miozina). U A regiji svakog sarkomera, titin se nalazi u blizini miozinskog filamenta i pomaže da se zadrži u centru sarkomera. Molekuli titina u području trake I su fleksibilni i funkcionišu kao "elastične trake" koje se odupiru pasivnoj kontrakciji mišića i utiču na brzinu skraćivanja mišića.

D. Aktivne i pasivne komponente mišićne snage
Protezljivost molekule titina (titin se može rastegnuti do oko deset puta svoje prvobitne dužine u skeletnim mišićima i nešto manje u srčanom mišiću) određena je čestim ponavljanjem PEVK (prolin-glutamat-valin-lizin) sekvence. Uz vrlo snažno istezanje mišića, koje je predstavljeno najstrmijim dijelom krivulje mirovanja (D), također se razvijaju elementi globularnog lanca koji se nazivaju domeni imunoglobulina C2. Što se mišić brže kontrahira, to će biti neočekivaniji i nagliji učinak ovog "amortizera".

D. krivulje dužina-sila za skeletne i srčane mišiće
Dužina (L) i snaga (F), ili “napetost” mišića su usko povezani (B, D). Ukupna snaga mišića je zbir njegove aktivne sile i napetosti u mirovanju, kao što je gore opisano. Pošto je aktivna sila određena veličinom svih potencijalnih interakcija aktin-miozin, ona varira u skladu sa početnom dužinom sarkomera (C, D). Skeletni mišić može razviti maksimalnu aktivnu (izometrijsku) silu (F0) iz svoje dužine mirovanja (Lmax; dužina sarkomera je približno 2 do 2,2 µm; B). Kada se sarkomeri skrate, (L< Lmax), часть тонких филаментов перекрывается - развиваемая сила меньше Fq (В). При L -0,7 /тах (длина саркомера 1,65 мкм) толстые филаменты контактируют с Z-диском - F еще меньше. Кроме того, способность предварительно растянутой мышцы }