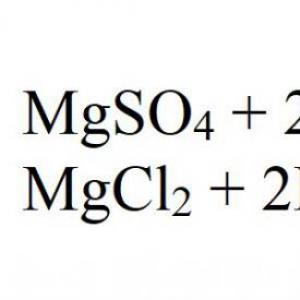Magnija hidroksīda pielietojums. Magnija hidroksīds
Magnija hidroksīds ir neorganiska viela, slikti šķīstošs savienojums, tāpēc, veidojoties ūdens šķīdumos, parādās nogulsnes. Magnija hidroksīda formula ir Mg(OH) 2, tas ir, tā ir diskābes bāze. Šķīst vairāk ūdenī nekā tipiskas nešķīstošās bāzes, bet mazāk šķīst nekā kalcija hidroksīds. Šī iemesla dēļ to klasificē kā slikti šķīstošu savienojumu.
Izplatība dabā
Magnija hidroksīds dabiski sastopams kā minerāls brucīts. Lieli šī iežu nogulumi ir ļoti reti. Krievijā to iegūst Kulduras atradnē, kur tās rezerves tiek lēstas 14 miljonu tonnu apmērā. Tā ražošanas apmērs ir aptuveni 250 tūkstoši tonnu produkcijas gadā, bet kopš šī gada ražošanas apjomi ir dubultojušies. Iemesls tam bija labais pieprasījums pēc šī minerāla ārvalstīs. Lielākā importētāja ir Japāna.
Brucīts izskatās kā balti, pelēki vai zaļgani balti kristāli ar stiklveida spīdumu lūzuma vietā. Tam ir diezgan zema cietība, tāpēc to var viegli sagriezt ar nazi. Var saturēt piemaisījumus. Atkarībā no to daudzuma un veida izšķir vairākas šī minerāla pasugas. Tādējādi feronemalīts papildus magnija hidroksīdam satur 5% dzelzs oksīda veidā, bet ferobrusīts - jau pat 36%. Dzelzs oksīdam ir brūna krāsa (rūsas krāsa), tāpēc šie minerāli iegūst to pašu nokrāsu, nevis parasto gaiši zaļu. Ir arī mangobrucīts. Mangāns šeit darbojas kā piemaisījums. Šim minerālam jau ir medusdzeltena krāsa. Bet, saskaroties ar atmosfēras skābekli, minerāls ātri zaudē savu skaisto krāsu un ātri kļūst melns.
Šo minerālu galvenokārt izmanto kā izejvielu. No tā iegūst magnija oksīdu un citus savienojumus, kušņus un dažādus ugunsizturīgus materiālus. Bet brucītu var izmantot bez jebkādas apstrādes. Tādējādi šis minerāls tiek izmantots gāzu attīrīšanai no hlora un ūdens sorbcijas filtrēšanai.
Kvīts
Galvenā reakcija nešķīstošu hidroksīdu ražošanai ir sārmu reakcija ar magnija sāļiem. Piemēram, ja magnija sulfāts reaģē ar nātrija hidroksīdu. Šī ir laba ilustrācija. Vēl viens piemērs ir magnija hlorīda un kālija hidroksīda mijiedarbība.

Jonu formā visas šādas reakcijas ir rakstītas šādi:
Mg 2+ + OH - → Mg(OH) 2
Magnijam vai tā oksīdam reaģējot ar ūdeni, var iegūt arī hidroksīdu. Šī reakcija notiek ļoti lēni un tikai sildot.

Ir tāds diezgan izplatīts minerāls - dolomīts. No ķīmiskā viedokļa tas ir kalcija karbonāta un magnija maisījums. Kad šo minerālu apstrādā ar magnija hlorīda ūdens šķīdumu un karsē, izgulsnējas nešķīstošs hidroksīds:
MgCO 3 CaCO 3 + 2H 2 O + MgCl 2 → Mg(OH) 2 + CaCl 2 + 2CO 2
Fizikālās īpašības
Kad magnija hidroksīds ir sauss, tas ir balta kristāliska viela. Tas ir bez smaržas, bet tam piemīt raksturīga sārma garša. Tas nedaudz šķīst ūdenī (tikai 0,6 mg uz 100 ml ūdens). Bet pat neskatoties uz to, tā ūdens šķīdumiem ir nedaudz sārmaina vide un indikatori krāsojas atbilstošās krāsās. Bet šis savienojums izšķīst amonija sāļu šķīdumos. Tas nekūst, jo 480 o C temperatūrā, tāpat kā jebkura cita nešķīstoša bāze, sadalās magnija oksīdā un ūdenī. Blīvums normālos apstākļos: 2,4 g/cm3.
Ķīmiskās īpašības
Magnija hidroksīds ir tipiska nešķīstoša bāze. Tas nosaka tā ķīmiskās īpašības. Piemēram, magnija hidroksīds reaģē ar skābēm, skābiem oksīdiem un nemetāliem:

Pēdējās reakcijas dēļ tai ir tendence absorbēt oglekļa dioksīdu tieši no gaisa, veidojot karbonātu, tāpēc šo vielu nav ieteicams ilgstoši uzglabāt atvērtā veidā.
Tas arī mijiedarbojas ar sāļiem, ja reakcijas rezultātā veidojas nogulsnes vai gāze:

Kā minēts iepriekš, sildot, magnija hidroksīds sadalās saskaņā ar vienādojumu:
Mg(OH) 2 → H 2 O + MgO
Attiecībā uz sarežģītu savienojumu veidošanos, kur magnija katjons darbotos kā ligands, šajā jautājumā ir pretrunīga informācija. Daži avoti norāda, ka magnijs nav pakļauts to veidošanai, un pastāv tikai nestabili savienojumi ar magnija halogenīdiem. Citi avoti norāda, ka magnija hidroksīds var reaģēt ar karstiem sārmiem, veidojot hidromagnesātus:
Mg(OH)2 + 2NaOH → Na 2
Pielietojums medicīnā
Medicīnā suspensijas, kuru pamatā ir magnija hidroksīds, izmanto kā antacīdu. To veicina pamata īpašības. Nokļūstot kuņģī, magnija hidroksīds samazina tā skābumu, neitralizējot sālsskābi. Lieto gastrīta, kuņģa un divpadsmitpirkstu zarnas čūlas gadījumā. Uz tā balstītie preparāti nesamazina skābju-bāzes līdzsvaru un neizjauc sālsskābes sekrēciju. Bet pat neskatoties uz to, zālēm ir vairāki ierobežojumi, un tās ir kontrindicētas cilvēkiem ar paaugstinātu jutību pret magnija hidroksīdu.
Magnija hidroksīda un kuņģa sulas sālsskābes mijiedarbības produkts ir magnija hlorīds. Tas ir spēcīgs caurejas līdzeklis (efekts rodas pēc 2-6 stundām). Tāpēc magnija hidroksīds ir dažu zāļu aktīvā sastāvdaļa šajā jomā. Magnija pārpalikums organismā viegli izdalās caur nierēm, bet, ja cilvēks slimo ar kādām šo orgānu slimībām, tad lieko magniju organismā var iegūt, lietojot medikamentus (hipermagnēzija).
Vēl viena šī savienojuma īpašība ir muskuļu relaksācija. Dažreiz zāles, kas satur magnija hidroksīdu, tiek parakstītas sievietēm, kurām ir spontāna aborta risks.
Pielietojums citās nozarēs
Magnija hidroksīdu izmanto arī pārtikas rūpniecībā kā piedevu E528. Produktos tas regulē skābumu un stabilizē krāsu. Magnija hidroksīdu izmanto arī sēra dioksīda saistīšanai, kura izskats pārtikas produktos ir nevēlams. To izmanto konservētu dārzeņu, mērču, marinādes un siera ražošanā. Šī piedeva tiek uzskatīta par nekaitīgu, taču tā ir aizliegta Austrālijā, Apvienotajā Karalistē un Jaunzēlandē.
Magnija hidroksīdu izmanto arī kā ugunsdrošu piedevu polimēros (PVC, poliolefīniem), kā piedevu mazgāšanas līdzekļos un zobu pastās, cukura rafinēšanai un notekūdeņu attīrīšanai.
No magnija hidroksīda iegūtais oksīds ir diezgan noderīgs savienojums. Tas var izturēt aptuveni 3000 grādu temperatūru, tāpēc to izmanto kā ugunsdrošu materiālu. Tātad, to pievieno ķieģeļiem, no kuriem pēc tam tiek izgatavotas domnas. Magnija oksīdu izmanto arī kā sorbentu naftas produktu attīrīšanai. Arī šī savienojuma abrazīvās īpašības ir augstas. To izmanto detaļu virsmu tīrīšanai un pulēšanai elektronikas nozarē.
Magnija hidroksīds
Ķīmiskās īpašības
Neorganisks savienojums, bāzisks metāla hidroksīds Mg. Standarta apstākļos tā ir amorfa viela, praktiski nešķīst ūdenī, šķīst amonija sāļos. Magnija hidroksīda ķīmiskā formula: Mg(OH)2. Dabā tas pastāv kā minerāls brucīts. Molekulmasa = 58,3 grami uz molu.
Magnija hidroksīda ķīmiskās īpašības. Vāja bāze nešķīst ūdenī, bet pat neliels daudzums izšķīdušā savienojuma dod šķīdumam sārmainu reakciju. Tiek novērota raksturīga indikatoru krāsa. Produkts ir diezgan nestabils pret augstām temperatūrām un sadalās pie 350 grādiem pēc Celsija. Reaģē ar skābēm, skābiem oksīdiem (veido sāli un ūdeni); ar koncentrētu sārmu (form hidroksomagnesāti ).
Vielu iegūst, izmantojot šķīstošo sāļu reakcijas Mg un sārmu, hlorīda šķīdums Mg ar apdegušu dolomīts , metāla Mg ar ūdens tvaiku. Rezultātā vienmēr izkrīt baltas amorfas, sierveidīgas nogulsnes, nogulsnes ir baltas vai dzeltenīgas reaģentu piemaisījumu dēļ.
Mg hidroksīdu izmanto:
- notekūdeņu attīrīšanai kā flokulants;
- termoplastisko polimēru ražošanā;
- kā saistošs reaģents sēra dioksīds , lai iegūtu ;
- kā daļu no mazgāšanas līdzekļiem un tīrīšanas līdzekļiem;
- zobu pastas un rafinētā cukura ražošanā;
- uztura bagātinātāja veidā saskaņā ar kodu E528 ;
- medicīnā, lai neitralizētu kuņģa skābes un kā caurejas līdzeklis.
farmakoloģiskā iedarbība
Antacīds, caurejas līdzeklis.
Farmakodinamika un farmakokinētika
Magnija hidroksīdam ir spēja neitralizēt brīvu sālsskābe kas atrodas kuņģa sulā. Tā rezultātā veidojas zāles, kurām, nonākot zarnās, ir caureju veicinoša iedarbība. Reakcijas produkts iekļūst zarnās, kur tas palielina osmotisko spiedienu, palielina fekāliju daudzumu, izstiepj zarnu sienas un stimulē peristaltiku. Magnijs izdalās jonu veidā kopā ar zarnu saturu.
Zāles labi saista žultsskābes un inaktivē fermentu pepsīns ja tie nejauši nokļūst kuņģī no divpadsmitpirkstu zarnas. Viela aizsargā kuņģa gļotādu laikā. Pēc zāļu lietošanas tiek novērota stabila un ilgstoša iedarbība bez sekundāras sālsskābes hipersekrēcijas. Pēc zāļu lietošanas palielinās visu zarnu daļu peristaltika. Caureju veicinošais efekts tiek novērots pēc pusstundas.
Pacientiem ar nieru slimību zāles jālieto piesardzīgi, jo viela var uzsūkties sistēmiskā cirkulācijā un ietekmēt centrālās nervu sistēmas darbību.
Lietošanas indikācijas
Zāles ir parakstītas:
- pacientu ar hronisku paaugstinātu vai normālu kuņģa skābes sekrēciju ārstēšanai;
- pie ;
- pacienti ar sāpēm un diskomfortu epigastrālajā reģionā;
- ārstēšanai pēc taukainas un sāļas pārtikas, nikotīna, kafijas, alkohola ēšanas;
- kā caurejas līdzeklis kļūdām uzturā.
Kontrindikācijas
Zāles ir kontrindicētas lietošanai:
- pie ;
- plkst hipermagnēzija ;
- tablešu veidā bērniem līdz 6 gadu vecumam un citos medikamentos. veidlapas – līdz trim gadiem.
Blakus efekti
Magnija hidroksīds reti izraisa alerģiskas reakcijas. Citu iemeslu dēļ viela var uzsūkties sistēmiskā asinsritē, un tādā gadījumā var rasties nervu sistēmas darbības traucējumi.
Magnija hidroksīds, lietošanas instrukcija (metode un devas)
Vielu lieto iekšēji.
Kā antacīds līdzeklis bērniem un pacientiem, kas vecāki par 12 gadiem, tiek izrakstīts no 300 mg līdz 1,2 gramiem zāļu 4 reizes dienā. Bērniem no 3 gadu vecuma standarta vienreizēja deva ir 0,4 grami.
Medikamentu kombinācija ar pretmikrobu līdzekļiem, atvasinājumiem fluorhinolons , var samazināt šo zāļu efektivitāti.
Ir ziņots par gadījumiem, kad zāles ietekmē vielmaiņu dikumarols .
Medikamentu kombinācija ar alumīnija hidroksīds Un diflunisāls noved pie zāļu biopieejamības samazināšanās.
Viela samazina dzelzs sāļu absorbcijas spēju.
Kombinējot Magnija hidroksīdu ar un flurbiprofēns Palielinās zāļu sākotnējā uzsūkšanās.
Zāles var samazināt koncentrāciju plazmā un to kairinošo ietekmi uz gremošanas traktu.
Viela samazina biopieejamību un efektivitāti karbenoksolons , penicilamīns , . Ātrums, bet ne absorbcijas pakāpe, palēninās.
Ja zāles tiek kombinētas ar, tas ievērojami palielinās pH urīns un palielina zāļu toksicitāti.
Produkts palēnina uzsūkšanos,
Magnija hidroksīds standarta apstākļos parādās kā bezkrāsaini kristāli. Kā pārtikas piedevas ar numuru E528 galvenais mērķis ir regulēt skābumu, kā arī stabilizēt produktu toņus. Savienojumam ir raksturīga sārmaina garša.
Viena no šīs vielas īpašībām ir spēja absorbēt oglekļa dioksīdu no ūdens, un notiek bāziskā magnija karbonāta veidošanās. Nākamā īpašība ir zema šķīdības pakāpe ūdenī, bet diezgan augsta amonija sāļu, kā arī spēja sadalīties karsējot.
Kopumā savienojums ir vidēja stipruma pamats. Dabiskos apstākļos to var atrast kā minerālu brucītu.
Rūpnieciskos apstākļos magnija hidroksīdu iegūst, reaģējot dažādiem sārmiem un magnija sāļiem. Turklāt šis ķīmiskais savienojums var veidoties kalcinēta dolomīta un magnija hlorīda šķīduma reakcijas vai metāliskā magnija un ūdens tvaiku mijiedarbības rezultātā.
Piemērošanas joma
Pateicoties tā īpašajām īpašībām, magnija hidroksīdu izmanto pārtikas ražošanā:
- konservēti dārzeņi – marinēti un sālīti dārzeņi, konservēti dārzeņu uzkodas, marinādes, mērces, dabīgi konservēti dārzeņi;
- kakao produkti.
Sēra dioksīda saistīšanai izmanto pārtikas piedevu E528.
Sēra hidroksīds ir izmantots arī kā flokulants notekūdeņu attīrīšanas laikā, kā piedeva dažādiem mazgāšanas līdzekļiem, dezodorantiem, pretsviedru līdzekļiem un zobu pastām. To izmanto arī magnija oksīda ražošanai un cukura rafinēšanai kā antipirēns PVC un poliolefīnās.
Pielietojums medicīnā
Medicīnā magnija hidroksīdu izmanto kā zāles kuņģa skābes neitralizēšanai, kā arī kā spēcīgu caurejas līdzekli.
Savienojuma farmakoloģiskā darbība ir caurejas līdzeklis un antacīds. Spēj neitralizēt sālsskābi kuņģī, samazina kuņģa sulas peptisko aktivitāti. Vielas iedarbība neizraisa sekundāru sālsskābes hipersekrēciju vai izmaiņas skābju-bāzes līdzsvarā. Savienojuma caureju veicinošā iedarbība rodas pēc 0,5-6 stundām. Turklāt zāles palielina peristaltiku visās zarnu daļās.
Blakusparādības var būt: pastāvīga diskomforta sajūta, reibonis, aritmija, garastāvokļa izmaiņas, ēstgribas zudums, neparasts nogurums, muskuļu vājums, asiņošana no taisnās zarnas, svara zudums. Ja parādās vismaz viens no iepriekš minētajiem simptomiem, jums jākonsultējas ar ārstu. Iespējamas arī pastiprinātas slāpes, slikta dūša, bālgans vai plankumains izkārnījumos, caureja un vēdera krampji.
Savienojuma lietošanas indikācijas ir:
- grēmas pēc kafijas, nikotīna, alkoholisko dzērienu lietošanas;
- aizcietējums;
- sāpes krūtīs;
- gastrīta saasināšanās hroniskā formā ar augstu un normālu skābumu;
- divpadsmitpirkstu zarnas un kuņģa čūlas saasināšanās.
Zāles ir kontrindicētas Alcheimera slimības, zīdīšanas, grūtniecības un paaugstinātas jutības pret hidroksīdu laikā.
Magnija hidroksīda kaitējums
Magnija hidroksīds kā pārtikas piedeva ir aizliegts Apvienotajā Karalistē, Austrālijā un Jaunzēlandē. Šis savienojums tiek uzskatīts par drošu un nekaitīgu. Bet pārmērīgs hidroksīda patēriņš izraisa caureju un gremošanas traucējumus, jo viela absorbē šķidrumu zarnās, tādējādi uzlabojot tā kustīgumu.
Populāri raksti Lasīt vairāk rakstus
 02.12.2013
02.12.2013
Mēs visi dienas laikā daudz staigājam. Pat ja mums ir mazkustīgs dzīvesveids, mēs tik un tā staigājam - galu galā mēs...
606210 65 Sīkāk
 10.10.2013
10.10.2013
Piecdesmit gadi daiļā dzimuma pārstāvēm ir sava veida pavērsiens, kuru šķērso ik sekundi...
445616 117 Sīkāk
 02.12.2013
02.12.2013
Mūsdienās skriešana vairs neizraisa lielu entuziasma pilnu atsauksmju, kā tas bija pirms trīsdesmit gadiem. Tad sabiedrība būtu...
355157 41 Sīkāka informācija
Magnija hidroksīds (e528) ir emulgatoru grupas pārtikas piedeva.
Raksturīgs
Ārēji ķīmiskais savienojums ir balts kristālisks pulveris bez smaržas ar raksturīgu sārmu garšu. E528 izmanto kā pārtikas piedevu. Tās galvenais mērķis ir stabilizēt produktu nokrāsas un regulēt skābumu.
350 grādu pēc Celsija temperatūrā magnija hidroksīds sadalās ūdenī un magnija oksīdā. Tas praktiski nešķīst ūdenī. Tas absorbē oglekļa dioksīdu un ūdeni no gaisa, veidojot pamata magnija karbonātu. Dabā E528 var atrast īpaša minerāla - brucīta - veidā.
Magnija hidroksīda sagatavošana
Rūpnieciskā mērogā magnija hidroksīda ražošana notiek magnija sāļu mijiedarbības rezultātā ar dažādiem sārmiem.
Arī ķīmiskais savienojums tiek iegūts, reaģējot magnija hlorīda šķīdumam ar kalcinētu dolomītu vai ūdens tvaikus reaģējot ar magnija metālu.
Magnija hidroksīda īpašības
Pārtikas rūpniecībā magnija hidroksīda īpašības ir kļuvušas plaši izplatītas kakao produktu (līdz 70 g/kg), dārzeņu konservu (sālīti un marinēti dārzeņi, mērces, marinādes, konservēti dārzeņu uzkodas, dabīgie konservēti dārzeņi) ražošanā un siers. Kā pārtikas piedevu E528 izmanto sēra dioksīda saistīšanai.
Vielu izmanto kā flokulantu notekūdeņu attīrīšanai, kā piedevu dažādos mazgāšanas līdzekļos, pretsviedru līdzekļos, dezodorantos un zobu pastās. Izmanto cukura rafinēšanai un magnija oksīda ražošanai.
Magnija hidroksīda īpašības ir pelnījušas īpašu uzmanību, ļaujot to izmantot medicīnā. Vielai piemīt antacīds un caureju veicinošs efekts, tā samazina kuņģa sulas aktivitāti un neitralizē sālsskābi kuņģī. Tajā pašā laikā e528 lietošana nav saistīta ar skābēm bagātā hormona izmaiņām vai sekundāru sālsskābes hipersekrēciju. Arī medicīnā vielu izmanto, lai palielinātu zarnu kustīgumu. Kā caurejas līdzeklis tas sāk darboties 2-6 stundas pēc lietošanas.
 Indikācijas ķīmiskā savienojuma lietošanai: grēmas pēc kafijas, alkohola vai smēķēšanas, hronisks gastrīts ar normālu vai pastiprinātu sekrēciju, kuņģa un divpadsmitpirkstu zarnas čūla, aizcietējums, sāpes epigastrijā un diskomforts.
Indikācijas ķīmiskā savienojuma lietošanai: grēmas pēc kafijas, alkohola vai smēķēšanas, hronisks gastrīts ar normālu vai pastiprinātu sekrēciju, kuņģa un divpadsmitpirkstu zarnas čūla, aizcietējums, sāpes epigastrijā un diskomforts.
Medicīnā plaši izplatīts ir magnija hidroksīda algeldrāts - līdzeklis, ko lieto pret akūtu duodenītu, kuņģa čūlu, gastraļģiju, grēmas, hronisku pankreatītu, fermentatīvu vai pūšanas dispepsiju, hiperacīdu gastrītu. Tomēr jums jāzina, ka šīs zāles ir kontrindicētas pacientiem ar paaugstinātu jutību pret magnija hidroksīdu, Alcheimera slimību, kā arī grūtniecības un zīdīšanas laikā. Tas jālieto piesardzīgi pacientiem ar nieru darbības traucējumiem, jo pēc tā lietošanas organismā var veidoties pārmērīgs magnija daudzums (hipermagnēzija).
Ietekme uz cilvēka ķermeni
Pārtikas piedeva e528 ir aizliegta Austrālijā, Lielbritānijā un Jaunzēlandē. Kopumā uztura bagātinātājs tiek uzskatīts par nekaitīgu ķermenim. Tomēr tā lietošana lielās koncentrācijās var izraisīt kuņģa darbības traucējumus un izraisīt caureju, jo tas absorbē šķidrumu no zarnām, palielinot to kustīgumu.