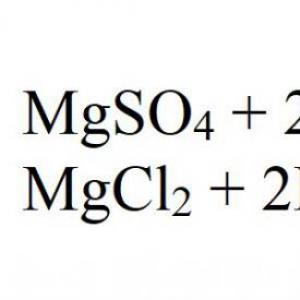Kas satur fenolu? Fenols - ietekme uz cilvēka ķermeni
Fenoli- aromātisko ogļūdeņražu atvasinājumi, kas var saturēt vienu vai vairākas hidroksilgrupas, kas savienotas ar benzola gredzenu.
Kā sauc fenolus?
Saskaņā ar IUPAC noteikumiem nosaukums " fenols" Atomu numerācija nāk no atoma, kas ir tieši saistīts ar hidroksigrupu (ja tas ir vecāks), un tiek numurēts tā, lai aizvietotāji saņemtu mazāko skaitu.
Pārstāvis - fenols - C6H5OH:
Fenola struktūra.
Skābekļa atoma ārējā līmenī ir vientuļš elektronu pāris, kas tiek “ievilkts” gredzena sistēmā (+M efekts VIŅŠ-grupas). Tā rezultātā var rasties 2 sekas:
1) benzola gredzena elektronu blīvuma palielināšana līdz orto- un para- pozīcijām. Būtībā šis efekts izpaužas elektrofīlās aizvietošanas reakcijās.
2) blīvums uz skābekļa atoma samazinās, kā rezultātā saite VIŅŠ vājina un var saplēst. Ietekme ir saistīta ar palielinātu fenola skābumu salīdzinājumā ar piesātinātajiem spirtiem.
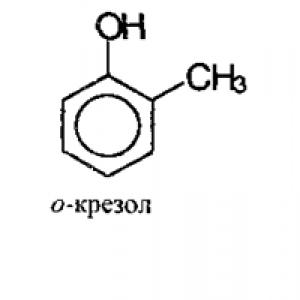
Monoaizvietoti atvasinājumi fenols(krezols) var būt 3 strukturālos izomēros:

Fenolu fizikālās īpašības.
Fenoli ir kristāliskas vielas istabas temperatūrā. Slikti šķīst aukstā ūdenī, bet labi šķīst karstā ūdenī un sārmu ūdens šķīdumos. Viņiem ir raksturīga smarža. Ūdeņraža saišu veidošanās dēļ tiem ir augsta viršanas un kušanas temperatūra.
Fenolu sagatavošana.
1. No halobenzoliem. Karsējot hlorbenzolu un nātrija hidroksīdu zem spiediena, tiek iegūts nātrija fenolāts, kas pēc reakcijas ar skābi pārvēršas fenolā:
2. Rūpnieciskā metode: kumēna katalītiskā oksidēšana gaisā rada fenolu un acetonu:

3. No aromātiskām sulfonskābēm, sapludinot ar sārmiem. Reakcija, ko visbiežāk veic, lai iegūtu daudzvērtīgus fenolus, ir:

Fenolu ķīmiskās īpašības.
R Skābekļa atoma orbitāle veido vienotu sistēmu ar aromātisko gredzenu. Tāpēc elektronu blīvums uz skābekļa atoma samazinās, un uz benzola gredzena tas palielinās. Komunikācijas polaritāte VIŅŠ palielinās, un hidroksilgrupas ūdeņradis kļūst reaktīvāks, un to var viegli aizstāt ar metāla atomu pat sārmu iedarbībā.
Fenolu skābums ir augstāks nekā spirtiem, tāpēc var veikt šādas reakcijas:
Bet fenols ir vāja skābe. Ja oglekļa dioksīds vai sēra dioksīds tiek izvadīts caur tā sāļiem, izdalās fenols, kas pierāda, ka ogļskābes un sērskābes ir spēcīgākas skābes:
Fenolu skābās īpašības vājina I tipa aizvietotāju ievadīšana gredzenā un pastiprina II tipa ievadīšana.
2) esteru veidošanās. Process notiek skābes hlorīdu ietekmē:
3) Elektrofilās aizvietošanas reakcija. Jo VIŅŠ-grupa ir pirmā veida aizvietotājs, tad palielinās benzola gredzena reaktivitāte orto- un para-pozīcijās. Kad fenols tiek pakļauts broma ūdenim, tiek novērotas nogulsnes - tā ir kvalitatīva reakcija uz fenolu:

4) Fenolu nitrēšana. Reakciju veic ar nitrēšanas maisījumu, kā rezultātā veidojas pikrīnskābe:

5) Fenolu polikondensācija. Reakcija notiek katalizatoru ietekmē:

6) Fenolu oksidēšana. Fenolus viegli oksidē atmosfēras skābeklis:

7) Kvalitatīva reakcija uz fenolu ir dzelzs hlorīda šķīduma iedarbība un violeta kompleksa veidošanās.
Fenolu pielietojums.
Fenolus izmanto fenola-formaldehīda sveķu, sintētisko šķiedru, krāsvielu un medikamentu, dezinfekcijas līdzekļu ražošanā. Pikrīnskābi izmanto kā sprāgstvielas.
Fenolu nosaukumi ir apkopoti, ņemot vērā faktu, ka pamatstruktūrai saskaņā ar IUPAC noteikumiem tiek saglabāts triviālais nosaukums “fenols”. Benzola gredzena oglekļa atomu numerācija sākas no atoma, kas tieši saistīts ar hidroksilgrupu (ja tā ir augstākā funkcija), un turpinās tādā secībā, ka pieejamie aizvietotāji saņem vismazākos skaitļus.
Mono-aizvietoti fenola atvasinājumi, piemēram, metilfenols (krezols), var pastāvēt trīs strukturālo izomēru formā - orto-, meta- un para-krezoli.
Fizikālās īpašības.
Fenoli pārsvarā ir kristāliskas vielas (-krezols - šķidrums) istabas temperatūrā. Tiem ir raksturīga smarža, tie diezgan slikti šķīst ūdenī, bet labi šķīst sārmu ūdens šķīdumos (skatīt zemāk). Fenoli veido spēcīgas ūdeņraža saites, un tiem ir diezgan augsta viršanas temperatūra.
Iegūšanas metodes.
1. Preparāts no halobenzoliem. Karsējot hlorbenzolu un nātrija hidroksīdu zem spiediena, iegūst nātrija fenolātu, kuru tālāk apstrādājot ar skābi, veidojas fenols:
2. Pagatavošana no aromātiskām sulfonskābēm (sk. 3. reakciju sadaļā “Benzola ķīmiskās īpašības”, § 21). Reakciju veic, sakausējot sulfonskābes ar sārmiem. Sākotnēji izveidotos fenoksīdus apstrādā ar stiprām skābēm, lai iegūtu brīvus fenolus. Šo metodi parasti izmanto, lai iegūtu daudzvērtīgus fenolus:

Ķīmiskās īpašības.
Fenolos skābekļa atoma p-orbitāle veido vienu sistēmu ar aromātisko gredzenu. Šīs mijiedarbības rezultātā skābekļa atoma elektronu blīvums samazinās un benzola gredzena blīvums palielinās. O-H saites polaritāte palielinās, un OH grupas ūdeņradis kļūst reaktīvāks un ir viegli nomaināms ar metālu pat sārmu iedarbībā (atšķirībā no piesātinātajiem vienvērtīgajiem spirtiem).
Turklāt šādas savstarpējas ietekmes rezultātā fenola molekulā palielinās benzola gredzena reaktivitāte orto un kara pozīcijās elektrofīlās aizvietošanas reakcijās (halogenēšana, nitrēšana, polikondensācija utt.):

1. Fenola skābās īpašības izpaužas reakcijās ar sārmiem (saglabāts vecais nosaukums “karbolskābe”):
Fenols tomēr ir ļoti vāja skābe. Kad oglekļa dioksīds vai sēra dioksīda gāzes tiek izlaistas caur fenolātu šķīdumu, izdalās fenols - šī reakcija pierāda, ka fenols ir vājāka skābe nekā oglekļa un sēra dioksīds:
Fenolu skābās īpašības vājina pirmā veida aizvietotāju ievadīšana gredzenā un uzlabo otrā veida aizvietotāju ievadīšana.
2. Esteru veidošanās. Atšķirībā no spirtiem, fenoli neveido esterus, pakļaujoties karbonskābēm; Šim nolūkam izmanto skābes hlorīdus:
3. Halogenēšana. Fenolu pakļaujot broma ūdenim (salīdzināt ar benzola bromēšanas nosacījumiem - 21. §), veidojas 2,4,6-tribromfenola nogulsnes:

Šī ir kvalitatīva reakcija fenola noteikšanai.
4. Nitrēšana. 20% slāpekļskābes ietekmē fenols viegli pārvēršas orto- un para-nitrofenolu maisījumā. Ja fenolu nitrē ar koncentrētu slāpekļskābi, veidojas 2,4,6-trinitrofenols - stipra skābe (pikrīnskābe).
5. Oksidācija. Fenoli viegli oksidējas pat atmosfēras skābekļa ietekmē.
Tādējādi, stāvot gaisā, fenols pakāpeniski kļūst sārti sarkans. Fenola enerģiskās oksidēšanas laikā ar hroma maisījumu galvenais oksidācijas produkts ir hinons. Diatomiskie fenoli tiek oksidēti vēl vieglāk. Hidrohinona oksidēšanās rezultātā veidojas hinons:

Veidojas uz benzola bāzes. Normālos apstākļos tās ir cietas toksiskas vielas ar specifisku aromātu. Mūsdienu rūpniecībā šiem ķīmiskajiem savienojumiem ir liela nozīme. Pēc lietošanas apjoma fenols un tā atvasinājumi ir starp divdesmit populārākajiem ķīmiskajiem savienojumiem pasaulē. Tos plaši izmanto ķīmiskajā un vieglajā rūpniecībā, farmācijā un enerģētikā. Tāpēc fenola ražošana rūpnieciskā mērogā ir viens no galvenajiem ķīmiskās rūpniecības uzdevumiem.
Fenola apzīmējumi
Sākotnējais fenola nosaukums ir karbolskābe. Vēlāk šim savienojumam tika dots nosaukums "fenols". Šīs vielas formula ir parādīta attēlā:
Fenola atomi ir numurēti no oglekļa atoma, kas ir saistīts ar OH hidrokso grupu. Secība turpinās tādā secībā, ka pārējie aizvietotie atomi saņem mazākos skaitļus. Fenola atvasinājumi pastāv trīs elementu veidā, kuru īpašības izskaidrojamas ar to strukturālo izomēru atšķirībām. Dažādi orto-, meta-, para-krezoli ir tikai benzola gredzena un hidroksilgrupas savienojuma pamatstruktūras modifikācija, kuras pamata kombinācija ir fenols. Šīs vielas formula ķīmiskajā apzīmējumā izskatās kā C 6 H 5 OH.
Fenola fizikālās īpašības
Vizuāli fenols parādās kā cieti, bezkrāsaini kristāli. Brīvā dabā tie oksidējas, piešķirot vielai raksturīgu rozā nokrāsu. Normālos apstākļos fenols diezgan slikti šķīst ūdenī, bet, paaugstinoties temperatūrai līdz 70 o, šis rādītājs strauji palielinās. Sārmainos šķīdumos šī viela šķīst jebkurā daudzumā un jebkurā temperatūrā.

Šīs īpašības saglabājušās arī citos savienojumos, kuru galvenās sastāvdaļas ir fenoli.
Ķīmiskās īpašības
Fenola unikālās īpašības ir izskaidrojamas ar tā iekšējo struktūru. Šīs ķīmiskās vielas molekulā skābekļa p-orbitāle veido vienotu p-sistēmu ar benzola gredzenu. Šī ciešā mijiedarbība palielina aromātiskā gredzena elektronu blīvumu un samazina šo skābekļa atoma indikatoru. Šajā gadījumā hidroksogrupas saišu polaritāte ievērojami palielinās, un tās sastāvā esošais ūdeņradis ir viegli nomaināms ar jebkuru sārmu metālu. Tā veidojas dažādi fenolāti. Šie savienojumi nesadalās ar ūdeni kā alkoholāti, taču to šķīdumi ir ļoti līdzīgi stipru bāzu un vāju skābju sāļiem, tāpēc tiem ir diezgan izteikta sārma reakcija. Fenolāti reaģē ar dažādām skābēm, reakcijas rezultātā samazinās fenoli. Šī savienojuma ķīmiskās īpašības ļauj tam reaģēt ar skābēm, veidojot esterus. Piemēram, fenola un etiķskābes reakcijas rezultātā veidojas fenilesteris (fenilacetāts).

Plaši zināma ir nitrēšanas reakcija, kurā 20% slāpekļskābes ietekmē fenols veido para- un ortonitrofenolu maisījumu. Fenolu apstrādājot ar koncentrētu slāpekļskābi, veidojas 2,4,6-trinitrofenols, ko dažreiz sauc par pikrīnskābi.

Fenols dabā
Kā neatkarīga viela fenols dabā ir atrodams akmeņogļu darvā un dažos eļļās. Bet rūpnieciskām vajadzībām šis daudzums nespēlē nekādu lomu. Tāpēc fenola mākslīga iegūšana ir kļuvusi par prioritāti daudzām zinātnieku paaudzēm. Par laimi šī problēma tika atrisināta un galu galā tika iegūts mākslīgais fenols.
Īpašības, saņemšana
Dažādu halogēnu izmantošana ļauj iegūt fenolātus, no kuriem tālākā pārstrādē veidojas benzols. Piemēram, karsējot nātrija hidroksīdu un hlorbenzolu, veidojas nātrija fenolāts, kas skābes ietekmē sadalās sālī, ūdenī un fenolā. Šādas reakcijas formula ir dota šeit:
C6H5-CI + 2NaOH -> C6H5-ONa + NaCl + H2O
Aromātiskās sulfonskābes ir arī avots benzola ražošanai. Ķīmiskā reakcija tiek veikta, vienlaikus kausējot sārmu un sulfonskābi. Kā redzams no reakcijas, vispirms veidojas fenoksīdi. Apstrādājot ar stiprām skābēm, tie tiek reducēti par daudzvērtīgiem fenoliem.
Fenols rūpniecībā
Teorētiski vienkāršākais un daudzsološākais veids, kā iegūt fenolu, izskatās šādi: ar katalizatora palīdzību benzols tiek oksidēts ar skābekli. Bet līdz šim šīs reakcijas katalizators nav izvēlēts. Tāpēc pašlaik rūpniecībā tiek izmantotas citas metodes.
Nepārtraukta rūpnieciskā metode fenola iegūšanai sastāv no hlorbenzola un 7% nātrija hidroksīda šķīduma mijiedarbības. Iegūtais maisījums tiek izvadīts caur pusotru kilometru garu cauruļu sistēmu, kas uzkarsēta līdz 300 C temperatūrai. Temperatūras un uzturēta augsta spiediena ietekmē sāk reaģēt izejvielas, kā rezultātā rodas 2,4-dinitrofenols un citi produkti.

Pirms neilga laika tika izstrādāta rūpnieciska metode fenolu saturošu vielu iegūšanai, izmantojot kumēna metodi. Šis process sastāv no diviem posmiem. Pirmkārt, izopropilbenzolu (kumenu) iegūst no benzola. Lai to izdarītu, benzols tiek sārmains ar propilēnu. Reakcija izskatās šādi:

Pēc tam kumēns tiek oksidēts ar skābekli. Otrās reakcijas rezultāts ir fenols un vēl viens svarīgs produkts, acetons.
Fenolu var ražot rūpnieciskā mērogā no toluola. Lai to izdarītu, toluols tiek oksidēts ar skābekli, kas atrodas gaisā. Reakcija notiek katalizatora klātbūtnē.
Fenolu piemēri
Tuvākos fenolu homologus sauc par krezoliem.

Ir trīs veidu krezoli. Metakrezols normālos apstākļos ir šķidrs, parakrezols un ortokrezols ir cietas vielas. Visi krezoli slikti šķīst ūdenī, un to ķīmiskās īpašības ir gandrīz līdzīgas fenolam. Krezoli dabiskā veidā ir atrodami akmeņogļu darvā, rūpniecībā tos izmanto krāsvielu un dažu veidu plastmasas ražošanā.
Diatomisko fenolu piemēri ir para-, orto- un metahidrobenzoli. Visi no tiem ir cietas vielas, viegli šķīst ūdenī.
Vienīgais trīsvērtīgā fenola pārstāvis ir pirogalols (1,2,3-trihidroksibenzols). Tās formula ir parādīta zemāk.

Pirogallols ir diezgan spēcīgs reducētājs. Tas viegli oksidējas, tāpēc to izmanto bezskābekļa gāzu ražošanai. Šī viela ir labi zināma fotogrāfiem, to izmanto kā izstrādātāju.
1. Fenoli- aromātisko ogļūdeņražu atvasinājumi, kuru molekulās hidroksilgrupa (-OH) ir tieši saistīta ar oglekļa atomiem benzola gredzenā.
2. Fenolu klasifikācija
Atkarībā no OH grupu skaita molekulā izšķir viena, divu un trīsvērtīgu fenolu:
Saskaņā ar kondensēto aromātisko gredzenu skaitu molekulā izšķir pašus fenolus (viens aromātiskais gredzens - benzola atvasinājumi), naftolus (2 kondensēti gredzeni - naftalīna atvasinājumi), antranolus (3 kondensēti gredzeni - antracēna atvasinājumi) un fenantrolus:
3. Fenolu izomērisms un nomenklatūra
Ir iespējami 2 izomērijas veidi:
- benzola gredzena aizvietotāju pozīcijas izomerisms
- sānu ķēdes izomērija (alkilgrupas struktūra un radikāļu skaits)
Fenoliem plaši tiek izmantoti triviāli nosaukumi, kas attīstījušies vēsturiski. Aizvietoto mononukleāro fenolu nosaukumos tiek izmantoti arī prefiksi orto-,meta- Un pāris -, izmanto aromātisko savienojumu nomenklatūrā. Sarežģītākiem savienojumiem atomi, kas veido aromātiskos gredzenus, ir numurēti un aizvietotāju atrašanās vieta tiek norādīta, izmantojot digitālos indeksus.
4. Molekulas uzbūve
Fenilgrupa C 6 H 5 – un hidroksilgrupa –OH savstarpēji ietekmē viena otru
- Skābekļa atoma vientuļo elektronu pāri pievelk benzola gredzena 6 elektronu mākonis, kā dēļ O-H saite ir vēl vairāk polarizēta. Fenols ir spēcīgāka skābe nekā ūdens un spirti.
- Benzola gredzenā tiek izjaukta elektronu mākoņa simetrija, palielinās elektronu blīvums pozīcijās 2, 4, 6. Tas padara reaktīvākas 2., 4., 6. pozīcijā esošās C-H saites un benzola gredzena saites.
5. Fizikālās īpašības
Lielākā daļa vienvērtīgo fenolu normālos apstākļos ir bezkrāsainas kristāliskas vielas ar zemu kušanas temperatūru un raksturīgu smaržu. Fenoli nedaudz šķīst ūdenī, viegli šķīst organiskajos šķīdinātājos, toksiski un, uzglabājot gaisā, oksidācijas rezultātā pakāpeniski kļūst tumšāki.
Fenols C6H5OH (karbolskābe ) - bezkrāsaina kristāliska viela gaisā oksidējas un kļūst sārta; parastā temperatūrā tā slikti šķīst ūdenī; virs 66 °C jebkurā proporcijā sajaucas ar ūdeni. Fenols ir toksiska viela, kas izraisa ādas apdegumus un ir antiseptisks līdzeklis.
6. Toksiskas īpašības
Fenols ir indīgs. Izraisa nervu sistēmas disfunkciju. Putekļi, tvaiki un fenola šķīdums kairina acu, elpceļu un ādas gļotādas. Nokļūstot organismā, fenols ļoti ātri uzsūcas pat caur neskartām ādas vietām un dažu minūšu laikā sāk ietekmēt smadzeņu audus. Pirmkārt, rodas īslaicīgs uztraukums un pēc tam elpošanas centra paralīze. Pat ja tiek pakļauti minimālām fenola devām, tiek novērota šķaudīšana, klepus, galvassāpes, reibonis, bālums, slikta dūša un spēka zudums. Smagos saindēšanās gadījumus raksturo bezsamaņa, cianoze, apgrūtināta elpošana, radzenes nejutīgums, ātrs, tikko manāms pulss, auksti sviedri, bieži vien krampji. Fenols bieži ir vēža cēlonis.
7. Fenolu pielietojums
1. Sintētisko sveķu, plastmasas, poliamīdu ražošana
2. Zāles
3. Krāsvielas
4. Virsmaktīvās vielas
5. Antioksidanti
6. Antiseptiķi
7. Sprāgstvielas
8. Fenola sagatavošana V nozare
1). Kumena metode fenola iegūšanai (PSRS, Sergejevs P.G., Ūdris R.Ju., Krūzalovs B.D., 1949). Metodes priekšrocības: bezatkritumu tehnoloģija (derīgo produktu raža > 99%) un izmaksu efektivitāte. Pašlaik kumēna metodi izmanto kā galveno metodi fenola globālajā ražošanā.

2). Izgatavots no akmeņogļu darvas (kā blakusprodukts - raža ir maza):
C 6 H 5 ONa + H 2 SO 4 (atšķaidīts) → C 6 H 5 – OH + NaHSO 4
nātrija fenolāts
(produkts nosveķu zābakikaustiskā soda)
3). No halobenzoliem :
C 6 H 5 -Cl + NaOH t , lpp→ C 6 H 5 – OH + NaCl
4). Aromātisko sulfonskābju sāļu saplūšana ar cietiem sārmiem :
C 6 H 5 -SO 3 Na+ NaOH t → Na 2 SO 3 + C 6 H 5 – OH
nātrija sāls
benzolsulfonskābes
9. Fenola (karbolskābes) ķīmiskās īpašības
es . Hidroksilgrupas īpašības
Skābes īpašības– izteikts skaidrāk nekā piesātinātajos spirtos (rādītāju krāsa nemainās):
- Ar aktīviem metāliem-
2C6H5-OH + 2Na → 2C6H5-ONa + H2
nātrija fenolāts
- Ar sārmiem-
C6H5-OH + NaOH (ūdens šķīdums)↔ C 6 H 5 -ONa + H 2 O
! Fenolāti ir vājas karbolskābes sāļi, kurus sadala ogļskābe -
C6H5-ONa+H2O+ARO 2 → C 6 H 5 -OH + NaHCO 3
Pēc skābuma īpašībām fenols ir 10 6 reizes pārāks par etanolu. Tajā pašā laikā tas ir tikpat reižu zemāks par etiķskābi. Atšķirībā no karbonskābēm, fenols nevar izspiest ogļskābi no tā sāļiem
C 6 H 5 - Ak! + NaHCO 3 = reakcija nenotiek - lai gan tas lieliski šķīst sārmu ūdens šķīdumos, tas faktiski nešķīst nātrija bikarbonāta ūdens šķīdumā.
Fenola skābās īpašības tiek uzlabotas elektronu izvelkošo grupu ietekmē, kas saistītas ar benzola gredzenu ( NĒ 2 - , Br - )
2,4,6-trinitrofenols jeb pikrīnskābe ir stiprāka par ogļskābi
II . Benzola gredzena īpašības
1). Atomu savstarpējā ietekme fenola molekulā izpaužas ne tikai hidroksigrupas uzvedībā (skat. iepriekš), bet arī benzola gredzena lielākā reaktivitātē. Hidroksilgrupa palielina elektronu blīvumu benzola gredzenā, īpaši orto- Un pāris- pozīcijas (+ M-OH grupas efekts):
Tāpēc fenols ir daudz aktīvāks nekā benzols elektrofīlās aizvietošanas reakcijās aromātiskajā gredzenā.
- Nitrēšana. 20% slāpekļskābes HNO 3 ietekmē fenols viegli pārvēršas maisījumā orto- Un pāris- nitrofenoli:
Ja izmanto koncentrētu HNO 3, 2,4,6-trinitrofenolu ( pikrīnskābe):
- Halogenēšana. Fenols viegli reaģē ar broma ūdeni istabas temperatūrā, veidojot baltas 2,4,6-tribromfenola nogulsnes (kvalitatīva reakcija uz fenolu):
- Kondensācija ar aldehīdiem. Piemēram:
2). Fenola hidrogenēšana
C6H5-OH + 3H2 Ni, 170ºC→ C6H11 – OH cikloheksilspirts (cikloheksanols)
Visi fenoli ir toksiskas un cilvēkiem ļoti bīstamas vielas. Bet miljoniem tonnu to ražo un izmanto visā pasaulē.
Ja šīs vielas nonāk cilvēka organismā, tās var izraisīt smagu saindēšanos. Tāpēc noskaidrosim, kurās nozarēs fenols tiek izmantots, kā tas nonāk cilvēka organismā, tā toksiskās īpašības un saindēšanās pazīmes, pirmā palīdzība un ārstēšana.
Fenolu raksturojums
Fenols ir bezkrāsainu kristālu veidā, kas ātri oksidējas gaisā un iegūst rozā krāsu. Asā, specifiskā fenola smarža ir līdzīga guašas smaržai.
Tas vidēji šķīst ūdenī (1:20). Tas labi šķīst spirtā, sārmos, acetonā un eļļās. Bet temperatūrā virs 700°C tas izšķīst ūdenī jebkurā proporcijā. Ar ūdens tvaikiem tas iegūst gaistošas īpašības. Viegli adsorbēts ar produktiem.

Fenoli ietver:
- hlorfenols;
- krezols;
- Lizols;
- kreozots;
- butilfenols;
- rezorcīns;
- pirotehīns;
- hidrohinons un citi.
Fenolu pielietojums
Ikvienam ir iespēja sastapt un pat saindēties ar fenolu ikdienā, ņemot vērā tā plašo pielietojumu. Kur tas tiek izmantots?

Fenola toksicitāte
Fenols ir II bīstamības klase - ļoti bīstama viela. Tas var iekļūt organismā caur gļotādām, elpošanas orgāniem un ādu, un tiek izvadīts caur nierēm un plaušām.
Fenola šķīdums, kā arī tā putekļi un tvaiki izraisa ādas, acu un elpceļu gļotādu kairinājumu un ķīmiskus apdegumus. Saindēšanās ar fenola tvaiku var izraisīt nervu sistēmas darbības traucējumus, tostarp elpošanas centra paralīzi.
Kad viela nonāk saskarē ar ādu, tā ātri uzsūcas pat caur neskartām vietām. Jau pēc dažām minūtēm sākas toksiska ietekme uz smadzenēm. Nāvējošā fenola deva, lietojot iekšķīgi, pieaugušajam svārstās no 1 g līdz 10 g, bet bērniem - no 0,05 g līdz 0,5 g.
Indīgā iedarbība uz visām šūnām rodas olbaltumvielu molekulu struktūras izmaiņu rezultātā, mainoties to īpašībām un šūnu proteīnu nogulsnēšanai. Tā rezultātā var attīstīties audu nekroze (nāve).
Fenoliem ir arī izteikta toksiska ietekme uz nierēm. Tie iznīcina sarkanās asins šūnas, alergēni iedarbojas uz organismu, izraisa dermatītu un citas alerģiskas reakcijas.
Saindēšanās cēloņi
Saindēšanās ar fenolu var rasties šādu iemeslu dēļ:

Saindēšanās ar fenolu simptomi
Saindēšanās var būt akūta vai hroniska. Akūtas saindēšanās ar fenolu pazīmes var rasties, toksiskajai vielai nonākot mutē, elpceļos vai saskaroties ar ādu.
Akūta inhalācijas saindēšanās ar fenolu izpaužas ar šādiem simptomiem:

Ja viela nokļūst uz ādas, vispirms parādās izteikts bālums un skartās ādas grumbas, kam seko apsārtums, tulznu veidošanās, kam seko nekrozes attīstība. Nejutīgums vai tirpšana vai sāpju trūkums sākumā var izraisīt aizkavētu medicīnisko aprūpi.
Ar plašiem bojājumiem attīstās smaga saindēšanās ar drudzi, elpošanas, asinsrites un nervu sistēmas traucējumiem.
Kad fenols nonāk organismā, raksturīgās saindēšanās izpausmes ir:

Kad aknas ir bojātas, attīstās dzelte. Urinēšanas pārtraukšana norāda uz nieru bojājumu. Ja organismā nonāk koncentrēti šķīdumi vai lielas vielas devas, nāve iestājas jau pirmajā dienā.
Hronisku saindēšanos raksturo:

Pirmā palīdzība un ārstēšana
Saindēšanās ar fenolu gadījumā (pat ar nelielu simptomu izpausmi) ārstēšana jāveic kompetenti jau no pirmajām minūtēm, lai nekaitētu cietušajam.
Ko darīt akūtas saindēšanās ar fenolu gadījumā? Steidzami izsauciet ātro palīdzību, jo neatliekamās palīdzības un ārstēšanas kavēšanās nav pieļaujama!
Saindēšanās ar fenolu gadījumā pirmā palīdzība jāsniedz pirms medicīniskā personāla ierašanās.

Visos fenola saindēšanās gadījumos ārstēšana tiek veikta toksikoloģijas nodaļā. Ārstēšana var ietvert:

Lai izvairītos no saindēšanās ar fenolu, strādājot ar to stingri jāievēro drošības pasākumi un jānodrošina pareiza produktu uzglabāšana mājās. Saindēšanās gadījumā tikai tūlītēja medicīniskā palīdzība var glābt dzīvību.