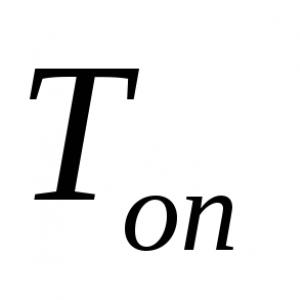Električna provodljivost je numerički izraz sposobnosti vodene otopine da provodi električnu struju. Električna provodljivost prirodne vode uglavnom zavisi
Pretvarač dužine i udaljenosti Pretvarač mase Konvertor mera zapremine rasutih proizvoda i prehrambenih proizvoda Konvertor površine Pretvarač zapremine i mernih jedinica u kulinarskim receptima Pretvarač temperature Pretvarač pritiska, mehaničkog naprezanja, Youngovog modula Pretvarač energije i rada Pretvarač snage Pretvarač sile Pretvarač vremena Linearni pretvarač brzine Ravni ugao Konvertor termičke efikasnosti i efikasnosti goriva Pretvarač brojeva u različitim sistemima brojeva Pretvarač mernih jedinica količine informacija Kursevi valuta Ženska odeća i veličine cipela Muška odeća i cipele veličine Pretvarač ugaone brzine i frekvencije rotacije Konvertor ubrzanja Pretvarač ugaonog ubrzanja Pretvarač gustine Konvertor specifične zapremine Pretvarač momenta inercije Pretvarač momenta sile Pretvarač obrtnog momenta Specifična toplota pretvarača sagorevanja (po masi) Gustina energije i specifična toplota pretvarača sagorevanja (po zapremini) Konvertor temperaturne razlike Koeficijent pretvarača termičke ekspanzije Pretvarač toplotnog otpora Pretvarač toplotne provodljivosti Konvertor specifičnog toplotnog kapaciteta Pretvarač snage izlaganja energije i toplotnog zračenja Pretvarač gustine toplotnog fluksa Pretvarač koeficijenta prenosa toplote Pretvarač zapreminskog protoka Konvertor masenog protoka Konvertor molarnog protoka Konvertor gustine masenog protoka Konvertor molarne koncentracije Konvertor masene koncentracije u rastvoru Dinamički (apsolutni) konvertor viskoziteta Kinematički konvertor viskoziteta Konvertor površinskog napona Konvertor paropropusnosti Konvertor gustine protoka vodene pare Konvertor gustine zvuka Konvertor nivoa zvuka Konvertor osetljivosti mikrofona Konvertor Nivoa zvučnog pritiska (SPL) Konvertor nivoa zvučnog pritiska sa izborom Pretvarač referentnog pritiska Pretvarač osvetljenosti Pretvarač Pretvarač svetlosnog intenziteta i Resolution I Pretvarač jačine svetlosti I frekvencije Pretvarač talasne dužine Dioptrijska snaga i žižna dužina Dioptrijska snaga i uvećanje sočiva (×) Konvertor električnog naboja Pretvarač gustine linearnog naboja Konvertor gustine površinskog naboja Pretvarač zapreminske gustine naelektrisanja Pretvarač električne struje Konvertor gustine linearne struje Konvertor gustine površinske struje Pretvarač gustine površinske struje Pretvarač električnog potencijala i pretvarač napona elektrostatskog Pretvarač električnog otpora Pretvarač električnog otpora Pretvarač električne provodljivosti Pretvarač električne provodljivosti Konvertor električne provodljivosti Pretvarač induktivnosti američkog kabla Nivoi u dBm (dBm ili dBm), dBV (dBV), vati, itd. jedinice Pretvarač magnetne sile Pretvarač jačine magnetnog polja Pretvarač magnetnog fluksa Pretvarač magnetne indukcije Zračenje. Konvertor brzine doze apsorbovanog jonizujućeg zračenja Radioaktivnost. Konvertor radioaktivnog raspada Zračenje. Konvertor doze ekspozicije Zračenje. Konvertor apsorbovane doze Konvertor decimalnog prefiksa Prenos podataka Konverter jedinica za obradu tipografije i slike Konvertor jedinica zapremine drveta Proračun molarne mase Periodni sistem hemijskih elemenata D. I. Mendeljejeva
1 konvencionalna jedinica električne provodljivosti = 0,0001 simensa po metru [S/m]
Početna vrijednost
Preračunata vrijednost
siemens po metru picosiemens po metru po metru po metru po centimetru abmo po metru abmo po centimetru statmo po metru statmo po centimetru siemens po centimetru milisimensu po metru milisimensu po centimetru mikrosimensu po metru mikrosimensu po centimetru konvencionalna jedinica električne provodljivosti ppm konvencionalna jedinica električne provodljivosti , koeficijent. preračunavanje 700 ppm, koeficijent. preračunavanje 500 ppm, koeficijent. preračunavanje 640 TDS, ppm, koeficijent. preračunavanje 640 TDS, ppm, koeficijent. preračunavanje 550 TDS, ppm, koeficijent. preračunavanje 500 TDS, ppm, koeficijent. preračunavanje 700
Više o električnoj provodljivosti
Uvod i definicije
Električna provodljivost (ili električna provodljivost) je mjera sposobnosti tvari da provodi električnu struju ili pomiče električne naboje unutar nje. Ovo je omjer gustine struje i jačine električnog polja. Ako uzmemo u obzir kocku provodljivog materijala sa stranicom od 1 metar, tada će vodljivost biti jednaka električnoj provodljivosti mjerenoj između dvije suprotne strane ove kocke.
Specifična provodljivost je povezana sa provodljivošću sljedećom formulom:
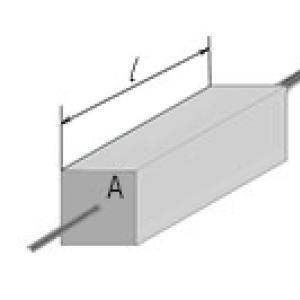
G = σ(A/l)

Gdje G- električna provodljivost, σ - specifična električna provodljivost, A- poprečni presjek provodnika okomit na smjer električne struje i l- dužina provodnika. Ova formula se može koristiti sa bilo kojim vodičem u obliku cilindra ili prizme. Imajte na umu da se ova formula može koristiti i za pravougaoni paralelepiped, jer je to poseban slučaj prizme čija je osnova pravougaonik. Podsjetimo da je električna provodljivost recipročna vrijednost električne otpornosti.
Ljudima koji su daleko od fizike i tehnologije može biti teško da shvate razliku između provodljivosti provodnika i specifične provodljivosti neke supstance. U međuvremenu, naravno, to su različite fizičke veličine. Provodljivost je svojstvo datog vodiča ili uređaja (kao što je otpornik ili kupka za oblaganje), dok je provodljivost svojstvo materijala od kojeg je taj provodnik ili uređaj napravljen. Na primjer, vodljivost bakra je uvijek ista, bez obzira na to kako se oblik i veličina bakrenog predmeta mijenjaju. Istovremeno, vodljivost bakrene žice zavisi od njene dužine, prečnika, mase, oblika i nekih drugih faktora. Naravno, slični predmeti napravljeni od materijala veće provodljivosti imaju veću provodljivost (iako ne uvek).

U Međunarodnom sistemu jedinica (SI) jedinica za električnu provodljivost je Siemens po metru (S/m). Jedinica provodljivosti koja je uključena u njega nazvana je po njemačkom naučniku, pronalazaču i preduzetniku Verneru fon Simensu (1816–1892). Osnovan od njega 1847. godine, Siemens AG (Siemens) je jedna od najvećih kompanija za proizvodnju električne, elektronske, energetske, transportne i medicinske opreme.

Raspon električne provodljivosti je vrlo širok: od materijala s visokom otpornošću kao što je staklo (koje, inače, dobro provodi struju ako se zagrije crveno) ili polimetil metakrilat (pleksiglas) do vrlo dobrih provodnika poput srebra, bakra ili zlata. Električna provodljivost je određena brojem naelektrisanja (elektrona i jona), brzinom kojom se kreću i količinom energije koju mogu nositi. Vodeni rastvori različitih supstanci, koji se koriste, na primer, u kupkama za oblaganje, imaju prosečne vrednosti provodljivosti. Drugi primjer elektrolita sa prosječnim vrijednostima provodljivosti je unutrašnje okruženje tijela (krv, plazma, limfa i druge tekućine).
O vodljivosti metala, poluprovodnika i dielektrika detaljno se govori u sljedećim člancima web stranice Physical Quantity Converter: i Električna provodljivost. U ovom članku ćemo detaljnije govoriti o specifičnoj vodljivosti elektrolita, kao io metodama i jednostavnoj opremi za njeno mjerenje.
Specifična električna provodljivost elektrolita i njeno mjerenje

Specifična provodljivost vodenih otopina u kojima nastaje električna struja kao rezultat kretanja nabijenih iona određena je brojem nosilaca naboja (koncentracija tvari u otopini), brzinom njihovog kretanja (pokretljivost iona zavisi od temperature) i naboja koji nose (određeno valentnošću jona). Stoga u većini vodenih otopina povećanje koncentracije dovodi do povećanja broja iona i, posljedično, do povećanja vodljivosti. Međutim, nakon postizanja određenog maksimuma, specifična provodljivost otopine može početi opadati s daljnjim povećanjem koncentracije otopine. Stoga otopine s dvije različite koncentracije iste soli mogu imati istu provodljivost.
Temperatura također utiče na provodljivost jer kako temperatura raste, joni se kreću brže, što rezultira povećanom provodljivošću. Čista voda je loš provodnik struje. Obična destilovana voda, koja sadrži ugljični dioksid iz zraka u ravnoteži i ukupnu mineralizaciju manju od 10 mg/l, ima specifičnu električnu provodljivost od oko 20 mS/cm. Specifična provodljivost različitih rastvora data je u tabeli ispod.


Za određivanje specifične vodljivosti otopine koristi se mjerač otpora (ommetar) ili vodljivost. To su gotovo identični uređaji, koji se razlikuju samo po mjerilu. Oba mjere pad napona na dijelu strujnog kola kroz koji teče električna struja iz baterije uređaja. Izmjerena vrijednost provodljivosti se ručno ili automatski pretvara u specifičnu provodljivost. Ovo se radi uzimajući u obzir fizičke karakteristike mjernog uređaja ili senzora. Senzori vodljivosti su jednostavni: oni su par (ili dva para) elektroda uronjenih u elektrolit. Senzori za mjerenje provodljivosti se odlikuju konstanta senzora provodljivosti, koji se u najjednostavnijem slučaju definira kao omjer udaljenosti između elektroda D na područje (elektrodu) okomito na strujni tok A
Ova formula dobro funkcionira ako je površina elektroda znatno veća od udaljenosti između njih, jer u ovom slučaju većina električne struje teče između elektroda. Primer: za 1 kubni centimetar tečnosti K = D/A= 1 cm/1 cm² = 1 cm⁻¹. Imajte na umu da senzore provodljivosti s malim elektrodama razmaknutim na relativno velikoj udaljenosti karakteriziraju konstantne vrijednosti senzora od 1,0 cm⁻¹ i više. Istovremeno, senzori s relativno velikim elektrodama smještenim blizu jedna drugoj imaju konstantu od 0,1 cm⁻¹ ili manje. Konstanta senzora za mjerenje električne provodljivosti različitih uređaja kreće se od 0,01 do 100 cm⁻¹.

Teoretska konstanta senzora: lijevo - K= 0,01 cm⁻¹, desno - K= 1 cm⁻¹
Da bi se dobila provodljivost iz izmjerene provodljivosti, koristi se sljedeća formula:
σ = K ∙ G
σ - specifična provodljivost rastvora u S/cm;
K- konstanta senzora u cm⁻¹;
G- provodljivost senzora u siemensu.
Konstanta senzora se obično ne izračunava iz njegovih geometrijskih dimenzija, već se mjeri u određenom mjernom uređaju ili u specifičnoj mjernoj postavci pomoću rješenja poznate provodljivosti. Ova izmjerena vrijednost se unosi u mjerač provodljivosti, koji automatski izračunava provodljivost iz izmjerenih vrijednosti provodljivosti ili otpora otopine. Zbog činjenice da provodljivost zavisi od temperature rastvora, uređaji za njeno merenje često sadrže temperaturni senzor koji meri temperaturu i obezbeđuje automatsku temperaturnu kompenzaciju merenja, odnosno normalizaciju rezultata na standardnu temperaturu od 25°C. .
Najjednostavniji način mjerenja provodljivosti je primjena napona na dvije ravne elektrode uronjene u otopinu i mjerenje struje koja teče. Ova metoda se naziva potenciometrijska. Prema Ohmovom zakonu, provodljivost G je omjer struje I na napon U:
Međutim, nije sve tako jednostavno kao što je gore opisano - postoji mnogo problema pri mjerenju provodljivosti. Ako se koristi jednosmjerna struja, ioni se skupljaju na površinama elektroda. Takođe, može doći do hemijske reakcije na površinama elektroda. To dovodi do povećanja otpora polarizacije na površinama elektroda, što zauzvrat dovodi do pogrešnih rezultata. Ako pokušate izmjeriti otpor, na primjer, otopine natrijevog klorida konvencionalnim testerom, jasno ćete vidjeti kako se očitanja na zaslonu digitalnog uređaja prilično brzo mijenjaju u smjeru povećanja otpora. Kako bi se eliminirao utjecaj polarizacije, često se koristi dizajn senzora od četiri elektrode.
Polarizacija se također može spriječiti ili, u svakom slučaju, smanjiti ako pri mjerenju koristite naizmjeničnu struju umjesto jednosmjerne, pa čak i podesiti frekvenciju ovisno o provodljivosti. Niske frekvencije se koriste za mjerenje niske provodljivosti, gdje je utjecaj polarizacije mali. Više frekvencije se koriste za mjerenje visoke provodljivosti. Obično se frekvencija automatski podešava tokom procesa merenja, uzimajući u obzir dobijene vrednosti provodljivosti rastvora. Moderni digitalni dvoelektrodni mjerači provodljivosti obično koriste složene valne oblike naizmjenične struje i temperaturnu kompenzaciju. Kalibriraju se u fabrici, ali je rekalibracija često potrebna tokom rada, jer se konstanta mjerne ćelije (senzora) mijenja tokom vremena. Na primjer, može se promijeniti kada se senzori zaprljaju ili kada se elektrode podvrgnu fizičkim i kemijskim promjenama.
U tradicionalnom mjeraču provodljivosti s dvije elektrode (ovo je onaj koji ćemo koristiti u našem eksperimentu), naizmjenični napon se primjenjuje između dvije elektrode i mjeri se struja koja teče između elektroda. Ova jednostavna metoda ima jedan nedostatak - ne mjeri se samo otpor otopine, već i otpor uzrokovan polarizacijom elektroda. Da bi se smanjio uticaj polarizacije, koristi se dizajn senzora sa četiri elektrode, kao i premazivanje elektroda platinastom crnom.
Opća mineralizacija
Za određivanje se često koriste uređaji za mjerenje električne provodljivosti ukupna mineralizacija ili sadržaj čvrstih materija(eng. total dissolved solids, TDS). To je mjera ukupne količine organskih i neorganskih tvari sadržanih u tekućini u različitim oblicima: joniziranim, molekularnim (otopljenim), koloidnim i u suspenziji (neotopljenim). Otopljene tvari uključuju sve neorganske soli. Uglavnom su to hloridi, bikarbonati i sulfati kalcijuma, kalijuma, magnezijuma, natrijuma, kao i neke organske materije rastvorene u vodi. Da bi se klasifikovale kao totalna mineralizacija, supstance moraju biti ili rastvorene ili u obliku veoma finih čestica koje prolaze kroz filtere sa prečnikom pora manjim od 2 mikrometra. Supstance koje su stalno suspendovane u rastvoru, ali ne mogu da prođu kroz takav filter, nazivaju se suspendovane čvrste materije(eng. total suspended solids, TSS). Ukupne suspendirane čvrste tvari se obično mjere kako bi se odredio kvalitet vode.

Postoje dvije metode za mjerenje sadržaja čvrstih tvari: gravimetrijska analiza, što je najpreciznija metoda, i merenje provodljivosti. Prva metoda je najpreciznija, ali zahtijeva puno vremena i laboratorijske opreme, jer se voda mora ispariti da bi se dobio suhi ostatak. To se obično radi na 180°C u laboratorijskim uslovima. Nakon potpunog isparavanja, ostatak se vaga na preciznoj vagi.
Druga metoda nije tako precizna kao gravimetrijska analiza. Međutim, to je vrlo zgodna, rasprostranjena i najbrža metoda, jer se radi o jednostavnom mjerenju provodljivosti i temperature koje se izvodi u nekoliko sekundi sa jeftinim mjernim instrumentom. Metoda mjerenja specifične električne provodljivosti može se koristiti zbog činjenice da specifična provodljivost vode direktno ovisi o količini joniziranih tvari otopljenih u njoj. Ova metoda je posebno pogodna za praćenje kvaliteta vode za piće ili procjenu ukupnog broja jona u otopini.
Izmjerena provodljivost ovisi o temperaturi otopine. To jest, što je temperatura viša, to je veća provodljivost, jer se joni u otopini kreću brže kako temperatura raste. Za dobijanje temperaturno nezavisnih mjerenja koristi se koncept standardne (referentne) temperature na koju se svode rezultati mjerenja. Referentna temperatura vam omogućava da uporedite rezultate dobijene na različitim temperaturama. Dakle, mjerač provodljivosti može mjeriti stvarnu provodljivost, a zatim koristiti funkciju korekcije koja će automatski prilagoditi rezultat na referentnu temperaturu od 20 ili 25°C. Ako je potrebna vrlo visoka preciznost, uzorak se može staviti u inkubator, a zatim se mjerač može kalibrirati na istoj temperaturi koja će se koristiti u mjerenjima.
Većina modernih mjerača provodljivosti ima ugrađen temperaturni senzor, koji se koristi i za korekciju temperature i za mjerenje temperature. Najnapredniji instrumenti su sposobni za mjerenje i prikaz izmjerenih vrijednosti u jedinicama provodljivosti, otpornosti, saliniteta, ukupnog saliniteta i koncentracije. Ipak, još jednom napominjemo da svi ovi uređaji mjere samo vodljivost (otpor) i temperaturu. Sve fizičke veličine prikazane na displeju uređaj izračunava uzimajući u obzir izmerenu temperaturu, koja se koristi za automatsku temperaturnu kompenzaciju i dovođenje izmerenih vrednosti na standardnu temperaturu.
Eksperiment: mjerenje ukupne mineralizacije i provodljivosti
Konačno, izvršit ćemo nekoliko eksperimenata za mjerenje provodljivosti koristeći jeftin TDS-3 mjerač ukupne mineralizacije (koji se također naziva salinometar, salinometar ili mjerač provodljivosti). Cijena “neimenovanog” TDS-3 uređaja na eBayu uključujući isporuku u vrijeme pisanja je manja od 3,00 USD. Potpuno isti uređaj, ali sa imenom proizvođača, košta 10 puta više. Ali ovo je za one koji vole da plaćaju za brend, iako postoji velika verovatnoća da će se oba uređaja proizvoditi u istoj fabrici. TDS-3 vrši temperaturnu kompenzaciju iu tu svrhu je opremljen temperaturnim senzorom koji se nalazi pored elektroda. Stoga se može koristiti i kao termometar. Još jednom treba napomenuti da uređaj zapravo ne mjeri samu mineralizaciju, već otpor između dvije žičane elektrode i temperaturu otopine. Automatski izračunava sve ostalo koristeći faktore kalibracije.

Mjerač ukupne mineralizacije može vam pomoći da odredite sadržaj krutih tvari, na primjer kada pratite kvalitet vode za piće ili određujete salinitet vode u akvariju ili slatkovodnom ribnjaku. Također se može koristiti za praćenje kvaliteta vode u sistemima za filtriranje i prečišćavanje vode kako bi se znalo kada je vrijeme za zamjenu filtera ili membrane. Instrument je fabrički kalibrisan sa 342 ppm (delovi na milion ili mg/L) rastvorom natrijum hlorida, NaCl. Opseg mjerenja uređaja je 0–9990 ppm ili mg/l. PPM - dio na milion, bezdimenzionalna mjerna jedinica relativnih vrijednosti, jednaka 1 10⁻⁶ osnovnog indikatora. Na primjer, masena koncentracija od 5 mg/kg = 5 mg u 1.000.000 mg = 5 ppm ili ppm. Kao što je postotak stoti dio, ppm je milioniti dio. Procenti i ppm su vrlo slični po značenju. Delovi na milion, za razliku od procenata, korisni su za indikaciju koncentracije veoma slabih rastvora.
Uređaj mjeri električnu provodljivost između dvije elektrode (tj. recipročnu vrijednost otpora), zatim konvertuje rezultat u specifičnu električnu provodljivost (u engleskoj literaturi se često koristi skraćenica EC) koristeći gornju formulu vodljivosti, uzimajući u obzir konstantu senzora K, zatim vrši još jednu konverziju množenjem rezultirajuće provodljivosti sa faktorom konverzije od 500. Rezultat je ukupna vrijednost saliniteta u dijelovima na milion (ppm). Više detalja o tome u nastavku.

Ovaj mjerač ukupne mineralizacije ne može se koristiti za ispitivanje kvaliteta vode s visokim sadržajem soli. Primjeri supstanci s visokim udjelom soli su neke namirnice (obična supa s normalnim udjelom soli od 10 g/l) i morska voda. Maksimalna koncentracija natrijum hlorida koju ovaj uređaj može da izmeri je 9990 ppm ili oko 10 g/l. Ovo je tipična koncentracija soli u hrani. Ovaj uređaj također ne može mjeriti salinitet morske vode, jer on obično iznosi 35 g/l ili 35.000 ppm, što je mnogo više nego što uređaj može izmjeriti. Ako pokušate izmjeriti tako visoku koncentraciju, instrument će prikazati poruku o grešci Err.
TDS-3 mjerač saliniteta mjeri specifičnu provodljivost i koristi takozvanu “skalu od 500” (ili “NaCl skalu”) za kalibraciju i konverziju u koncentraciju. To znači da se za dobivanje koncentracije ppm vrijednost provodljivosti u mS/cm množi sa 500. To jest, na primjer, 1,0 mS/cm se množi sa 500 da bi se dobilo 500 ppm. Različite industrije koriste različite razmjere. Na primjer, u hidroponici se koriste tri vage: 500, 640 i 700. Jedina razlika između njih je u upotrebi. Skala 700 temelji se na mjerenju koncentracije kalijevog hlorida u rastvoru, a konverzija specifične provodljivosti u koncentraciju se vrši na sledeći način:
1,0 mS/cm x 700 daje 700 ppm
Skala 640 koristi faktor konverzije od 640 za pretvaranje mS u ppm:
1,0 mS/cm x 640 daje 640 ppm
U našem eksperimentu prvo ćemo izmjeriti ukupnu mineralizaciju destilovane vode. Mjerač saliniteta pokazuje 0 ppm. Multimetar pokazuje otpor od 1,21 MOhm.

Za eksperiment ćemo pripremiti otopinu natrijum klorida NaCl koncentracije 1000 ppm i izmjeriti koncentraciju pomoću TDS-3. Za pripremu 100 ml otopine potrebno je otopiti 100 mg natrijum hlorida i dodati destilovanu vodu u 100 ml. Izvagati 100 mg natrijum hlorida i staviti u merni cilindar, dodati malo destilovane vode i mešati dok se so potpuno ne rastvori. Zatim dodajte vodu do oznake od 100 ml i ponovo dobro promiješajte.
Merenje otpora između dve elektrode izrađene od istog materijala i istih dimenzija kao i TDS-3 elektrode; multimetar pokazuje 2,5 kOhm
Za eksperimentalno određivanje provodljivosti koristile smo dvije elektrode izrađene od istog materijala istih dimenzija kao i TDS-3 elektrode. Izmjereni otpor je bio 2,5 KOhm.
Sada kada znamo otpor i koncentraciju natrijum hlorida u ppm, možemo približno izračunati ćelijsku konstantu TDS-3 merača saliniteta koristeći gornju formulu:
K = σ/G= 2 mS/cm x 2,5 kOhm = 5 cm⁻¹

Ova vrijednost od 5 cm⁻¹ je bliska izračunatoj konstantnoj vrijednosti TDS-3 mjerne ćelije sa dimenzijama elektroda navedenim u nastavku (vidi sliku).
- D = 0,5 cm - razmak između elektroda;
- Š = 0,14 cm - širina elektroda
- L = 1,1 cm - dužina elektroda
TDS-3 senzorska konstanta je K = D/A= 0,5/0,14x1,1 = 3,25 cm⁻¹. Ovo se ne razlikuje mnogo od gore dobivene vrijednosti. Podsjetimo da gornja formula dozvoljava samo približnu procjenu konstante senzora.
Da li vam je teško prevesti mjerne jedinice s jednog jezika na drugi? Kolege su spremne da vam pomognu. Postavite pitanje u TCTerms i u roku od nekoliko minuta dobićete odgovor.
Sposobnost elektrolita da postanu provodnici kada se na njih dovede električna struja naziva se elektrolitička provodljivost. Razmotrimo solne i kisele elektrolite, kao i bazne elektrolite vezane za vodene otopine. Ove tvari se razlikuju po tome što je koncentracija aniona (negativno nabijenih iona) i kationa (pozitivno nabijenih iona) nastalih u njima uslijed elektrolitičke disocijacije 2 prilično visoka. Otopine elektrolita pripadaju drugoj vrsti provodnika. Njihova vodljivost u električnom polju, za razliku od prve grupe provodnika, posljedica je jonske aktivnosti.
Provodnici imaju sposobnost otpora (R). Prema Ohmovom zakonu, ova veličina je u direktnoj proporciji sa dužinom provodnika ( l ), i obrnuto je proporcionalan površini (S) njegovog poprečnog presjeka. Koeficijent proporcionalnosti - pokazatelj otpornosti (ρ) centimetarskog vodiča sa poprečnim presjekom od 1 cm2:
Električna provodljivost je označena kao Cm (S) i mjeri se u SI jedinicama - u simensu. Dobijamo sljedeći izraz: Ohm −1 = kg −1 .m −2 .s 3 A 2 .
Razlikovati specifična električna provodljivost ( K- kappa) i molarili drugo ekvivalent ( Λ - lambda) 3 .
Napomena 1: Koncentracije su date u gramima po kilogramu otopine.
Napomena 2:Termin "elektrolitička disocijacija" označava djelomičnu ili potpunu molekularnu razgradnju na katione i anione rastvorljive supstance.
Napomena 3: Upotreba termina „ekvivalentna električna provodljivost” se ne preporučuje. Osnova je uputstvo koje je izradila Komisija Sindikata čiste i primijenjene hemije. Međunarodna elektrohemijska nomenklatura IUPAC-a usvojila je termin "molarna provodljivost".
1. Električna provodljivost
Koristi se za kvantificiranje sposobnosti otopina elektrolita da provode struju. To je inverzno specifičnom otporu - indikator otopine koja ispunjava prostor između elektroda površine 1 cm2, postavljene na centimetarskoj udaljenosti jedna od druge:


Ova vrijednost je određena prirodom otopine elektrolita, njegovom temperaturom i zasićenošću. Specifična električna provodljivost raste s porastom temperature, što je karakteristična karakteristika takvih elektrolita u odnosu na provodnike prve vrste. Brzina kretanja iona povećava se zbog smanjenja solvatacije iona i smanjenja viskoznosti otopine.
Slika 1 jasno pokazuje kako se specifična električna provodljivost mijenja ovisno o koncentraciji otopina. Mjerna jedinica za ovu vrijednost je S/m - simens po metru (1 S/m = 1 Ohm-1m-1). Najčešće korišteni derivat je µS/cm.
Specifična električna provodljivost se prvo povećava sa povećanjem zasićenja, a nakon dostizanja određenog maksimuma opada. Treba napomenuti da je za jake elektrolite zavisnost jasno izražena, ali je za slabe otopine mnogo slabija. Prisutnost indikatora s graničnim vrijednostima na krivuljama jakih otopina ukazuje na to da brzina ionskog kretanja u razrijeđenim elektrolitima samo neznatno ovisi o njihovoj zasićenosti i u početku raste direktno proporcionalno broju iona. S povećanjem koncentracije povećava se interakcija iona, što dovodi do smanjenja brzine kretanja. Maksimalni presjek na krivulji slabog elektrolita nastaje zbog smanjenja stupnja disocijacije uzrokovanog povećanjem koncentracije. Nakon postizanja određene zasićenosti, koncentracija raste brže od numeričkog sadržaja iona u otopini. Da bi se opisao efekat ionske interakcije i zasićenja elektrolita na njihovu električnu provodljivost, koncept „molarna provodljivost ».
2. Molarna provodljivost
Λ (molarna električna provodljivost- vidi napomenu 4) - recipročna vrijednost otpora elektrolita za vodič sa sadržajem tvari od 1 mol, koji je postavljen između elektroda postavljenih na centimetarskoj udaljenosti jedna od druge. Da bi se odredio odnos između molarne električne provodljivosti i molarne koncentracije otopine (M) i specifične električne provodljivosti (K), izveden je sljedeći odnos:

Napomena 4: Električna provodljivost 1N otopine elektrolita pozvaoekvivalentan (Λ = 1000 TO /N). Koncentracija (N) je izražena u g-eq/l. Međutim, uputstva IUPAC-a ne preporučuju korištenje izraza “ekvivalentna električna provodljivost”.
Molarna električna provodljivost u odnosu i na jake i na slabe elektrolite napreduje sa smanjenjem koncentracije (odnosno, sa smanjenjem zasićenosti rastvora (V = 1/M), njegova električna provodljivost raste). Ona dostiže granicuΛ 0. Ovaj maksimum se pozivamolarna električna provodljivost pri beskonačnom razrjeđivanju.
 Za slabe elektrolite (slika 2), ovisnost ove vrijednosti o koncentraciji određena je uglavnom povećanjem stepena disocijacije uzrokovanog razrjeđivanjem otopine elektrolita. U jakim elektrolitima, kako se zasićenje smanjuje, interakcija jona slabi. Intenzitet njihovih pokreta raste, što za sobom povlačipovećanje molarne električne provodljivosti otopine.
Za slabe elektrolite (slika 2), ovisnost ove vrijednosti o koncentraciji određena je uglavnom povećanjem stepena disocijacije uzrokovanog razrjeđivanjem otopine elektrolita. U jakim elektrolitima, kako se zasićenje smanjuje, interakcija jona slabi. Intenzitet njihovih pokreta raste, što za sobom povlačipovećanje molarne električne provodljivosti otopine.
Istraživanje F. Kohlrausch-a pokazuje kako svaki ion doprinosi molarnoj električnoj provodljivosti elektrolita u beskonačno razrijeđenim otopinama (krajnje razrjeđivanje). Utvrdio je da je λ0 (granična ionska provodljivost) zbir molarne provodljivosti koju pokazuju kation i anion, a također je izveo formulacijuzakon nezavisnosti kretanja jona:
Pri beskonačnom razrjeđivanju elektrolita, molarna električna provodljivost jednaka je zbroju kationske i anionske pokretljivosti u elektrolitičkoj otopini:
Λ 0 = K 0 + + K 0 - (4)
3. Faktori koji određuju električnu provodljivost otopine
Koncentracija soli i temperatura su glavni faktori koji određuju električnu provodljivost vode. Glavna mineralna komponenta vode u prirodi:
Kationi K + , Na + , Mg 2+ , Ca 2+ ;
Anjoni HCO 3 - , Cl - , SO 4 2- .
Prisutni su i drugi joni (Al 3+, Fe 3+, Mn 2+, Fe 2+, H 2 PO 4 -, NO 3 -, HPO 4 2-), ali je njihov uticaj na električnu provodljivost beznačajan, jer obično malo sadržaja u vodi. Vrijednosti električne provodljivosti nam omogućavaju da procijenimo nivo njegove mineralizacije. U prirodi je specifična električna provodljivost vode 100-2000 µS/cm sa salinitetom od 50 do 1000 mg/l (kod padavina -10-120 µS/cm sa salinitetom od 3-60 mg/l).
4. Električna provodljivost. Izvođenje proračuna
Primjenjujući formule 3 i 4, i imajući pri ruci indikatore ionske električne provodljivosti ( TO), moguće je izračunati električnu provodljivost ( TO IΛ ) za bilo koje rješenje:
K = (K + + K - ) M /1000 (5)
U Tabeli 1 datoj ovdje možete pronaći ionsku i graničnu ionsku električnu provodljivost karakterističnu za uobičajene ione u razrijeđenim otopinama (temperatura +18°C).
Tabela 1

Primjer 1: Potrebno je izvršiti proračune na osnovu specifične električne provodljivosti (K). Rastvor KCl (kalijum hlorid) 0,0005 M.
Rješenje: Do disocijacije KCl u vodenim rastvorima dolazi do K+ i Cl - jona. Koristeći priručnik ili podatke date u tabeli 6, nalazimo indikatore ionske električne provodljivosti na 18°C u razrijeđenim otopinama:
K + - koncentracija jona 0,0005 M (λ = 63,7 Ohm -1 cm 2 mol -1);
Koncentracija jona Cl - - 0,0005 M (λ = 64,4 Ohm -1, cm 2, mol -1).
Ako trebate izračunati specifičnu električnu provodljivost otopine elektrolita, koja sadrži mješavinu različitih iona, formula ima sljedeći oblik:
k = Σ λ i Mi /1000 (6)
Računica, n Gore navedeno vrijedi za jake elektrolite. Za slaba rješenja bit će potrebno koristiti dodatne proračune koji se odnose na korištenje konstanti disocijacije i određivanje zasićenja slobodnim ionima. Molarna električna provodljivost, na primjer, otopine 0,001 M octene kiseline -Λ = 41 Ohm-1.cm2.mol-1 (18 °C), međutim, primjena formule (6) će rezultirati vrijednošću približno jednakom 351.9 Ohm -1.cm 2.mol -1.
Primjer 2: Potrebno je saznati specifičnu električnu provodljivost (k) za otopinu 0,001 M octene kiseline (CH3COOH).
Rješenje: Do disocijacije slabih vodenih rastvora sirćetne kiseline dolazi do CH 3 COO - i H + jona (CH 3 COOH ↔ H + + CH 3 COO -).
Konstanta - KSN 3 COOH = [H+]. / [CH 3 COOH].
Za jednobazičnu kiselinu - [H+] = = x.
Zasićenost disociranim molekulima slabe kiseline u odnosu na ukupnu koncentraciju je preniska, pa se stoga može uzeti kao M (M = 0,001 mol/l).
KSN 3 COOH = x 2 /M, K CH3COOH = 1,8. 10 -5.
Prema stanju: zasićenost kiselinom 0,001 M (0,001 g-ekviv/l).
Imajući podatke o zasićenosti H + i CH 3 COO - jona, kao i o njihovoj električnoj provodljivosti (λ n+ 0,001 = 311 Ohm -1. cm 2. mol -1, λ snsoo- 0.001 ≈ 40.9 Ohm -1. cm 2. mol -1), izračunava se specifična električna provodljivost “k”.
k = (311 + 40,9) . 0,001/1000 = 3,52,10 -4 Ohm -1 cm -1 (S/cm) ili 352 µS/cm.
Poštovani, ako imate potrebu da ispravite indikator “Električna provodljivost” kako biste kvalitet vode doveli na određene standarde, obratite se stručnjacima kompanije Waterman. Ponudićemo Vam optimalnu tehnološku šemu za prečišćavanje vode.
Ko zna formulu vode od školskih dana? Naravno, to je to. Vjerovatno je da iz cijelog kursa hemije mnogi koji je tada ne proučavaju na specijalizovan način imaju samo znanje o tome šta znači formula H 2 O. Ali sada ćemo pokušati razumjeti što je moguće detaljnije i dublje koja su njegova glavna svojstva i zašto postoji život bez njega.na planeti Zemlji nemoguće.
Voda kao supstanca
Molekul vode, kao što znamo, sastoji se od jednog atoma kiseonika i dva atoma vodika. Njegova formula je zapisana na sljedeći način: H 2 O. Ova supstanca može imati tri stanja: čvrsto - u obliku leda, gasovito - u obliku pare, i tečno - kao supstanca bez boje, ukusa i mirisa. Inače, ovo je jedina supstanca na planeti koja može postojati u sva tri stanja istovremeno u prirodnim uslovima. Na primjer: na polovima Zemlje nalazi se led, u okeanima voda, a isparavanje pod sunčevim zracima je para. U tom smislu, voda je anomalna.
Voda je takođe najzastupljenija supstanca na našoj planeti. Prekriva površinu planete Zemlje za gotovo sedamdeset posto - to su okeani, brojne rijeke s jezerima i glečeri. Većina vode na planeti je slana. Neprikladan je za piće i za uzgoj. Slatka voda čini samo dva i po posto ukupne količine vode na planeti.
Voda je veoma jak i kvalitetan rastvarač. Zahvaljujući tome, hemijske reakcije u vodi se odvijaju ogromnom brzinom. Ovo isto svojstvo utiče na metabolizam u ljudskom tijelu. da je tijelo odraslog čovjeka sedamdeset posto vode. Kod djeteta je ovaj procenat još veći. Do starosti ova brojka opada sa sedamdeset na šezdeset posto. Inače, ova osobina vode jasno pokazuje da je ona osnova ljudskog života. Što više vode u tijelu, to je zdravije, aktivnije i mlađe. Zato naučnici i doktori iz svih zemalja neumorno insistiraju na tome da treba puno piti. To je voda u svom čistom obliku, a ne zamjena u obliku čaja, kafe ili drugih pića.
Voda oblikuje klimu na planeti i to nije pretjerivanje. Tople okeanske struje zagrijavaju čitave kontinente. To se događa zbog činjenice da voda apsorbira mnogo sunčeve topline, a zatim je oslobađa kada se počne hladiti. Na taj način reguliše temperaturu na planeti. Mnogi naučnici kažu da bi se Zemlja odavno ohladila i pretvorila u kamen da nije bilo toliko vode na zelenoj planeti.

Svojstva vode
Voda ima mnoga vrlo zanimljiva svojstva.
Na primjer, voda je najmobilnija tvar nakon zraka. Iz školskog kursa mnogi se vjerovatno sjećaju takvog koncepta kao što je ciklus vode u prirodi. Na primjer: mlaz isparava pod utjecajem direktne sunčeve svjetlosti i pretvara se u vodenu paru. Nadalje, ova para se negdje prenosi vjetrom, skuplja se u oblacima, ili čak i pada u planine u obliku snijega, grada ili kiše. Dalje, potok ponovo teče sa planina, delimično isparavajući. I tako - u krugu - ciklus se ponavlja milione puta.
Voda takođe ima veoma visok toplotni kapacitet. Zbog toga se vodena tijela, posebno okeani, vrlo sporo hlade tokom prijelaza iz tople sezone ili doba dana u hladno. Nasuprot tome, kako temperatura zraka raste, voda se zagrijava vrlo sporo. Zbog toga, kao što je već spomenuto, voda stabilizira temperaturu zraka na cijeloj našoj planeti.
Nakon žive, voda ima najveću površinsku napetost. Nemoguće je ne primijetiti da kap slučajno prolivena na ravnu površinu ponekad postane impresivna mrlja. Ovo pokazuje viskoznost vode. Još jedno svojstvo se pojavljuje kada temperatura padne na četiri stepena. Kada se voda ohladi do ove tačke, postaje lakša. Stoga led uvijek pliva na površini vode i stvrdne se u koru, prekrivajući rijeke i jezera. Zahvaljujući tome, riba se ne smrzava u rezervoarima koji se smrzavaju zimi.
Voda kao provodnik struje
Prvo, trebali biste naučiti šta je električna provodljivost (uključujući vodu). Električna provodljivost je sposobnost tvari da provodi električnu struju kroz sebe. Prema tome, električna provodljivost vode je sposobnost vode da provodi struju. Ova sposobnost direktno zavisi od količine soli i drugih nečistoća u tečnosti. Na primjer, električna provodljivost destilovane vode je gotovo minimizirana zbog činjenice da je takva voda pročišćena od raznih aditiva koji su toliko potrebni za dobru električnu provodljivost. Odličan provodnik struje je morska voda u kojoj je koncentracija soli vrlo visoka. Električna provodljivost također ovisi o temperaturi vode. Što je temperatura viša, to je veća električna provodljivost vode. Ovaj obrazac je otkriven kroz više eksperimenata fizičara.

Merenje provodljivosti vode
Postoji takav termin - konduktometrija. Ovo je naziv jedne od metoda elektrohemijske analize zasnovane na električnoj provodljivosti rastvora. Ova metoda se koristi za određivanje koncentracije soli ili kiselina u otopinama, kao i za kontrolu sastava nekih industrijskih otopina. Voda ima amfoterna svojstva. Odnosno, u zavisnosti od uslova, sposoban je da pokaže i kisela i bazna svojstva - delujući i kao kiselina i kao baza.
Uređaj koji se koristi za ovu analizu ima vrlo sličan naziv - mjerač provodljivosti. Koristeći konduktometar, mjeri se električna provodljivost elektrolita u otopini koja se analizira. Možda je vrijedno objasniti još jedan pojam - elektrolit. To je supstanca koja se, kada se otopi ili otopi, raspada na ione, zbog čega se zatim provodi električna struja. Jon je električno nabijena čestica. Zapravo, konduktometar, uzimajući kao osnovu određene jedinice električne provodljivosti vode, određuje njenu specifičnu električnu provodljivost. Odnosno, određuje električnu provodljivost određene zapremine vode uzete kao početne jedinice.
Još prije početka sedamdesetih godina prošlog vijeka za označavanje provodljivosti elektriciteta korištena je mjerna jedinica „mo“, koja je bila derivat druge veličine – Ohma, koja je osnovna jedinica otpora. Električna provodljivost je veličina obrnuto proporcionalna otporu. Sada se mjeri u Siemensu. Ova količina je dobila ime u čast njemačkog fizičara - Werner von Siemens.
Siemens
Siemens (može biti označen ili Cm ili S) je recipročna vrijednost Ohma, što je jedinica mjerenja električne provodljivosti. Jedan cm je jednak svakom provodniku čiji je otpor 1 ohm. Siemens se izražava kroz formulu:
- 1 cm = 1: Ohm = A: B = kg −1 m −2 s³A², gdje je
A - amper,
V - volt.

Toplotna provodljivost vode
Sada razgovarajmo o sposobnosti tvari da prenosi toplinsku energiju. Suština fenomena je da se kinetička energija atoma i molekula, koji određuju temperaturu datog tijela ili tvari, prilikom njihove interakcije prenosi na drugo tijelo ili tvar. Drugim rečima, toplotna provodljivost je razmena toplote između tela, supstanci, kao i između tela i supstance.
Toplotna provodljivost vode je takođe veoma visoka. Ljudi koriste ovo svojstvo vode svaki dan, a da to ne primjećuju. Na primjer, sipanje hladne vode u posudu i hlađenje pića ili hrane u njoj. Hladna voda uzima toplinu iz boce ili posude, dajući hladnoću zauzvrat; moguća je i obrnuta reakcija.
Sada se isti fenomen lako može zamisliti na planetarnoj skali. Okean se tokom leta zagreva, a zatim se, sa početkom hladnog vremena, polako hladi i odaje svoju toplotu vazduhu, zagrevajući tako kontinente. Nakon što se tokom zime ohladi, okean počinje da se zagrijava veoma sporo u odnosu na kopno i predaje svoju hladnoću kontinentima koji čame na ljetnom suncu.

Gustina vode
Gore je opisano da ribe zimi žive u ribnjaku zbog činjenice da se voda stvrdne u koru na cijeloj njihovoj površini. Znamo da voda počinje da se pretvara u led na temperaturi od nula stepeni. Zbog činjenice da je gustina vode veća od njene gustine, ona pluta i smrzava se na površini.
svojstva vode
Takođe, pod različitim uslovima, voda može biti i oksidaciono i redukciono sredstvo. Odnosno, voda, odustajući od svojih elektrona, postaje pozitivno nabijena i oksidira. Ili dobija elektrone i postaje negativno nabijen, što znači da se obnavlja. U prvom slučaju voda oksidira i naziva se mrtvom. Ima vrlo moćna baktericidna svojstva, ali ne morate ga piti. U drugom slučaju, voda je živa. Osnažuje, stimuliše organizam na oporavak i daje energiju ćelijama. Razlika između ova dva svojstva vode izražava se pojmom "oksidaciono-redukcioni potencijal".

Na šta voda može da reaguje?
Voda je sposobna reagirati sa gotovo svim tvarima koje postoje na Zemlji. Jedina stvar je da je za pojavu ovih reakcija potrebno osigurati odgovarajuću temperaturu i mikroklimu.
Na primjer, na sobnoj temperaturi voda dobro reagira s metalima kao što su natrij, kalij, barij - nazivaju se aktivnim. Sa halogenima - ovo je fluor, hlor. Kada se zagreje, voda dobro reaguje sa gvožđem, magnezijumom, ugljem i metanom.
Uz pomoć različitih katalizatora, voda reagira s amidima i esterima karboksilnih kiselina. Katalizator je tvar koja kao da gura komponente prema međusobnoj reakciji, ubrzavajući je.
Ima li vode još negde osim Zemlje?
Do sada nije otkrivena voda ni na jednoj planeti Sunčevog sistema osim na Zemlji. Da, sugeriraju njegovo prisustvo na satelitima džinovskih planeta kao što su Jupiter, Saturn, Neptun i Uran, ali za sada naučnici nemaju tačne podatke. Postoji još jedna hipoteza, koja još nije u potpunosti potvrđena, o podzemnoj vodi na planeti Mars i na Zemljinom satelitu, Mjesecu. Što se tiče Marsa, generalno su iznesene brojne teorije da je na ovoj planeti nekada postojao okean, a njegov mogući model su čak osmislili naučnici.

Izvan Sunčevog sistema postoji mnogo velikih i malih planeta na kojima, prema naučnicima, može biti vode. Ali za sada ne postoji ni najmanja prilika da se u to sa sigurnošću uvjerimo.
Kako se toplinska i električna provodljivost vode koristi u praktične svrhe
Zbog činjenice da voda ima veliki toplotni kapacitet, koristi se u toplovodima kao rashladno sredstvo. Osigurava prijenos topline od proizvođača do potrošača. Mnoge nuklearne elektrane također koriste vodu kao odlično rashladno sredstvo.
U medicini se led koristi za hlađenje, a para za dezinfekciju. Led se koristi iu sistemu javne prehrane.
U mnogim nuklearnim reaktorima voda se koristi kao moderator kako bi se osiguralo uspješno odvijanje nuklearne lančane reakcije.
Voda pod pritiskom se koristi za cijepanje, lomljenje i čak rezanje stijena. Ovo se aktivno koristi u izgradnji tunela, podzemnih prostorija, skladišta i podzemnih željeznica.
Zaključak
Iz članka proizlazi da je voda po svojim svojstvima i funkcijama najnezamjenjiva i najnevjerovatnija supstanca na Zemlji. Da li život osobe ili bilo kojeg drugog živog bića na Zemlji zavisi od vode? Apsolutno da. Da li ova supstanca doprinosi ljudskoj naučnoj aktivnosti? Da. Da li voda ima električnu provodljivost, toplotnu provodljivost i druga korisna svojstva? Odgovor je takođe „da“. Druga stvar je što je na Zemlji sve manje vode, a posebno čiste vode. A naš zadatak je da ga (a samim tim i sve nas) sačuvamo i zaštitimo od izumiranja.
Specifična električna provodljivost (električna provodljivost)
- kvantitativna karakteristika sposobnosti vode da provodi električnu struju.
Ova sposobnost je direktno povezana sa koncentracijom jona u vodi. Provodni joni dolaze iz rastvorenih soli i neorganskih materijala kao što su alkalije, hloridi, sulfidi i karbonatna jedinjenja, itd. Što je više jona prisutno, to je veća provodljivost vode.
Joni provode električnu energiju zbog svojih pozitivnih i negativnih naboja. Kada se tvari otapaju u vodi, cijepaju se na pozitivno nabijene (kationske) i negativno nabijene (anionske) čestice. Kada se otopljene tvari razgrađuju u vodi, koncentracije svakog pozitivnog i negativnog naboja ostaju jednake. To znači da iako se provodljivost vode povećava s dodatkom jona, ona ostaje električno neutralna
U većini slučajeva, specifična električna provodljivost površinskih voda kopna je približna karakteristika koncentracije anorganskih elektrolita u vodi - Na kationa+ , K + , Ca 2+ , Mg 2+ i Clˉ, SO 4 2-, HCO 3 - anjoni . Prisustvo drugih jona, npr. Fe (II), Fe (III), Mn(II), NO 3 - , HPO 4 2- obično ima mali uticaj na vrednost električne provodljivosti, jer se ovi joni retko nalaze u vodi u značajnim količinama. Vodik i hidroksilni joni u opsegu svojih uobičajenih koncentracija u površinskim vodama kopna praktično nemaju utjecaja na električnu provodljivost. Uticaj rastvorenih gasova je podjednako mali.
Provodljivost se može izmjeriti primjenom naizmjenične električne struje (I) na dvije elektrode uronjene u otopinu i mjerenjem rezultirajućeg napona (V). Tokom ovog procesa, kationi migriraju na negativnu elektrodu, anjoni na pozitivnu elektrodu i otopina djeluje kao električni provodnik. Napon se koristi za mjerenje vodootpornosti, koja se zatim pretvara u provodljivost. Vodljivost je recipročna vrijednost otpora i mjeri se u količini provodljivosti na određenoj udaljenosti.
Jedinica za električnu provodljivost je Siemens po 1 m (S/m).Za vodu se kao jedinica mjere koriste izvedene vrijednosti - miliSiemens po 1 m (mS/m) ili mikroSiemens po 1 cm (μS/cm). Za vrlo čistu vodu nezgodno je raditi s vrijednošću provodljivosti, pa se češće koristi termin otpornost mjerena u Ohm/m (KOhm/cm ili MOhm/cm). Tako, na primjer, strVodljivost rijeka može biti u rasponu od 50 do 1500 µS/cm, ddestilovana voda ima provodljivost u rasponu od 0,5 do 5 µS/cm, ultra čista dejonizovana voda 10-18 MOhm/cm.
Provodljivost u potocima i rijekama prvenstveno zavisi od geologije područja kroz koje voda teče. Potoci koji teku kroz područja s granitnim stijenama obično imaju nižu provodljivost jer se granit sastoji od inertnijih materijala koji se ne ioniziraju (otapaju u jonske komponente) kada se peru u vodi. S druge strane, potoci koji teku kroz područja sa glinovitim tlom imaju tendenciju da budu provodljiviji zbog prisustva materijala koji ioniziraju kada se ispiru vodom. Dotoci podzemnih voda mogu imati slične efekte u zavisnosti od toga gdje teku. Ispuštanja u rijeke mogu promijeniti provodljivost u zavisnosti od njihovog sastava. Neispravan kanalizacioni sistem će povećati provodljivost zbog prisustva hlorida, fosfata i nitrata; izlivanje nafte će smanjiti provodljivost.
Vodljivost vode mora se precizno izmjeriti pomoću kalibriranog uređaja - mjerača provodljivosti. Geometrijska svojstva elektroda direktno utiču na provodljivost; odnosno vodljivost je obrnuto proporcionalna udaljenosti između elektroda i proporcionalna površini elektroda. Ovaj geometrijski odnos poznat je kao ćelijska konstanta. Konstantno mjerenje ćelije i otpora koje se mora provjeriti i prilagoditi ako je potrebno.
Pored geometrijskih svojstava elektrode u uređaju, a na provodljivost utiče i temperatura: što je voda toplija, to je veća provodljivost. Iz tog razloga, električna provodljivost je prijavljena kao provodljivost na 25 stepeni Celzijusa (25 °C).Povećanje temperature otopine dovest će do smanjenja njegove viskoznosti i povećanja pokretljivosti iona u otopini. Povećanje temperature može dovesti i do povećanja broja jona u otopini zbog disocijacije molekula. Pošto provodljivost rastvora zavisi od ovih faktora, povećanje temperature rastvora će dovesti do povećanja njegove provodljivosti. Poznavajući ovu zavisnostmnogi instrumenti automatski ispravljaju stvarno očitanje kako bi prikazali vrijednost koja bi se teoretski posmatrala pri nominalnoj temperaturi od 25°. Ovo se obično radi pomoću temperaturnog senzora ugrađenog u senzor provodljivosti i softverskog algoritma ugrađenog u mjerač provodljivosti. Međutim zaLinearna temperaturna kompenzacija pretpostavlja da temperaturni koeficijent varijacije ima istu vrijednost za sve mjerene temperature. Ova pretpostavka je netačna; ali za mnoga mjerenja to ne daje značajan doprinos ukupnoj mjernoj nesigurnosti prijavljenog rezultata.
http://www.iwinst.org/wp-content/uploads/2012/04/Conductivity-what-is-it.pdfhttps://hmc.usp.org/sites/default/files/documents/HMC/GCs-Pdfs/c645.pdf
https://www.google.ru/urlsa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0ahUKEwjR9Kautv_WAhVFP5oKHRb4D3MQFgg7MAI&url=http%3A%2F%2Fwww.fondriest.com%2Fenurements2%Fenvironmental%Fenducts2%Fenvironmental salinity-tds%2F&usg=AOvVaw31-HAReIg1Tn1CDOMaAVim
Zbornik smjernica tima za čistu vodu za praćenje i procjenu sliva Državnog odbora za kontrolu vodnih resursa FS-3.1.3.0(EC)V2e 4/27/2004
https://www.reagecon.com/pdf/technicalpapers/Effect_of_Temperature_TSP-07_Issue3.pdf
RD 52.24.495-2005 Vodični indeks i specifična električna provodljivost vode. Metodologija izvođenja mjerenja elektrometrijskom metodom