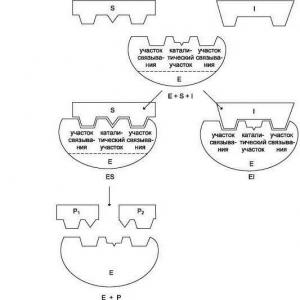
Piridin tıbbi maddeler türevleri. Heterosiklik bileşikler Çaydan kafeinin izolasyonu
Mol. m.79.1; renksiz özel özelliklere sahip sıvı. koku; e.n. -42.7 0 C, kp 115,4°C/760 mmHg Madde, 13,2°C / 10 mmHg; 0,9819: 1,5095; m 7,30 x x 10 -30 C m; g 3,7 10-2 N/m (25 0 C); h 0,885 mPa·s (25 0°C); P ile 135,62 kJ/mol K) (17 0 C), - 2783 kJ/mol. Suyla ve çoğu organik maddeyle her bakımdan karışabilir. r-koruyucular; su ile azeotropik bir karışım oluşturur (kaynama noktası 94 0 C, ağırlıkça %58 P.).
P.-baz (
R ka 5.20). inorg'dan. to-tami alkil halojenürlerle kararlı tuzlar oluşturur -piridinyum tuzları ,
metal halojenürler, S02, S03, Br2, H2O-kompleks bileşikleri ile. Tipik türevler: (C5H5N HC1) 2 PtCl2 (en. 262-264°C, ayrışmayla birlikte), C5H5N HC12HgCl2 (en. 177-178°C).
Aromatik özelliğe sahiptir. Aziz sen; Negatif nedeniyle sürü halinde tek bir kapalı sistem oluşturan 6p elektronu içerir. tümevarım N atomunun etkisiyle, özellikle 2, 4 ve 6 pozisyonlarındaki C atomlarının elektron yoğunluğu azalır (p-eksik heterosikl).
Elektrof. ikame büyük zorluklarla ilerler (P., elektrof ikame etme yeteneği açısından nitrobenzene yakındır) ve 3. konuma gider. Bu bölgelerin çoğu, orijinal Comm'un bir kesiminde asidik bir ortamda ilerler. P. artık kendisi değil, onun tuzu. P., t-re 300 0 C'de dumanlı H2S04'te yalnızca NaN03 veya KNO3'ün etkisi altında nitratlanır ve küçük bir verimle 3-nitropiridin oluşturulur; 220-270 0 C'de Hg sülfat varlığında oleum ile piridin-3-sülfonik asit halinde sülfonatlandı. 155 0 C'de P. üzerindeki cıva asetatın etkisi altında 3-piridilmerkürasetat oluşur; daha yüksek t-rah-di- ve çoklu ikame edilmiş türevlerde. Br2'nin oleumdaki 300 0 C'deki etkisi, 3-bromo- ve 3,5-dibromo-piridinlerin bir karışımına yol açar. Daha yüksek bir t-re'de (yaklaşık 500 0 C), reaksiyon radikal bir mekanizmaya göre ilerler; p-tion ürünleri - 2-bromo- ve 2,6-dibromopiridinler. Radikal reaksiyonlar ayrıca P.'nin fenildiazonyum hidrat ile etkileşimini de içerir (Gomberg-Bachmann-Hey reaksiyonu), %55 2-fenil-, %30 3-fenil- ve %15 4-fenil-piridin içeren bir karışımla sonuçlanır.
P.'deki nükleofilik sübstitüsyon 2 ve 4 pozisyonlarında ilerler ve benzenden daha kolaydır, örneğin P.'nin sodyum amid ile etkileşimi sırasında 2-aminopiridin sentezi (bkz. Chichibabina reaksiyonu
).
P., kural olarak oksitleyici maddelere karşı dirençlidir, ancak perasitlerin etkisi altında kolayca piridin N-oksit oluşturur (bkz. Amin N-oksitler)
Krom'da, C-2 ve C-4 atomlarındaki elektron yoğunluğu P'ye kıyasla artar. 300 0 C'de, FeCl3'ün etkisi altında P., toplam f-ly'nin izomerik dipiridillerinin bir karışımı halinde oksitlenir. C 5 H 4 N-C 5 H 4 N. Katalitik Pt veya Ni varlığında hidrojenasyon, alkolde Na'nın indirgenmesi ve ayrıca elektrokimyasal. geri kazanım piperidine yol açar (ikinci yöntem endüstride kullanılır). P.'nin daha sert restorasyonunu, döngünün bölünmesi ve deaminasyon takip eder.
P.'ye karbenlerin eklenmesi veya N-alkilpiridinyum iyonlarının deprotonasyonu, genel f-ly I'in piridinyum ilidlerine yol açar, P.'nin nitrenler ile etkileşimi veya N-aminopiridinyum tuzlarının deprotonasyonu, genel f-ly'nin piridinyum iminlerine yol açar II.

İletişim her iki tip de 1,3-dipolar sistemlerin özelliği olan p-tiyon siklokatılımına kolayca girer. P. esas olarak Kam.-ug'dan tahsis edilir. reçine (içerik yaklaşık %0,08), odun, turba veya kemiğin kuru damıtma ürünleri. Sentetik olarak yapabilir. iz alındı. reaksiyonlar:

P. ve türevleri-baz piridin alkaloidleri ,
ve diğerleri. şifalı Wed-in. P. ayrıca boyaların, böcek ilaçlarının sentezinde kullanılır ve alkolü denatüre etmek için kullanılır. P.'nin S03-piridinsülfotrioksit ile kompleksi hafif bir sülfürizasyon maddesidir; C5H5NBr2HBr-brominasyon maddesi; Epoksitlerin dehidrasyonu ve N-dealkilasyonu için C5H5N HCl reaktifi, C5H5NH2Cr207-oksitleyici ajan. P. iyi bir çözücüdür. birçok inorg. tuzlar (AgBr, Hg2Cl2, vb.). Havadaki MPC buharı P. ~0,005 mg/l, yani yanıcıdır. 23.3 0 C.
P. ilk kez 1849'da T. Andersen tarafından kemik yağından izole edildi; P.'nin yapısı 1869'da J. Dewar ve P. Kerner tarafından kuruldu.
P.'nin türevleri için bkz.
Döngülerin yalnızca karbon atomları tarafından değil aynı zamanda diğer elementlerin atomları (heteroatomlar (O, S, N)) tarafından da oluşturulduğu siklik bileşiklere heterosiklik denir. Heterosiklik bileşikler halkanın büyüklüğüne ve halkadaki heteroatom sayısına göre bölünür.
Bu bileşikler arasında beş ve altı üyeli heterosiklik bileşikler en büyük öneme sahiptir. Tipik heterosiklik bileşikler aromatiktir. Ancak bir heteroatomun varlığı elektron yoğunluğu dağılımını etkiler. Örneğin, beş üyeli heterosikllerde (furan, tiyofen, pirolde), elektron yoğunluğu heteroatomdan halkaya doğru kayar ve a-pozisyonlarında maksimumdur. Bu nedenle a-pozisyonlarında elektrofilik ikame (SE) reaksiyonu en kolay şekilde meydana gelir.
Altı üyeli döngülerde (örneğin piridin), karbona çift bağla bağlanan heteroatom, döngünün p-elektron yoğunluğunu kendine çeker, böylece piridin molekülündeki elektron yoğunluğu a ve g konumlarında azalır. Bu, nükleofilik ikamede (SN) reaktanların bu konumlarına tercih edilen yönelim ile tutarlıdır. Piridin'de elektron yoğunluğu b - pozisyonunda daha büyük olduğundan, elektrofilik reaktif b - pozisyonuna yönlendirilir.
İki heteroatomlu heterosiklleri incelerken pirimidin ve türevlerine özellikle dikkat edin: urasil, timin, sitozin. Pirimidin çekirdeği çok sayıda doğal üründe bulunur: vitaminler, koenzimler ve nükleik asitler:
Pirimidinin elektrofilik ikamesi 5 pozisyonunda gerçekleşir; nükleofilik (piridin için olduğu gibi) zordur ve 4 ve 6 pozisyonlarındaki karbon atomuna saldırır.
İki kaynaşmış heterosiklden (pirimidin ve imidazol) oluşan karmaşık bir heterosiklik sisteme pürin çekirdeği denir.
Pürin grubu, purin bazları formunda dahil edildiği başta nükleik asitler olmak üzere birçok bileşiğin temelini oluşturur: adenin (6-aminopurin) ve guanin (2-amino-6-oksipurin).
Pürin - ürik asidin (2,6,8 - trioksipurin) oksijen türevi ilgi çekicidir.
Laboratuvar #8
Çalışmanın amacı: heterosiklik bileşiklerin kimyasal özelliklerinin incelenmesi
Reaktifler ve ekipmanlar:
1) Antipirin,
2) FeCl3 - 0.1n,
3) amidopirin,
4) H2S04 - 2n,
5) NaNO 2 - 0,5n,
6) piridin, NaOH - 2n,
7) ürik asit, HCl - 2n,
8) NH4Cl doymuş çözeltisi,
9) pikrik asit doymuş. çözüm,
10) turnusol kağıdı,
11) bromtimol mavisi,
12) mikroskop,
13) test tüpleri.
8.1 deneyimini yaşayın Antipirin ve amidopirinin (piramidon) reaksiyonları
Demir(III) klorür ile
Bir test tüpüne birkaç antipirin kristali yerleştirin, iki damla su ve bir damla 0,1 N ekleyin. FeCl3. Yoğun ve kalıcı bir turuncu-kırmızı renk hemen gelişir ve ayakta durduğunda kaybolmaz. Karşılaştırma için başka bir test tüpüne birkaç amidopirin (piramidon) kristali yerleştirin. İki damla su ve bir damla 0,1 N ekleyin. FeCl3. Mor bir renk belirir ve hızla kaybolur. Aynı anda üç damla daha demir (III) klorür ekleyin. Renk yeniden ortaya çıkacak, biraz daha uzun süre dayanacak, ancak yavaş yavaş kaybolacaktır. Antipirinin demir (III) klorürden boyanması, karmaşık bir bileşik olan ferropirinin oluşumundan kaynaklanmaktadır.

Amidopirin antipirinin bir türevidir. Bu durumda 4. pozisyondaki hareketli hidrojen atomunun yerini bir dimetilamino grubu alır.
Rengin ortaya çıkışı amidopirinin demir (III) klorür ile oksidasyonundan kaynaklanmaktadır. Bu nedenle renk kararsızdır ve fazla demir (III) klorür reaksiyona zarar verir.
Bu reaksiyonlar farmasötik uygulamada antipirin ve amidopirini tanımak ve birbirlerinden ayırmak için kullanılır. Bunu göz önünde bulundurarak, bu reaksiyonların karşılaştırma amacıyla iki test tüpünde paralel olarak yapılması gerekir.
8.2 deneyimini yaşayın Antipirin ve amidopirinin nitröz asitle reaksiyonları
Bir test tüpüne birkaç antipirin kristali yerleştirin, iki damla su, bir damla 2n ekleyin. H 2 SO 4 ve bir damla 0,5n. NaNO2. Zümrüt yeşili bir renk ortaya çıkacak ve özellikle göreceli olarak fazla miktarda sodyum nitrit olduğunda, yavaş yavaş kaybolacaktır. Karşılaştırma için, başka bir test tüpüne birkaç amidopirin kristali yerleştirin, iki damla su, bir damla 2n ekleyin. H 2 SO 4 ve bir damla 0,5n. NaNO2. Çok kararsız bir mor renk ortaya çıkıyor. Renk çok çabuk kaybolursa biraz daha amidopirin ekleyin. Antipirin ile reaksiyon aşağıdaki denkleme göre ilerler:

Amidopirin ile renkli oksidasyon ürünleri oluşur.
Yukarıdaki demir (III) klorür reaksiyonları gibi, her iki reaksiyon da farmasötik uygulamada antipirin ve amidopirini tanımak ve bunları birbirlerinden ayırmak için kullanılır. Bu nedenle iki test tüpünde paralel olarak yapılmalıdır.
Deneyim 8.3 Sulu bir çözelti ile demir (III) hidroksitin çökeltilmesi
Piridin
Bir test tüpüne iki damla sulu piridin çözeltisi koyun ve bir damla 0,1 N FeCl3 ekleyin. Kahverengi demir hidroksit Fe(OH)3 pulları hemen çökerek suda kolayca çözünen piridin hidroklorür tuzunu (piridin hidroklorür) oluşturur.
Demir (III) hidroksitin oluşumu piridinin temel özelliklerini doğrular.
Piridin oksit hidratın demir (III) klorür ile etkileşimi sırasında piridin hidroklorürün (piridinyum klorür) oluşumu için bir şema yazın.
8.4 deneyimini yaşayın Piridin pikrin oluşumu
Bir pipet kullanarak, bir test tüpüne bir damla sulu piridin çözeltisi koyun ve üç damla doymuş sulu pikrik asit çözeltisi ekleyin. Çalkalandığında, iyi tanımlanmış iğne benzeri piridin pikrat kristalleri yavaş yavaş göze çarpıyor. Piridin fazlalığında kristaller çözülür.
Kristallerin bir kısmını bir cam slayt üzerine yerleştirin, bunları mikroskop altında inceleyin ve elde edilen preparatın kristallerinin şeklini çalışma günlüğüne çizin.
Nispeten az çözünür bir piridin pikratın oluşumu aynı zamanda piridinin temel karakterini de doğrular. Bu reaksiyon piridini tanımlamak için kullanılır (piridin pikrat 167 0 C'de erir).
Piridin pikratın oluşum şemasını yazınız.
Deneyim 8.5Ürik asitin çözünürlüğü ve sudaki ortalama sodyum tuzu
Bir test tüpüne az miktarda (bir spatulanın ucuna) ürik asit koyun. Her seferinde tüpü çalkalayarak damla damla su ekleyin.
Ürik asidin sudaki zayıf çözünürlüğüne dikkat edin. Soğuk suda ürik asit neredeyse çözünmez: 1 kısmı 39.000 kısım suda çözünür.
8 damla su ilave edildikten sonra çözünme hala fark edilmemektedir. Ancak 2n'den yalnızca 1 damla eklemeye değer. Bulanık bir çözelti olan NaOH, nispeten kolay çözünebilen bir ortamda disübstitüe edilmiş sodyum tuzunun oluşması nedeniyle anında temizlenir. Ortaya çıkan çözümü sonraki deneyler için kaydedin.
Ürik asit iki tautomerik formda bulunur:

Laktim-enol formundan alkali ile ürik asit tuzları veya üratlar oluşur. Aslında bunlar tuz değil, enolattır.
Ürik asidin çok zayıf şekilde belirgin asidik yapısı, teorik olarak mümkün olan enol formunun üç hidrojen atomundan yalnızca ikisinin sodyum ile değiştirilebileceğini belirler. Ürik asitin trisübstitüe tuzları bilinmemektedir.
8.6 deneyimini yaşayın Az çözünen amonyum üratın oluşumu
Dört damla orta dereceli dibazik sodyum ürik asit tuzu çözeltisine (deney 8.5), iki damla doymuş amonyum klorür çözeltisi ekleyin. Hemen beyaz bir amonyum ürat çökeltisi çökeldi. Bu çökeltiyi, serbest ürik asidin izolasyonu üzerine yapılacak sonraki deney için saklayın (deney 8.7).
Her iki sodyum iyonunun da sodyum üratta amonyum iyonları ile değiştirildiğini dikkate alarak reaksiyon şemasını yazın.
Deneyim 8.7 Mineral asidin etkisi altında üratların ayrışması (kristalin ürik asidin izolasyonu)
Bir pipet kullanarak, amonyum ürat içeren bulanık bir çözeltiden bir damla cam slayta uygulayın (deney 8.6). Damlanın merkezine bir damla 2n ekleyin. HC1. Çökeltinin kısmi çözünmesi gözlenir.
Mikroskop altında bakıldığında, henüz ayrışmamış sarımsı amonyum ürat kümeleri ve bileme taşlarına benzeyen uzun prizmalar şeklinde yeni oluşan karakteristik ürik asit kristalleri görülebilir. Ortaya çıkan preparatın kristallerinin şeklini çalışma günlüğüne çizin.
Ürik asit kristallerinin vücutta birikmesi (idrar taşları, gut düğümleri vb.), çevrenin asitliğin artmasına karşı reaksiyonundaki bir değişikliğin etkisi altında meydana gelir.
Ürik asidi tuzundan ayırmak için bir şema yazınız.
Laboratuvar çalışması numarası 9.
Çaydan kafeinin ayrılması
Çalışmanın amacı: Heterosiklik bir bileşiğin (kafein) bazı kimyasal özelliklerini izole edin ve inceleyin
Reaktifler ve ekipmanlar:
1) siyah çay
2) magnezyum oksit tozu
4) porselen fincan
5) HNO3'ün konsantre çözeltisi
6) konsantre amonyak çözeltisi
9.1'i deneyimleyin.Kafeinin süblimleşmesi.
Havanda ezilmiş 1 çay kaşığı siyah çayı ve 2 gr magnezyum oksiti porselen veya metal bir krozeye koyun. Her iki maddeyi karıştırın ve potayı fayansın üzerine koyun. Isıtma orta düzeyde olmalıdır. Pota üzerine soğuk su dolu porselen bir kap yerleştirin. Magnezyum oksit varlığında kafein süblimleşir. Kafein, soğuk bir yüzeye ulaştığında renksiz kristaller halinde bardağın dibine çöker. Isıtma durdurulur, bardak dikkatlice potadan çıkarılır ve kristaller temiz bir şişeye kazınır.
9.2 deneyimini yaşayınKafeine niteliksel yanıt.
Porselen bir tabağa birkaç kristal kafein yerleştirilir ve bir damla konsantre nitrik asit eklenir. Plakayı üzerindeki karışım kuruyana kadar ısıtın. Aynı zamanda kafein oksitlenerek turuncu renkli amalik asit haline gelir. Üzerine on damla konsantre amonyak ekleyin, kırmızı bir tuz, mora dönüşerek renk oluşur. Bu tuza müreksit adı verilir ve reaksiyona da müreksit adı verilir.
Reaksiyon denklemini yazın.
Kontrol edilecek sorular
1. Hangi bileşiklere heterosiklik denir?
2. Heterosiklik bileşiklerin sınıflandırılması?
3. Heterosiklik bileşiklerin aromatikliği nedir?
4. Amino asitleri oluşturan heterosikllerin formüllerini yazınız.
5. Pürin ve pirimidinin biyolojik rolü.
Piridin bir nitrojen atomuna sahip altı üyeli aromatik heterosikl, keskin, hoş olmayan bir kokuya sahip renksiz sıvı; su ve organik solventlerle karışabilir.
Piridin zayıf bir bazdır, güçlü mineral asitlerle tuzlar verir, kolayca çift tuzlar ve karmaşık bileşikler oluşturur.
Piridin molekülünün elektronik yapısı benzeninkine benzer. Karbon ve nitrojen atomları sp2 hibridizasyonu durumundadır. Tüm C–C, C–H ve C–N σ bağları hibrit yörüngelerden oluşur ve aralarındaki açı yaklaşık 120°'dir. Bu nedenle döngü düz bir yapıya sahiptir. Hibrit olmayan p-orbitallerinde bulunan altı elektron, bir π-elektron aromatik sistemi oluşturur.

Azot atomunun üç hibrit yörüngesinden ikisi C-N σ bağlarını oluşturur ve üçüncüsü, π elektron sistemine katılmayan yalnız bir elektron çifti içerir. Bu nedenle piridin, aminler gibi bazın özelliklerini gösterir. Sulu çözeltisi turnusol mavisine dönüşür. Piridin güçlü asitlerle reaksiyona girdiğinde piridinyum tuzları oluşur.

Pİridin, üçüncül aminlerin karakteristik özelliklerini sergiler: N-oksitler, N-alkilpiridinyum tuzları oluşturur ve bir sigma-verici ligandı olarak işlev görebilir.
Aynı zamanda piridin açık aromatik özelliklere sahiptir. Bununla birlikte, konjugasyon halkasında bir nitrojen atomunun varlığı, elektron yoğunluğunun ciddi bir şekilde yeniden dağılımına yol açar, bu da elektrofilik aromatik ikame reaksiyonlarında piridin aktivitesinde güçlü bir azalmaya yol açar. Bu tür reaksiyonlarda ağırlıklı olarak halkanın meta pozisyonları reaksiyona girer.
Piridin ve benzen arasındaki temel fark, nitrojenin karbona kıyasla daha yüksek elektronegatifliği nedeniyle, piridin durumunda, p-elektron yoğunluğunun dağılımını tanımlayan sınırlayıcı yapılar kümesinde, ayrılmış negatif ve negatif olan yapıların katkısıdır. pozitif yükler önemlidir:

Negatif yükün nitrojen atomunda lokalize olduğu ve pozitif yükün esas olarak 2,4 ve 6 pozisyonlarındaki (a- ve g-pozisyonları) karbon atomları arasında dağıtıldığı, onların değerlendirmesinden görülebilir. Bu bağlamda piridin, yukarıda ele alınan furan, pirol ve tiyofenin aksine, elektron eksikliği olan bir aromatik heterosikl olarak sınıflandırılır. Bu, aromatik bir sistem olarak piridin çekirdeğinin elektrofilik sisteme göre devre dışı bırakıldığı ve benzene kıyasla nükleofilik saldırıya göre aktive edildiği anlamına gelir.
Bununla birlikte, nitrojen atomunun yalnız bir elektron çiftine ve aşırı p-elektron yoğunluğuna sahip olması, özellikle bir s-bağının oluşumu aromatik sistemi etkilemediğinden, onu bir elektrofil tarafından çok aktif bir saldırı merkezi haline getirir. Dolayısıyla piridin aktif bir N-nükleofildir ve bu özelliği her zaman başlangıçta bir elektrofilik saldırı sırasında gerçekleştirilir.

Piridin - karbon atomlarına elektrofilik saldırı - ile C-nükleofilliğinin tezahürü ile ilişkili reaksiyonun diğer olası yönleri son derece zordur ve bunların uygulanması için çok ağır koşullar gereklidir. Yukarıda belirtilen p-elektron sisteminin elektron eksikliği doğasına ek olarak, aromatik çekirdekteki elektrofilik ikame modellerinin niteliksel açıklamasına yönelik genel yaklaşım çerçevesinde, bu durum, p-elektron sisteminin varlığıyla ilgili olmalıdır. Halkadaki karbon atomundan daha elektronegatif olan nitrojen, orta derecede oluşan katyonik s-kompleksini dengesizleştirir.
Böylece piridin, oldukça aktif bir n-nükleofilin ve büyük ölçüde devre dışı bırakılmış bir p-nükleofilin özelliklerini birleştirir. Aşağıdaki örneklerden de görüleceği gibi, nitrojen atomuna elektrofilik saldırı sonucu kolaylıkla oluşan bir ürün çoğunlukla kararsızdır ve oluşumu, kinetik olarak tercih edilse de, tersine çevrilebilir bir süreçtir. Bunun tersine, karbon atomlarına elektrofilik saldırı çok daha zordur ancak termodinamik olarak tercih edilen daha kararlı ikame ürünlerinin oluşumuna yol açar. Sonuç olarak, piridin türevlerinin birçok reaksiyonu kinetik, yani heteroatom veya termodinamik, yani halkanın karbon atomları, kontrol koşulları altında gerçekleştirilebilir, bu da onları oksiarenlerin ve aromatik aminlerin benzer reaksiyonlarıyla ilişkili kılar.
Daha önce belirtildiği gibi piridin bir bazdır ve stabil piridinyum tuzları oluşturmak üzere protonlanır. Benzer şekilde piridinin alkil halojenürlerle N-alkilasyonu meydana gelir ve alkilpiridinyum tuzlarına yol açar. Piridin N-oksit oluşumu ile perasitlerle oksidasyon, nitrojen atomunun yalnız elektron çifti üzerindeki elektrofillerle benzer reaksiyonlara da atfedilebilir.

Benzer şekilde piridin, N-bromopiridinyum tuzu - piridinyum bromür perbromür oluşturmak için brom ile etkileşime girer ve piridin sülfotrioksit oluşturmak için soğuduktan sonra oleum ile etkileşime girer.

Karboksilik asit klorürlerin piridin ile reaksiyonları benzer şekilde ilerler. Bununla birlikte, ortaya çıkan N-asilpiridinyum tuzu o kadar aktif bir elektrofiliktir ki bu durumda bir açilleyici reaktiftir ve serbest halde izole edilemez.

Piridin, ağırlıklı olarak halkanın orto-para pozisyonlarında meydana gelen aromatik nükleofilik ikame reaksiyonları ile karakterize edilir. Bu reaktivite, piridin halkasının elektron eksikliği olan yapısının bir göstergesidir ve bu, aşağıdaki genel kuralla özetlenebilir: aromatik bir bileşik olarak piridinin reaktivitesi, kabaca nitrobenzenin reaktivitesine karşılık gelir.
Piridin aromatik bir bileşiğin özelliklerini gösterir, ancak benzenden farklı olarak elektrofilik ikame reaksiyonlarına pek girmez - ağırlıklı olarak b türevlerinin oluşumuyla yalnızca yaklaşık 300 ° C'de nitratlanır, sülfonlanır ve bromlanır. Nükleofilik ikame benzenden daha kolay gerçekleşir.
Yani NaNH2'li piridin, KOH - a-oksipiridin ile a-aminopiridin verir. Piridin, 120°C'de alkoldeki sodyum veya Ni üzerinden H2 ile piperidine indirgenir. Örneğin bir piridinyum tuzu üzerindeki bazların etkisi altında piridin halkası, glutakonik dialdehit HOCCH = CHCH2COH veya bunun türevlerini oluşturmak üzere kırılır.

İnorganik asitlerle stabil tuzlar, alkil halojenürlerle piridinyum tuzları ve metal halojenürler, SO2, SO3, Br2, H2O ile kompleks bileşikler oluşturur.
Elektrofilik yer değiştirme büyük zorluklarla ilerler (piridin, elektrofilik yer değiştirme yeteneği bakımından nitrobenzene yakındır) ve 3. pozisyona gider. Bu reaksiyonların çoğu, başlangıç bileşiğinin artık piridinin kendisi değil, onun olduğu asidik bir ortamda gerçekleşir. tuz.
Piridin, temel özelliklerinin yanı sıra aromatik bir bileşiğin özelliklerini de sergiler. Ancak elektrofilik ikame reaksiyonlarındaki aktivitesi benzenden daha düşüktür. Bunun nedeni, nitrojenin daha elektronegatif bir element olarak elektronları kendine doğru çekmesi ve özellikle 2, 4 ve 6 konumlarında (orto ve para konumları) halkadaki elektron bulutunun yoğunluğunu azaltmasıdır.
Bu nedenle, örneğin piridinin nitrasyon reaksiyonu zorlu koşullar altında (300 °C'de) ve düşük verimle gerçekleşir. Nitrojen atomunun, piridin içindeki elektrofilik ikame sırasında yeni bir ikame edicinin eklenmesi üzerindeki yönlendirici etkisi, nitrobenzendeki nitro grubunun etkisine benzer: reaksiyon, pozisyon 3'e ilerler.
Benzen gibi piridin de doymuş bir piperidin bileşiği oluşturmak için bir katalizör varlığında hidrojen ekleyebilir.

Piperidin, ikincil bir aminin (kuvvetli baz) özelliklerini gösterir.
Piridin, 300 0C sıcaklıkta dumanlı H2SO4 içerisinde yalnızca NaNO3 veya KNO3 etkisi altında nitratlanır ve küçük bir verimle 3-nitropiridin oluşturulur; 220-270°C'de Hg sülfat varlığında oleum ile piridin-3-sülfonik asit halinde sülfonatlandı.
Piridin 155°C'de cıva asetat ile muamele edildiğinde 3-piridilmerkürasetat oluşur; daha yüksek sıcaklıklarda di- ve çoklu ikame edilmiş türevler.
Br2'nin oleum içindeki 300°C'deki etkisi, 3-bromo- ve 3,5-dibromo-piridinlerin bir karışımına yol açar. Daha yüksek bir sıcaklıkta (yaklaşık 500°C) reaksiyon radikal bir mekanizma ile ilerler; reaksiyon ürünleri - 2-bromo- ve 2,6-dibromopiridinler.
Radikal reaksiyonlar aynı zamanda piridinin fenildiazonyum hidrat ile etkileşimini de içerir (Gomberg-Bachmann-Hey reaksiyonu), %55 2-fenil-, %30 3-fenil- ve %15 4-fenil-piridin içeren bir karışımla sonuçlanır.
Piridin içindeki nükleofilik sübstitüsyon 2 ve 4 pozisyonlarında ilerler ve benzenden daha kolaydır, örneğin piridinin sodyum amid ile reaksiyonu yoluyla 2-aminopiridin sentezi. (Chichibabina reaksiyonu).
Piridin, kural olarak oksitleyici maddelere karşı dirençlidir, ancak perasitlerin etkisi altında, C-2 ve C-4 atomlarındaki elektron yoğunluğunun piridin ile karşılaştırıldığında arttığı piridin N-oksiti kolayca oluşturur.
300 0C'de FeCl3'ün etkisi altında piridin, C5H4N-C5H4N genel formülüne sahip izomerik dipiridillerin bir karışımına oksitlenir.
Pt veya Ni varlığında katalitik hidrojenasyon, alkolde Na'nın indirgenmesi ve elektrokimyasal indirgeme piperidine yol açar (ikinci yöntem endüstride kullanılır). Piridin'in daha şiddetli indirgenmesine halka bölünmesi ve deaminasyon eşlik eder.
Piridin nitrasyonu, 370 °C'de potasyum nitrat ve sülfürik asidin etkisi altında meydana gelir ve b-nitropiridine yol açar. Piridin sülfatlaması, 220 °C'de cıva sülfat varlığında oleum ile gerçekleştirilir; brominasyon, 300 °C'de oleum içindeki bir brom çözeltisinin etkisiyle gerçekleştirilebilir. Bu şekilde halkaya ikinci bir ikame edicinin dahil edilmesi mümkün değildir. Piridin Friedel-Crafts reaksiyonlarına girmez.

Genel olarak piridin kimyasında ve elektrofilik ikame reaksiyonları yardımıyla işlevselleştirilmesiyle ilgili kısımda, N-oksite dönüşme olasılığı büyük önem taşımaktadır. Bu bileşiğin elektronik yapısını düşünün.

Bu rezonans yapılarının analizi, N-oksit grubunun, halkanın p-elektron sistemi ile ilişkili olarak hem bir donör (yapıların üst sırası) hem de bir elektron alıcısı olarak hareket edebileceği yönünde şaşırtıcı bir sonuca yol açmaktadır; a ve g pozisyonlarında hem elektrofilik ikame reaksiyonlarının oluşmasına hem de aynı pozisyonlara bir nükleofilin eklenmesine katkıda bulunabilir! Gerçekte ne gözlemleniyor?
Bu grubun gerçekte sergilediği elektronik etki, reaktifin doğasına bağlıdır. Piridin N-oksitin nitrasyonu, 90 ° C'de dumanlı nitrik asit ve sülfürik asit karışımının etkisi altında, piridinin kendisinden çok daha kolay ilerler ve % 90 verimle g-nitro türevine yol açar; N-oksit grubunun aktive edici etkisine uygun olarak. Bunun aksine, sülfonasyon reaksiyonu, piridin'inkine benzer koşullar altında meydana gelir ve bir b-sülfonik asitle sonuçlanır. Sülfonasyon reaksiyonunun bu yönü, SO3'ün N-oksit grubunun oksijen atomuna koordinasyonu ile açıklanır, bu da bu grubu bir alıcıya ve dolayısıyla bir meta-yönlendirici maddeye dönüştürür.
Piridin'in N-oksite dönüştürülmesi, onunla elektrofilik ikame reaksiyonlarının gerçekleştirilmesi ve ardından N-oksit oksijen atomunun indirgeyici şekilde uzaklaştırılması, doğrudan elde edilemeyen geniş bir yelpazedeki fonksiyonel olarak ikame edilmiş piridin türevlerinin sentezine genel bir yaklaşımdır. piridin'den. Böylece, g-nitropiridin'in N-oksitinin trifenilfosfin ile indirgenmesi, N-oksit oksijen atomunun çıkarılmasına yol açar, bu da 4-nitropiridin'in iyi bir verimle elde edilmesini mümkün kılar. G-nitropiridin'in N-oksiti, asetik asitteki demir ile indirgendiğinde, nitro grubu ve N-oksit grubu aynı anda indirgenerek 4-aminopiridin elde edilir. Daha önce belirtildiği gibi, N-oksit grubu aynı zamanda nükleofilik ikame reaksiyonlarının oluşmasını da kolaylaştırır. Dolayısıyla, g-nitropiridin'in N-oksiti, hidrojen klorür veya hidrojen bromür ile reaksiyona girdiğinde, g-halo-ikameli piridin'in N-oksidi oluşur (bu reaksiyon için bir mekanizma önerin), PCl3 ile sonraki reaksiyon, N-oksit grubu.

Piridin N-oksit organometalik bileşiklerle etkileşime girdiğinde bağlanma ağırlıklı olarak 2. pozisyonda meydana gelir, yani bu reaksiyonda N-oksit grubu aslında nükleofilik saldırıya göre bu pozisyonu aktive eder. Reaksiyon karışımının su ile işlenmesinden sonra yüksek verimle 2-sübstitüe piridin türevleri oluşur.

Piridin N-oksit, atmosferik oksijenin (oksitleyici madde) varlığında alkalilerle reaksiyona girdiğinde, a-hidroksipiridin oksit oluşur. İlginç bir şekilde bu bileşik, N-hidroksipiridon ile totomerik dengede bulunur.
Alkil piridinyum tuzları nükleofilik reaktiflerle daha da kolay etkileşime girer.

Piridinyum tuzlarının nükleofilik reaktiflerle etkileşimi de halka açılmasına yol açabilir. Böylece metilpiridinyum iyodürün anilin ile reaksiyonu asiklik konjuge heterotrien sistemine yol açar. Bu reaksiyonun hazırlayıcı bir değeri vardır.
Piridin kendisi de nükleofilik katılma reaksiyonlarına girme yeteneğine sahiptir, ancak elbette daha katı koşullar altında. Bu dönüşümlerden Chichibabin reaksiyonu, yani 130°C'de sodyum amid ile reaksiyon, en büyük hazırlayıcı öneme sahiptir. Bu reaksiyon katılma-bölünme mekanizmasıyla meydana gelir ve ürünü a-aminopiridindir. Piridin, potasyum amid ile reaksiyona girdiğinde a-aminopiridin ile birlikte g-aminopiridin de oluşur.

400°C'ye ısıtıldığında piridin, a-hidroksipiridin oluşturmak üzere KOH ile reaksiyona girer, fenillityum ile reaksiyon 110°C'de 8 saat boyunca meydana gelir ve suyla işlemden sonra a-fenilpiridine yol açar.

Piridin ve türevlerinin indirgenmesi, ya alkol içindeki metalik sodyumun etkisi altında ya da katalitik hidrojenasyon koşulları altında meydana gelir. Bu durumda piridin heksahidro türevleri oluşur ve piridin kendisi durumunda piperidin oluşur.
Diazotizasyon sırasında b-aminopiridin, nitrojen gelişimi olsun veya olmasın, bu sınıftaki bileşikler için olağan dönüşümlere girebilen oldukça stabil diazonyum tuzları oluşturur. Bunun aksine, a- ve g-aminopiridinler kolaylıkla diazonyum tuzları oluşturmazlar ve bu tuzların kendileri oldukça kararsızdır.
Hidroksipiridinler ve hidroksiarenlerin tautomerik okso formunda var olma yeteneği arasında bir paralellik kurmak ilginçtir. Resmi olarak, piridin ve benzen türevlerinde böyle bir denge kurma işlemi aynı mekanizmaya göre ilerlemeli ve bir protonun bir hidroksi grubundan aromatik veya heteroaromatik bir halkaya aktarılmasından oluşmalıdır. Bu işlem senkronize değildir, iki aşamada ilerler, bunlardan ilki olan deprotonasyon, bir çözücünün veya başka bir aren molekülünün katılımıyla gerçekleşir ve doğal olarak daha kolay ilerler, asit hidroksil grubu ne kadar güçlüyse. Piridin çekirdeğinin elektron eksikliği olan doğası dikkate alındığında, hidroksipiridinlerin asitliğinin hidroksiarenlerin asitliğinden belirgin şekilde daha yüksek olduğu ve dolayısıyla piridin türevleri durumunda aktivasyon bariyerinin daha düşük olacağı iddia edilebilir. İkinci adım protonasyondur. Piridin halkasındaki nitrojen atomunun yalnız elektron çifti elektrofilik saldırı, özellikle protonasyon için uygun olduğundan ve nitrojen atomunun kendisinde kısmi bir negatif yük bulunduğundan (bkz. sayfa 43), şu varsayılabilir: piridin türevleri durumunda da bu aşamanın daha kolay gerçekleştirilmesi gerekmektedir. Piridin halkasındaki hidroksi grubunun konumuna bağlı olarak bu dönüşümlerin neye yol açacağını düşünelim.




Sunulan şemadan görülebileceği gibi, a- ve g-hidroksipiridinler durumunda, protonasyon-deprotonasyon aşamalarının sırası, hidroksi grubunun b-pozisyonuyla keto formuna yol açar, böyle bir dönüşüm imkansızdır - zwitterion oluşumuyla sonuçlanır. Aslında b-hidroksipiridin, anormal derecede yüksek erime noktası ve organik çözücülerdeki düşük çözünürlüğü ile kanıtlandığı gibi bu formda mevcuttur. Elbette hem hidroksiarenlerde hem de hidroksipiridinlerde söz konusu dönüşüm molekülün aromatiklik kaybına yol açar, ancak yukarıda belirtilen nedenlerden dolayı bu totomerik denge piridin türevlerinin çok daha karakteristik özelliğidir.
Protonasyonu kolaylaştıran aromatik halkaya ek donör grupları eklendiğinde, hidroksiarenlerde keto-enol totomerik dengenin de gerçekleştiğine dikkat edilmelidir. Yani, phleroglucinol - 1,3,5-trihidroksibenzen - esas olarak keto formunda bulunur.

Piridin, alifatik aminlere göre daha zayıf bir bazdır (Kb = 1.7.10-9). Sulu çözeltisi turnusol mavisine dönüşür:

Piridin güçlü asitlerle reaksiyona girdiğinde piridinyum tuzları oluşur:

aromatik özellikler. Benzen gibi piridin de elektrofilik ikame reaksiyonlarına girer, ancak nitrojen atomunun yüksek elektronegatifliği nedeniyle bu reaksiyonlardaki aktivitesi benzeninkinden daha düşüktür. Piridin 300°C'de düşük verimle nitratlanır:
Elektrofilik sübstitüsyon reaksiyonlarında nitrojen atomu 2. türden bir sübstitüent gibi davranır, bu nedenle meta konumunda elektrofilik sübstitüsyon meydana gelir.
Benzenin aksine piridin, nitrojen atomu aromatik sistemden elektron yoğunluğunu çektiğinden ve nitrojen atomuna göre orto-para pozisyonları elektron bakımından tükendiğinden nükleofilik ikame reaksiyonlarına girebilir. Dolayısıyla piridin, sodyum amid ile reaksiyona girerek orto ve para-aminopiridinlerin bir karışımını oluşturabilir (Chichibabin reaksiyonu):

Piridin hidrojenasyonu, siklik bir ikincil amin olan ve piridinden çok daha güçlü bir baz olan piperidin üretir:

Piridin homologları özellik bakımından benzen homologlarına benzer. Böylece yan zincirlerin oksidasyonu sırasında karşılık gelen karboksilik asitler oluşur:

Ders No. 9
Yapı ve biyolojik etki arasındaki ilişki
Piridin: Oldukça toksik bir madde. Yalnız bir elektron çifti, üçüncül bir nitrojen atomu vardır, güçlü temel özelliklere sahiptir
Dihidropiridin: koroner dilatör
Piridin-3-karboksilik asit: anti-pellajik ajan
Piridin-4-karboksilik asit: anti-tüberküloz aktiviteye sahiptir
piridin metanol türevleri B6 vitamini aktivitesine sahiptir.
Piridin metanolün tıbbi maddeler türevleri
Piridoksin Hidroklorür
Metil 3-hidroksi-4,5 dioksimetil-piridin hidroklorür
B6 Vitamini, acı-ekşi tada sahip, beyaz, kokusuz, ince kristalli bir tozdur. T pl. - 204 - 206 ° С (ayrışma ile). Suda kolayca çözülelim, zor - alkol ve asetonda.
piridoksalfosfat
2-metil-3-hidroksi 4-formil 5-hidroksimetil piridin'in fosforik esteri.
Fiziksel Özellikleri: Açık sarı kristal toz. Suda az çözünür, ışıkta kararsızdır.
Emoksipin
Etil 3-hidroksi-6-metil-piridin hidroklorür
Fiziksel özellikler: beyaz ince kristal toz, kokusuz. Suda kolayca çözünür.
Orijinallik:
Genel reaksiyonlar
2,6 - diklorokinon klorimid ile reaksiyona girerek mavi bir indofenol boyası oluşur
3. Azo boya oluşum reaksiyonu (tüm preparasyonlar). Fenolik hidroksile reaksiyon.
4. Fenolik hidroksil için FeCl3 ile reaksiyon
Genel alkaloid reaktiflerle reaksiyon (silikotungstik ve fosfotungstik asitler beyaz çökeltiler oluşturur).
Farklılaşma reaksiyonları
1. Piridoksin hidroklorür ve Emoksipin, Cl -'ye reaksiyon verir.
HCl + AgNO 3 AgCl + HNO 3
2. Piridoksal fosfat, bulunan bir aldehit grubu içerir:
Felling reaktifi 1 ve 2 ile A reaksiyonu
B- gümüş nitratın amonyak çözeltisi ile reaksiyonu
Hidrolizden sonra piridoksal fosfat, fosforik asitle reaksiyona girer. Sarı bir gümüş fosfat çökeltisi oluşur.
H3RO4 + 3AgNO3 Ag3PO4 + 3HPO4
Piridoksin hidroklorür, UV ışığı altında mavi floresans gösterir.
5. Spektrofotometrik yöntem (tüm hazırlıklar için). Test maddesinin UV spektrumunu kaydedin Standart maddenin UV spektrumunu kaydedin. Aynı olmaları gerekir.
kantitatif
Piridoksin hidroklorür ve emoksipin için
Sulu olmayan titrasyon yöntemi
Yöntem: doğrudan titrasyon
Yöntem, sulu olmayan bir ortamda asit-baz etkileşiminin reaksiyonuna dayanmaktadır.
Ortam: buzlu asetik asit, titrasyon sırasında açığa çıkan hidroklorik asidi bağlamak için Hg (CH3COO) 2 ekleyin
Kimya
R3N HCl + HClO 4 R3NHClO4 + HCl
HCl + Hg (CH3COO) 2 → HgCl2 +CH3COOH
Piridoksal fosfat
Standart bir çözüm aracılığıyla UV bölgesinde spektrofotometrik.
Yöntem Alkalimetrik
Fosforik asit kalıntısı üzerinde doğrudan titrasyon yöntemi. Yöntem asit-baz etkileşiminin reaksiyonuna dayanmaktadır.
Arjantometri
Merkür ve merkürimeria
Başvuru
Piridoksin 0,02 ve 0,1 g
Hamile kadınlarda toksikoz, çeşitli parkinsonizm türleri, pellagra ve kronik hepatit için piridoksal fosfat 0.01-0.02 g
Emoksipin bir antioksidandır, anjiyoprotektif aktiviteye sahiptir.
Ampullerde% 3'lük 5 ml'lik çözelti şeklinde üretilir.
Pirikarbat (Prodektin) 2,6-piridin dimetanollabismetil karbamat
Fiziksel Özellikleri: Kokusuz beyaz kristal toz. Suda zayıf çözünür.
T erime \u003d 137 - 140 ° C
Özgünlük
1. Sitrik asit varlığında asetik anhidrin ile ısıtılmadığında → sarı renk kiraz kırmızısına döner.
Piridin halkasına 2,4-dinitroklorobenzen ile reaksiyon. Bir piridin boyası oluşur.
Alkali hidrolizi gerçekleştirin. Metilamin salınır. Kırmızı turnusol kağıdı maviye döner.
| parmidin |
UV ve IR Spektroskopi Yöntemleri
A. UV spektroskopi yöntemi.
Test maddesinin UV spektrumunu kaydedin.
Standart maddenin UV spektrumunu çıkarın. Aynı olmaları gerekir.
UV spektroskopisinde elektromanyetik radyasyon tüm molekülün elektronları tarafından emilir ve spektrogramda maksimum bir ışık emilimi gözlemleriz.
λ, nm
B. IR spektroskopisi yöntemi.
kantitatif
Sulu olmayan titrasyon yöntemi
Yöntem: doğrudan titrasyon
Dihidropiridin türevleri
Nifedipin (Corinfar)
2,6-dimetil-4-(2/-nitrofenil)-1,4-dihidro-piridin-3,5-dikarboksilik asit dimetil ester
Fiziksel Özellikleri: Yeşilimsi sarı kristal toz. Suda pratik olarak çözünmez, alkolde zordur. Dünyada ayrışır. T erime \u003d 169-174 yaklaşık C.
Özgünlük
UV spektroskopi yöntemi
IR spektroskopi yöntemi
kantitatif
Kromatogramları alın.
H, mm h, mm
t,dakika t,dakika
Özgünlük
kantitatif
Özgünlük
UV ve IR spektroskopisi
2. alifatik NH2 - grubunun ninhidrin ile reaksiyonu. Mavi-mor bir renk oluşur.
kantitatif
Ders No. 9
Piridin tıbbi maddeler türevleri