parçalayıcı enzimler. İnsan vücudundaki enzimler: Bunu herkesin bilmesi gerekiyor! Sorunun durumu ve sorunun aciliyeti
Herhangi bir canlı organizmanın hücresinde milyonlarca kimyasal reaksiyon meydana gelir. Bunların her biri büyük önem taşıyor, bu nedenle biyolojik süreçlerin hızının yüksek seviyede tutulması önemlidir. Hemen hemen her reaksiyon kendi enzimi tarafından katalize edilir. Enzimler nelerdir? Hücredeki görevleri nelerdir?
Enzimler. Tanım
"Enzim" terimi Latince fermentum - mayadan gelir. Bunlara ayrıca Yunanca "mayadaki" enzimden gelen enzimler de denilebilir.
Enzimler biyolojik olarak aktif maddelerdir, dolayısıyla hücrede meydana gelen herhangi bir reaksiyon onların katılımı olmadan gerçekleşemez. Bu maddeler katalizör görevi görür. Buna göre herhangi bir enzimin iki temel özelliği vardır:
1) Enzim biyokimyasal reaksiyonu hızlandırır ancak tüketilmez.
2) Denge sabitinin değeri değişmez, sadece bu değere ulaşılmasını hızlandırır.
Enzimler biyokimyasal reaksiyonları bin, bazı durumlarda ise milyonlarca kat hızlandırır. Bu, bir enzimatik aparatın yokluğunda, tüm hücre içi süreçlerin pratik olarak duracağı ve hücrenin kendisinin öleceği anlamına gelir. Bu nedenle enzimlerin biyolojik olarak aktif maddeler olarak rolü büyüktür.
Çeşitli enzimler hücre metabolizmasının düzenlenmesini çeşitlendirmenize olanak sağlar. Herhangi bir reaksiyon kademesinde, çeşitli sınıflardan birçok enzim yer alır. Biyolojik katalizörler, molekülün spesifik yapısı nedeniyle oldukça seçicidir. Çoğu durumda enzimler protein yapısında olduğundan üçüncül veya dördüncül bir yapıdadırlar. Bu yine molekülün özgüllüğü ile açıklanmaktadır.
Enzimlerin hücredeki görevleri
Enzimin asıl görevi karşılık gelen reaksiyonu hızlandırmaktır. Hidrojen peroksitin ayrışmasından glikolize kadar her türlü süreç biyolojik bir katalizörün varlığını gerektirir.
Enzimlerin doğru işleyişi, belirli bir substrat için yüksek spesifiklik ile sağlanır. Bu, bir katalizörün yalnızca belirli bir reaksiyonu hızlandırabileceği, çok benzer bir reaksiyonu bile hızlandırabileceği anlamına gelir. Spesifiklik derecesine göre, aşağıdaki enzim grupları ayırt edilir:
1) Yalnızca tek bir reaksiyonun katalize edildiği mutlak spesifikliğe sahip enzimler. Örneğin kollajenaz kollajeni, maltaz ise maltozu parçalar.
2) Göreceli özgüllüğe sahip enzimler. Bu, hidrolitik bölünme gibi belirli bir reaksiyon sınıfını katalize edebilen maddeleri içerir.
Bir biyokatalizörün çalışması, aktif bölgesinin substrata bağlandığı andan itibaren başlar. Bu durumda kilit ve anahtar gibi tamamlayıcı bir etkileşimden bahsedilmektedir. Burada aktif merkezin şeklinin alt tabaka ile tamamen örtüşmesini kastediyoruz, bu da reaksiyonu hızlandırmayı mümkün kılıyor.
Bir sonraki adım reaksiyonun kendisidir. Enzimatik kompleksin etkisi nedeniyle hızı artar. Sonunda reaksiyonun ürünleriyle ilişkili bir enzim elde ederiz.
Son aşama, reaksiyon ürünlerinin enzimden ayrılmasıdır, bundan sonra aktif merkez bir sonraki iş için tekrar serbest hale gelir.
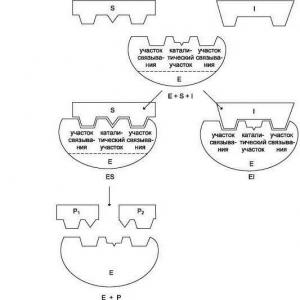
Şematik olarak enzimin her aşamadaki çalışması şu şekilde yazılabilir:
1) S + E ——> SE
2) SE ——> SP
3) SP ——> S + P, burada S substrattır, E enzimdir ve P üründür.

Enzim sınıflandırması
İnsan vücudunda çok sayıda enzim bulabilirsiniz. İşlevleri ve çalışmaları hakkındaki tüm bilgiler sistematik hale getirildi ve sonuç olarak, şu veya bu katalizörün ne için tasarlandığını belirlemenin kolay olduğu tek bir sınıflandırma ortaya çıktı. Burada enzimlerin 6 ana sınıfı ve bazı alt grupların örnekleri verilmiştir.
- Oksidoredüktazlar.
Bu sınıfın enzimleri redoks reaksiyonlarını katalize eder. Toplamda 17 alt grup bulunmaktadır. Oksidoredüktazlar genellikle bir vitamin veya hem ile temsil edilen protein olmayan bir kısma sahiptir.
Oksidoredüktazlar arasında aşağıdaki alt gruplar sıklıkla bulunur:
a) Dehidrojenazlar. Dehidrojenaz enzimlerinin biyokimyası, hidrojen atomlarının ortadan kaldırılması ve bunların başka bir substrata aktarılmasından oluşur. Bu alt grup çoğunlukla solunum, fotosentez reaksiyonlarında bulunur. Dehidrojenazların bileşimi mutlaka NAD / NADP veya flavoproteinler FAD / FMN formunda bir koenzim içerir. Çoğunlukla metal iyonları vardır. Örnekler arasında sitokrom redüktaz, piruvat dehidrojenaz, izositrat dehidrojenaz gibi enzimler ve birçok karaciğer enzimi (laktat dehidrojenaz, glutamat dehidrojenaz, vb.) yer alır.
b) Oksidazlar. Bir dizi enzim, oksijenin hidrojene eklenmesini katalize eder, bunun sonucunda reaksiyon ürünleri su veya hidrojen peroksit (H20, H202) olabilir. Enzim örnekleri: sitokrom oksidaz, tirozinaz.
c) Peroksidazlar ve katalazlar H2O2'nin oksijen ve suya parçalanmasını katalize eden enzimlerdir.
d) oksijenazlar. Bu biyokatalizörler substrata oksijen eklenmesini hızlandırır. Dopamin hidroksilaz bu tür enzimlerin bir örneğidir.
2. Transferazlar.
Bu gruptaki enzimlerin görevi radikalleri verici maddeden alıcı maddeye aktarmaktır.
a) metiltransferaz. Nükleotid replikasyon sürecini kontrol eden ana enzimler olan DNA metiltransferazlar, nükleik asidin düzenlenmesinde önemli bir rol oynar.
b) Asiltransferazlar. Bu alt grubun enzimleri asil grubunu bir molekülden diğerine taşır. Asiltransferaz örnekleri: lesitinkolesterol asiltransferaz (işlevsel bir grubu bir yağ asidinden kolesterole aktarır), lisofosfatidilkolin asiltransferaz (bir asil grubu lisofosfatidilkolin'e aktarılır).
c) Aminotransferazlar - amino asitlerin dönüşümünde rol oynayan enzimler. Enzim örnekleri: amino grubu transferi yoluyla piruvat ve glutamattan alanin sentezini katalize eden alanin aminotransferaz.
d) Fosfotransferazlar. Bu alt grubun enzimleri bir fosfat grubunun eklenmesini katalize eder. Fosfotransferazların başka bir adı olan kinazlar çok daha yaygındır. Örnekler, sırasıyla heksozlara (çoğunlukla glikoz) ve aspartik asite fosfor kalıntıları ekleyen heksokinazlar ve aspartat kinazlar gibi enzimlerdir.
3. Hidrolazlar - bir moleküldeki bağların parçalanmasını ve ardından su eklenmesini katalize eden bir enzim sınıfı. Bu gruba ait maddeler ana sindirim enzimleridir.
a) Esterazlar - eter bağlarını kırar. Bir örnek, yağları parçalayan lipazlardır.
b) Glikozidazlar. Bu serideki enzimlerin biyokimyası, polimerlerin (polisakaritler ve oligosakaritler) glikosidik bağlarının yok edilmesinden oluşur. Örnekler: amilaz, sükraz, maltaz.
c) Peptidazlar, proteinlerin amino asitlere parçalanmasını katalize eden enzimlerdir. Peptidazlar arasında pepsinler, trypsin, kimotripsin, karboksipeptidaz gibi enzimler bulunur.
d) Amidazlar - amid bağlarını ayırır. Örnekler: arginaz, üreaz, glutaminaz vb. Birçok amidaz enzimi,
4. Liyazlar - hidrolazlara benzer işlevlere sahip enzimler, ancak moleküllerdeki bağları ayırırken su tüketilmez. Bu sınıfın enzimleri her zaman, örneğin B1 veya B6 vitaminleri şeklinde protein olmayan bir kısım içerir.
a) Dekarboksilazlar. Bu enzimler C-C bağına etki eder. Örnekler glutamat dekarboksilaz veya piruvat dekarboksilazdır.
b) Hidratazlar ve dehidratazlar - C-O bağlarının bölünmesi reaksiyonunu katalize eden enzimler.
c) Amidin-liyazlar - C-N bağlarını yok eder. Örnek: arginin süksinat liyaz.
d) P-O liyaz. Bu tür enzimler, kural olarak, fosfat grubunu substrat maddesinden ayırır. Örnek: adenilat siklaz.

Enzimlerin biyokimyası yapılarına dayanmaktadır.
Her enzimin yetenekleri, kendine özgü, benzersiz yapısı tarafından belirlenir. Her enzim öncelikle bir proteindir ve yapısı ve katlanma derecesi, fonksiyonunun belirlenmesinde belirleyici rol oynar.
Her biyokatalizör, birkaç bağımsız işlevsel alana bölünmüş aktif bir merkezin varlığıyla karakterize edilir:
1) Katalitik merkez, enzimin substrata bağlandığı proteinin özel bir bölgesidir. Protein molekülünün yapısına bağlı olarak katalitik merkez, bir anahtara kilit gibi aynı şekilde substrata uyması gereken çeşitli formlar alabilir. Böylesine karmaşık bir yapı, neyin üçüncül veya dördüncül durumda olduğunu açıklar.
2) Adsorpsiyon merkezi - bir "tutucu" görevi görür. Burada öncelikle enzim molekülü ile substrat molekülü arasında bir bağlantı vardır. Ancak adsorpsiyon merkezinin oluşturduğu bağlar çok zayıftır, bu da bu aşamadaki katalitik reaksiyonun tersinir olduğu anlamına gelir.
3) Allosterik merkezler hem aktif merkezde hem de bir bütün olarak enzimin tüm yüzeyinde bulunabilir. Görevleri enzimin işleyişini düzenlemektir. Düzenleme, inhibitör moleküller ve aktivatör moleküllerin yardımıyla gerçekleşir.

Enzim molekülüne bağlanan aktivatör proteinler onun çalışmasını hızlandırır. İnhibitörler ise aksine, katalitik aktiviteyi inhibe eder ve bu iki şekilde meydana gelebilir: ya molekül, enzimin aktif bölgesi bölgesindeki allosterik bölgeye bağlanır (rekabetçi inhibisyon) ya da proteinin başka bir bölgesine bağlanır. (rekabetçi olmayan engelleme). daha verimli olduğu düşünülüyor. Sonuçta bu, substratın enzime bağlanma yerini kapatır ve bu işlem ancak inhibitör molekülünün şekli ile aktif merkezin şeklinin neredeyse tamamen çakışması durumunda mümkündür.
Bir enzim genellikle sadece amino asitlerden değil aynı zamanda diğer organik ve inorganik maddelerden de oluşur. Buna göre, apoenzim izole edilir - protein kısmı, koenzim - organik kısım ve kofaktör - inorganik kısım. Koenzim karbonhidratlar, yağlar, nükleik asitler, vitaminler ile temsil edilebilir. Buna karşılık, kofaktör çoğunlukla yardımcı metal iyonlarıdır. Enzimlerin aktivitesi yapısına göre belirlenir: Bileşimi oluşturan ilave maddeler katalitik özellikleri değiştirir. Çeşitli enzim türleri, listelenen tüm kompleks oluşum faktörlerinin bir kombinasyonunun sonucudur.

Enzim düzenlemesi
Biyolojik olarak aktif maddeler olarak enzimler vücut için her zaman gerekli değildir. Enzimlerin biyokimyası aşırı kataliz durumunda canlı hücreye zarar verebilecek özelliktedir. Enzimlerin vücut üzerindeki zararlı etkilerini önlemek için bir şekilde çalışmalarını düzenlemek gerekir.
Enzimler protein yapısında olduğundan yüksek sıcaklıklarda kolayca yok edilirler. Denatürasyon süreci tersine çevrilebilir, ancak maddelerin çalışmasını önemli ölçüde etkileyebilir.
pH aynı zamanda düzenlemede de büyük rol oynar. Enzimlerin en büyük aktivitesi kural olarak nötr pH değerlerinde (7.0-7.2) gözlenir. Yalnızca asidik ortamda veya yalnızca alkali ortamda çalışan enzimler de vardır. Böylece hücresel lizozomlarda, hidrolitik enzimlerin aktivitesinin maksimum olduğu düşük bir pH korunur. Ortamın zaten nötre yakın olduğu sitoplazmaya yanlışlıkla girerlerse aktiviteleri azalacaktır. "Kendi kendini yemeye" karşı bu tür bir koruma, hidrolazların çalışmasının özelliklerine dayanmaktadır.
Enzimlerin bileşiminde koenzim ve kofaktörün önemini belirtmekte fayda var. Vitaminlerin veya metal iyonlarının varlığı bazı spesifik enzimlerin işleyişini önemli ölçüde etkiler.

Enzim terminolojisi
Vücudun tüm enzimleri genellikle herhangi bir sınıfa ait olmalarına ve reaksiyona girdikleri substrata göre adlandırılır. Bazen isimde bir değil iki alt tabaka kullanılır.
Bazı enzimlerin adlarına örnekler:
- Karaciğer enzimleri: laktat dehidrojenaz, glutamat dehidrojenaz.
- Enzimin tam sistematik adı: laktat-NAD+-oksidoredükt-az.
Ayrıca isimlendirme kurallarına uymayan önemsiz isimler de vardır. Örnekler sindirim enzimleridir: trypsin, kimotripsin, pepsin.
Enzim Sentez Süreci
Enzimlerin fonksiyonları genetik düzeyde belirlenir. Bir molekül genel olarak bir protein olduğundan, sentezi transkripsiyon ve translasyon işlemlerini tam olarak tekrarlar.
Enzimlerin sentezi aşağıdaki şemaya göre gerçekleşir. Öncelikle DNA'dan istenen enzime ilişkin bilgi okunur ve bunun sonucunda mRNA oluşur. Messenger RNA, enzimi oluşturan tüm amino asitleri kodlar. Enzimlerin düzenlenmesi DNA düzeyinde de gerçekleşebilir: katalize edilen reaksiyonun ürünü yeterliyse gen transkripsiyonu durur ve bunun tersi de geçerlidir, bir ürüne ihtiyaç varsa transkripsiyon süreci etkinleştirilir.
MRNA hücrenin sitoplazmasına girdikten sonra bir sonraki aşama başlar - çeviri. Endoplazmik retikulumun ribozomlarında, peptit bağlarıyla bağlanan amino asitlerden oluşan bir birincil zincir sentezlenir. Ancak birincil yapıdaki protein molekülü henüz enzimatik fonksiyonlarını yerine getirememektedir.
Enzimlerin aktivitesi proteinin yapısına bağlıdır. Aynı ER'de, önce ikincil ve sonra üçüncül yapıların oluşması sonucunda protein bükülmesi meydana gelir. Bazı enzimlerin sentezi bu aşamada durur, ancak katalitik aktiviteyi aktive etmek için genellikle bir koenzim ve bir kofaktör eklemek gerekir.
Endoplazmik retikulumun belirli bölgelerine enzimin organik bileşenleri eklenir: monosakkaritler, nükleik asitler, yağlar, vitaminler. Bazı enzimler koenzim olmadan çalışamaz.
Kofaktör oluşumunda belirleyici rol oynar Enzimlerin bazı fonksiyonları ancak proteinin domain organizasyonuna ulaşmasıyla kullanılabilir. Bu nedenle, birkaç protein küreciği arasındaki bağlantı bağının bir metal iyonu olduğu dördüncül bir yapının varlığı onlar için çok önemlidir.

Çoklu enzim formları
Aynı reaksiyonu katalize eden ancak bazı parametrelerde birbirinden farklı olan birkaç enzime sahip olmanın gerekli olduğu durumlar vardır. Örneğin bir enzim 20 derecede çalışabilir ama 0 derecede artık fonksiyonlarını yerine getiremez. Düşük ortam sıcaklıklarında böyle bir durumda canlı bir organizma ne yapmalıdır?
Bu sorun, aynı reaksiyonu katalize eden ancak farklı koşullar altında çalışan birden fazla enzimin aynı anda bulunmasıyla kolayca çözülür. İki tür çoklu enzim formu vardır:
- İzoenzimler. Bu tür proteinler farklı genler tarafından kodlanır, farklı amino asitlerden oluşur ancak aynı reaksiyonu katalize eder.
- Gerçek çoğul formlar. Bu proteinler aynı genden kopyalanır, ancak peptitler ribozomlar üzerinde modifiye edilir. Sonuç olarak aynı enzimin çeşitli formları elde edilir.
Sonuç olarak çoklu formların birinci türü genetik düzeyde, ikinci türü ise translasyon sonrası düzeyde oluşur.
Enzimlerin önemi
Tıpta, maddelerin zaten doğru miktarlarda olduğu yeni ilaçların piyasaya sürülmesi söz konusudur. Bilim adamları vücutta eksik olan enzimlerin sentezini uyarmanın bir yolunu henüz bulamadılar, ancak günümüzde bunların eksikliğini geçici olarak telafi edebilecek ilaçlar yaygın olarak mevcuttur.
Hücredeki çeşitli enzimler çok çeşitli yaşamı sürdüren reaksiyonları katalize eder. Bu enizmlerden biri, nükleaz grubunun temsilcileridir: endonükleazlar ve eksonükleazlar. Görevleri, hücrede sabit bir nükleik asit seviyesini korumak ve hasarlı DNA ve RNA'yı ortadan kaldırmaktır.
Kanın pıhtılaşması gibi bir olguyu unutmayın. Etkili bir koruma önlemi olan bu süreç, birçok enzimin kontrolü altındadır. Bunlardan en önemlisi, aktif olmayan protein fibrinojeni aktif fibrine dönüştüren trombindir. İplikleri, damardaki hasar bölgesini tıkayan ve böylece aşırı kan kaybını önleyen bir tür ağ oluşturur.
Enzimler şarap yapımında, bira yapımında, birçok fermente süt ürününün elde edilmesinde kullanılır. Maya, glikozdan alkol üretmek için kullanılabilir, ancak onlardan elde edilen bir ekstrakt, bu sürecin başarılı bir şekilde ilerlemesi için yeterlidir.

Bilmediğiniz ilginç gerçekler
Vücudun tüm enzimleri büyük bir kütleye sahiptir - 5.000 ila 1.000.000 Da arasında. Bunun nedeni molekülde protein bulunmasıdır. Karşılaştırma için: glikozun moleküler ağırlığı 180 Da ve karbondioksit yalnızca 44 Da'dır.
Bugüne kadar çeşitli organizmaların hücrelerinde bulunan 2.000'den fazla enzim keşfedilmiştir. Ancak bu maddelerin çoğu henüz tam olarak anlaşılamamıştır.
Etkili çamaşır deterjanları üretmek için enzim aktivitesi kullanılır. Burada enzimler vücuttakiyle aynı görevi yerine getirir: Organik maddeleri parçalarlar ve bu özellik lekelerle mücadelede yardımcı olur. Benzer bir çamaşır tozunun 50 dereceyi aşmayan bir sıcaklıkta kullanılması tavsiye edilir, aksi takdirde denatürasyon işlemi meydana gelebilir.
İstatistiklere göre dünya çapında insanların %20'si bu enzimlerin eksikliğinden yakınıyor.
Enzimlerin özellikleri çok uzun zamandır biliniyordu, ancak yalnızca 1897'de insanlar, şekeri alkole fermente etmek için mayanın kendisinin değil, hücrelerinden elde edilen bir ekstraktın kullanılabileceğini fark etti.
Federal Eğitim Ajansı
Devlet eğitim kurumu
yüksek mesleki eğitim
Perm Devlet Teknik Üniversitesi
Kimya ve Biyoteknoloji Bölümü
Soyut:
litik enzimler. Lizozim
Gerçekleştirilen:
öğrenci gr.KhTBmPiB-05
Şevçenko I.K.
Danışman:
Doktora Gryaznova D.V.
Perm, 2010
Mikrobiyal kökenli litik enzimler 5
Keşif geçmişi 5
Bakteri kültürlerinde bakteriyolitik enzimlerin lokalizasyonu ve fizyolojik rolü 6
Bakteri hücre duvarlarının yapısının enzimlerin litik kabiliyetine etkisi 7
Bakteri hücre duvarlarının peptidoglikanı. 8
Bakteriyolitik enzimlerin substrat özgüllüğü 9
Bakteriyolitik kompleks "Lizoamidaz"ın keşfi 10
Lizoamidazın tıpta kullanımına ilişkin beklentiler 10
LİSOZİM 12
Lizis mekanizması 13
Çözüm. 15
Edebiyat. 16
Giriiş.
Besin değerlerini arttırmak ve mikrobiyal hücrelerin protoplazmasında bulunan biyolojik olarak aktif maddeleri bozulmamış bir biçimde elde etmek amacıyla çeşitli taksonomik gruplara ait mikroorganizmaların hücre duvarlarının parçalanması sorunu ilgili ve ulusal ekonomik öneme sahiptir.Mikrobiyal biyokütlenin yok edilmesi için çeşitli fiziksel ve biyokimyasal yöntemler bilinmektedir. Hücre duvarlarının enzimatik imha yöntemi, fizikokimyasal yöntemlerin aksine, hücreler üzerinde kontrollü bir etkiye ve hedef ürünlerin onlardan çıkarılmasına olanak tanır.
Mikroorganizmalar tarafından üretilen enzimler arasında, mikrobiyal hücre duvarının yapısal elemanlarının sıralı bozunmasının biyokimyasal reaksiyonlarını katalize eden litik enzimler tarafından özel bir yer işgal edilir.
Litik enzim preparatlarının kullanılması, mikrobiyal biyokütleden birçok değerli fizyolojik olarak aktif maddenin salınımının yoğunlaştırılmasını mümkün kılar: enzimler, vitaminler, amino asitler, vb. Yem mayasının hücre duvarının, sitoplazmik maddelerin sitoplazmik maddelerinin emilimini önlediği bilinmektedir. hayvanlara beslendiğinde hücre. Hücre duvarlarının enzimatik parçalanmasından sonra yem mayasının biyokütlesi artan bir besin değerine sahiptir, bu da genç çiftlik hayvanları için tam yağlı süt ikamelerinin bir parçası da dahil olmak üzere yem üretiminde daha verimli kullanılmasını mümkün kılar.
Ayrıca çevre koruma teknolojilerinde, mikrobiyolojik üretimin atıklarından biri olan mikrobiyal biyokütlenin değerlendirilmesi aşamalarında litik enzimler kullanılabilmektedir.
Ek olarak, dermatomikoz tedavisine yönelik olanlar da dahil olmak üzere, kimyasal olarak sentezlenmiş fungisitlere göre bir takım avantajlara sahip olan litik enzimlere dayalı antimikrobiyal ilaçlar yakın zamanda geliştirilmiştir. Çiftlik hayvanlarının gastrointestinal sistem hastalıklarının tedavisinde kullanıldığında olumlu sonuçlar elde edilmiştir. Stafilokok enfeksiyonuyla mücadelede, diş çürüklerinin tedavisinde litik enzimlerin kullanımı umut vericidir.
Endüstriyel enzim üretiminin yaratılması için özellikle ilgi çekici olan, yüksek bir büyüme hızına ve yetiştirme sıcaklığındaki değişikliklere karşı dirence sahip olan, litik enzimlerin aktinomiset üreticileri de dahil olmak üzere, ısıya dayanıklı mikroorganizmalardır. Ayrıca ısıya dayanıklı kültürlerin mikroflorayı enfekte etme açısından mezofilik üreticilere göre daha rekabetçi olması da önemlidir.
Mikrobiyal kökenli litik enzimler
Bakteri, mantar ve yüksek bitki hücrelerinin, hayvan hücrelerinin aksine, kural olarak çok güçlü hücre duvarlarına sahip olduğu iyi bilinmektedir. Bunun nedeni, bu organizmaların, yaşam ortamlarındaki sayısız biyolojik, kimyasal ve fiziksel faktörlere dayanma ihtiyacıdır. Aynı zamanda modern hücresel ve moleküler biyoloji alanında birçok deney yapabilmek için bu organizmaların kalın hücre duvarlarından yoksun "çıplak" hücrelerine sahip olmak gerekir. Bu tür "çıplak" hücreler veya "protoplastlar", hücre füzyonu deneyleri, çeşitli genetik mühendisliği manipülasyonları vb. için yaygın olarak kullanılmaktadır. Bu problemlerle bağlantılı olarak, bakterilerin, mantarların ve yüksek bitkilerin hücre duvarlarını yok edebilen (parçalayabilen) spesifik enzimler (protein niteliğindeki biyolojik katalizörler) bilim adamlarının yakın ilgisini uzun süredir çekmektedir. Bu arada, bu tür hücrelerin yüzey yapılarının yapısı ve işleyişinin incelenmesinde şu ana kadar elde edilen ilerleme, büyük ölçüde bu organizmaların hücre duvarlarının enzimatik lizizi üzerine yapılan çalışmaların gelişmesiyle ilişkilidir.Hücre duvarını yok eden (litik) enzimlerin, bu yapıların kendisinde, etki nesnelerinin hemen yakınında önemli miktarlarda bulunduğu ortaya çıktı. Bu tür enzimlere endojen (hücre içi) denir. Ayrıca litik enzimlerin bir kısmının ekzojen olduğu yani kendilerini oluşturan organizmaların yaşam alanlarına salgılandığı (salındığı) tespit edilmiştir.
Bakteri kültürlerinde bakteriyolitik enzimlerin lokalizasyonu ve fizyolojik rolü
Bakteriyolitik enzimlerin bakteri kültüründeki konumundan bahsedecek olursak öncelikle onları bu konuda üç gruba ayırmamız gerekir.
İlk grup oluşur otolizinler - hücre duvarının kendisinde her zaman (aktif veya inaktif durumda) bulunan bakteriyolitik enzimler. Bakteri hücrelerinin büyümesi ve farklılaşması sürecinde rol alırlar. Görünüşe göre bir bakteri hücresinde, hücre duvarının bileşenlerini yok eden ve sentezleyen enzimlerin aktiviteleri arasında normal bir ilişki vardır. Gerçekten de, yeni sentezlenen materyallerin hücre duvarına dahil edilmesi, belirli kimyasal bağların önceden parçalanması olmadan gerçekleşemez.
Duvarın liziz ve biyosentez işlemleri, bakteri hücresinin büyümesi ve gelişmesiyle aynı anda gerçekleşir ve yalnızca gelişimin sonraki aşamalarında, biyosentetik süreçler azaldığında ve litik enzimlerin aktivitesi aynı seviyede kaldığında, bakteriyel hücre lizizi meydana gelir. .
İkinci grup şunları içerir: Bakteri sporlarının litik enzimleri . Sporülasyon (spor oluşumu) döneminde ve bakteri sporlarının çimlenmesi sırasında biyopolimerlerin parçalanmasında rol oynayan diğer enzimlerle birlikte aktive edilirler. Bu enzimler, kabuğun tahrip edilmesi süreçlerinde ve bir bakteri hücresinin büyüme ve morfogenez süreçlerinde otolizinler olarak rol oynar.
Son olarak üçüncü grup ise hücre dışı litik enzimler . Biyolojik rolleri, bu tür enzimleri sentezleyen ve çevreye salgılayan bakterilerin, başta gıda kaynakları olmak üzere diğer bakterilere göre avantajlı olması gerçeğinde yatıyor gibi görünüyor. Diğer bakterilerin hücrelerini yok eden litik enzimler üreten bakteri, parçalanan hücrenin aminoasitlerini, karbonhidratlarını ve diğer bileşenlerini kendi ihtiyaçları için kullanır. Ayrıca bakteriyolitik enzimlerin bu grubu, bu enzimleri çevreye salgılayan hücrelerin, aynı ekolojik nişte yaşayan diğer bakterilerden korunmasında da tartışılmaz derecede önemli bir rol oynamaktadır.
Bakteriyel hücre duvarlarının yapısının enzimlerin litik kabiliyetine etkisi
Tüm bakteriler önemli ölçüde farklı iki gruba ayrılabilir: gram negatif ve gram pozitif. Aradaki fark, Gram pozitif ve Gram negatif bakterilerin hücre duvarlarının temelde farklı yapısından kaynaklanmaktadır. Gram pozitif bakterilerde (örn. stafilokok veya mikrokok) hücre duvarı, peptidoglikan adı verilen 70-80 nm kalınlığında çok katmanlı bir yapıdan oluşur. Bu hücrelerin sitoplazmik zarını kaplayan peptidoglikan kesesi, peptid köprüleriyle tek bir ağ halinde birbirine bağlanan polisakkarit zincirlerinden oluşur. Gram pozitif bakterilerin hücre zarlarının ağırlığının %80'ini oluşturur. Peptidoglikana ek olarak, bu bakterilerin hücre duvarları, teikoik asitler (Yunanca "teichos" duvarından) adı verilen negatif yüklü polimerler içerir. Teikoik asitlerin bir kısmı peptidoglikan ağına, bir kısmı da sitoplazmik membranın lipitlerine kovalent olarak bağlanır. İkinci durumda bunlara lipitteikoik asitler denir. Teikoik asitler, bileşimlerinde fosforik asit bulunması nedeniyle Gram pozitif bakteri hücrelerinin yüzeyinde elektronegatif bir yük sağlar.Bazı Gram-pozitif bakterilerde (örneğin Staphylococcus aureus), teikoik asitler onlarca ribitol fosfat molekülünden oluşur - ribitolteikoik asitler, diğer Gram-pozitif bakterilerde bu biyopolimerler gliserol fosfat moleküllerinden (gliserolteikoik asitler) oluşur. Teikoik asitler yalnızca Gram pozitif bakterilerde bulunur.
Gram-pozitif ve gram-negatif bakterilerin kabuklarının yapısındaki temel fark, ikincisinde sitoplazmik olana ek olarak dış membran olarak adlandırılan varlığıdır. İnce, tek-üç katmanlı bir peptidoglikan kesesinin (8 nm) üzerinde yer alan bu yapı, oldukça fazla sayıda benzersiz bileşenin tanımlandığı tipik iki katmanlı bir zardır: lipopolisakkaritler, lipoproteinler ve proteinler - porinler, dış zarda gözeneklerin oluşturulduğu, kabuğa (ve ondan çevreye) nispeten düşük moleküler ağırlıklı bileşiklerin nüfuz etmesine izin veren.
Bakteriyolitik enzimler, gram negatif bakterilerin tüm hücrelerindeki peptidoglikan katmanını, dış zarı çıkarmadan hidrolize edemez; bu, yalnızca bu hücrelerin şelatlayıcı maddeler, deterjanlar veya fiziksel yöntemlerle işlenmesiyle elde edilebilir.
Bakteri hücre duvarlarının peptidoglikanı.
Temel olarak bakteri hücrelerinin şeklinin korunmasından sorumludur ve bakteriyolitik enzimlerin yok etmeye çalıştığı yapıdır. Burada peptidoglikanın tüm gerçek bakterilerde mutlaka mevcut olduğunu vurgulamak önemlidir, ancak Gram-pozitif ve Gram-negatif bakterilerde bakteriyolitik enzimlerin etkisi için kullanılabilirliği önemli ölçüde farklılık gösterir.Yukarıda belirtildiği gibi peptidoglikan, tüm yapıyı bakteri hücresini dışarıdan çevreleyen tek bir "torba" halinde birleştiren polisakkarit zincirlerinden ve peptid köprülerinden oluşur. Polisakkarit (glikan) zincirleri, iki "tuğla"nın (glikozun nitrojen içeren türevleri: N-asetilglukosamin ve N-asetilmuramik asit) değişmesiyle oluşturulur ve genellikle kitin benzeri bir yapıyı temsil eder. Bu, evrimsel açıdan ilginçtir, çünkü kitin ve kitin benzeri yapılar, yaşayan dünyanın hemen hemen tüm temsilcilerinde (sadece bitkiler hariç) yaygındır ve Dünya üzerindeki en yaygın biyopolimerlerden biridir.
Peptidoglikan glikan zincirlerinin yapısı, incelenen bakterilerin çoğunda aynıdır. Farklı bakterilerdeki peptidoglikanın peptid kısmı önemli ölçüde farklılık gösterebilir. Ancak her durumda L- veya D-amino asitlerin 4-5 kalıntısından oluşur. Bu kısa peptidler bir yandan serbest NH2 grupları aracılığıyla muramik asidin karboksiline bir amid bağı ile bağlanırken, diğer yandan komşu glikan zincirinin aynı kısa peptidine bağlanırlar. Gram-pozitif bakterilerde, özellikle Staphylococcus aureus'ta, glikan zincirleriyle ilişkili peptitler doğrudan birbirine bağlanmaz, ancak çapraz bağlama köprüsü adı verilen ek bir peptitin katılımıyla bağlanır. Staphylococcus aureus'ta bu peptid köprüsü, en basit amino asit glisin'in beş molekülünden oluşur. Gram pozitif bakterilerin peptidoglikan yapısında bu tür köprülerin varlığı, onu daha yoğun gibi gösterir ve bu da Gram ile boyandığında boyanın bu hücreler tarafından tutulmasının en önemli nedenlerinden biridir. Peptidoglikandaki belirli bağların hidrolizi (su ile parçalanması), hücre duvarının bozulmasına ve bakterilerin parçalanmasına yol açar.
Bakteriyolitik enzimlerin substrat özgüllüğü
Substrat spesifikliğine göre bakteriyolitik enzimler üç tipe ayrılır.
Birinci tip, polisakkarit (glikan) zincirlerini yok eden glikozidazlardan oluşur. Bunlar arasında, N-asetilmuramik asit ile N-asetilglukozamin arasındaki bağı hidrolize eden N-asetilmuramidaz (lizozim) ve N-asetilglukosamin ile N-asetilmuramik asit arasındaki bağı hidrolize eden N-glukozaminidaz bulunur.
İkinci tip, polisakaritin muramik asidi ile peptit kısmı arasındaki bağı kesen bir enzim - N-asetilmuramil-L-alanilamidaz (veya basitçe amidaz) ile temsil edilir.
Üçüncü tip, peptidoglikanın peptid bağlarını hidrolize eden peptidazları içerir.
Bakteriyolitik kompleks "Lizoamidaz"ın keşfi
1975 yılında, Pushchino'daki (Oka Nehri kıyısında) Rusya Bilimler Akademisi Biyokimya ve Mikroorganizma Fizyolojisi Enstitüsü'nde ilginç bir gözlem yapıldı. Puşçin'in altındaki Oka sularında mikrobiyologlar G.K. Scriabin, V.A. Lambina ve arkadaşları, neredeyse hiç bakteri barındırmayan, oldukça geniş bir "steril nokta" buldular. "Nokta"nın hemen yakınındaki su örneklerinden, patojenik olanlar da dahil olmak üzere birçok bakterinin büyümesini engelleyen belirli bir faktörü çevreye salan Xanthomonas cinsinin bir bakteri kültürü izole edildi. Enstitü biyokimyacıları, benim liderliğim altında, bu "faktörün" aktif antibakteriyel ilkesinin, elektronegatif yüklü yüksek moleküler polisakarit ve pozitif yüklü enzimlerden oluşan bir kompleks olduğunu tespit etti. Bu kompleksin saflaştırılmış preparasyonuna lizoamidaz adı verildi. Biyokimyasal çalışmasının ilk aşamasında, peptidoglikandaki peptit (veya amid) bağlarını parçalayabilen ve sonuçta bakteri hücrelerinin parçalanmasına yol açabilen bakteriyolitik enzimler içerdiği bulundu.Lizoamidazın tıpta kullanımına ilişkin beklentiler
Zaten lisoamidaz preparatının özelliklerini incelemenin ilk aşamasında, bunun yalnızca biyolojide değil, örneğin hücre duvarlarından yoksun bakteriyel protoplastlar elde etmek için (Şekil 4) aynı zamanda tıpta da başarıyla kullanılabileceği ortaya çıktı. Lizoamidaz ilacının, antibiyotiğe dirençli birçok patojenik mikroorganizmayla mücadelede etkili bir araç olduğu ortaya çıktı.Günümüzde tıptaki en önemli sorunlardan biri, tıbbi uygulamada kullanılan antibiyotiklere karşı patojenik bakterilerin direnç (bağışıklık) klinik formlarının çok hızlı ortaya çıkmasıdır. Örneğin, hem Rusya'da hem de diğer ülkelerdeki çoğu doğum hastanesinde, yukarıdaki nedenlerden dolayı, özellikle stafilokok ve streptokok gibi bakterilerin neden olduğu cerahatli enfeksiyonlarla mücadele etmek giderek zorlaşmaktadır. Bununla birlikte, lisoamidaz ilacının, stafilokokların ve diğer Gram-pozitif patojenik bakterilerin çoklu ilaca dirençli suşlarının parçalanmasında çok etkili olduğu gösterilmiştir.
Lizoamidaz, Rus kliniklerinde kullanılan hemen hemen tüm antibiyotiklerden herhangi bir konsantrasyonda etkilenmeyen klinik suşları etkili bir şekilde öldürür. Bu ilacın daha ileri biyomedikal ve klinik denemeleri, doktorları lisoamidazın cerahatli enfeksiyonlarla mücadelede mükemmel bir araç olduğu sonucuna varmasına yol açtı. İyileşmesi zor trofik ülserlerin tedavisinde cerahatli cerrahi, diş hekimliği, jinekolojide yaygın olarak kullanılabilir. Şu anda, ilacın tıbbi uygulamada kullanılması onaylanmıştır ve üretimi, tıbbi amaçlar için Vyshnevolotsk enzim preparatları tesisinde kurulmuştur.
İlacın biyomedikal ve klinik testlerinde, sadece patojenik bakteriler üzerinde litik bir etkiye sahip olmadığı, aynı zamanda yaraları nekrotik (ölü) dokulardan iyi temizlediği ve aynı zamanda güçlü bir bağışıklık uyarıcı etkiye sahip olan yara iyileşmesini uyardığı ortaya çıktı.
Yaraların nekrotik kitlelerden (esas olarak denatüre proteinlerden oluşan) etkili bir şekilde temizlenmesinin, lisoamidaz preparatında yalnızca bakteriyolitik enzimlerin değil, aynı zamanda proteazların (protein parçalayıcı enzimler) varlığıyla ilişkili olduğu ortaya çıktı. Ve lisoamidazın immün sistemi uyarıcı aktivitesi, preparasyonda bir polisakkaritin varlığından kaynaklanmaktadır. Bir polisakaritin varlığı, lisoamidazın tıpta kullanılma olasılığı açısından temel öneme sahiptir, çünkü lisoamidazda bulunan bakteriyolitik enzimler, polisakarite elektrostatik olarak bağlanır ve bu da onların önemli ölçüde stabilizasyonuna yol açar. Lizoamidazın bakteriyolitik enzimleri, polisakaritten ayrıldıktan sonra, daha önce bilinen diğer analogları gibi, birkaç gün sonra enzimatik aktivitelerini kaybederler. Lizoamidazın bir parçası olarak bu enzimler, tıbbi preparatlar için zorunlu bir gereklilik olan soğukta aktivitelerini birkaç yıl boyunca neredeyse hiç değişmeden korur.
LİZOSİM
Lizozim (muramidaz), gram-pozitif bakterilerin hücre duvarındaki muramilglukozamin'i hidrolize ederek bakterilerin hücre zarlarını yok eden, hidrolaz sınıfının bir enzimi olan bir antibakteriyel maddedir. Lizozim, her şeyden önce, hayvan vücudunun çevre ile temas ettiği yerlerde - gastrointestinal sistemin mukoza zarında, lakrimal sıvıda, anne sütünde, tükürükte, nazofaringeal mukusta vb. Bulunur. Lizozim büyük miktarlarda bulunur. antibakteriyel özelliklerini açıklayan tükürük. İnsan anne sütünde lizozim konsantrasyonu çok yüksektir (yaklaşık 400 mg/l). Bu inekten çok daha fazlasıdır. Aynı zamanda anne sütündeki lizozim konsantrasyonu zamanla azalmaz, çocuğun doğumundan altı ay sonra artmaya başlar.1922 yılında Alexander Fleming tarafından burun boşluğundaki mukusta keşfedilmiş ve daha sonra insan vücudunun birçok doku ve sıvısında (kıkırdak, dalak, lökositler, gözyaşı), bitkilerde (lahana, şalgam, turp, yaban turpu), bazı bakteri ve fajlarda ve en büyük miktarda yumurta beyazında. Farklı kaynaklardan elde edilen lizozim yapı bakımından farklılık gösterir ancak eylem açısından benzerdir. Yumurta akı lizozimi, X-ışını kırınım analizi ile üç boyutlu bir yapı oluşturulan ve yapı ile etki mekanizması arasındaki ilişkinin ortaya konulduğu ilk enzimdir (1965); bu çalışmalar genel olarak enzimatik kataliz mekanizmalarının anlaşılmasına önemli bir katkı sağlamaktadır.
Lizozim, molekül ağırlığı yaklaşık 14.000 olan bir proteindir; tek polipeptit zinciri 129 amino asit kalıntısından oluşur ve kompakt bir kürecik (30x30x45 Å) şeklinde katlanır. Polipeptit zincirinin üç boyutlu yapısı 4 disülfit (-S - S -) bağıyla desteklenir. (İnsan sütü lizoziminde 3 tane, kaz yumurtası beyazında 2 tane var, T4 faj lizoziminde değiller; disülfit grupları ne kadar fazlaysa lizozim o kadar stabil ama daha az aktiftir.) Lizozim globülü bir şeritle ayrılmış iki parçadan oluşur. açıklık; bir kısımda çoğu amino asit (lösin, izolösin, triptofan vb.) hidrofobik gruplar içerir, diğerlerinde polar gruplu amino asitler (lisin, arginin, aspartik asit vb.) baskındır. Ortamın polaritesi, molekülün boşluğunun yüzeyinde bulunan iki karboksil grubunun (-COOH) farklı taraflarından iyonlaşmasını etkiler (bkz. Şekil). Lizozim, bakteri duvarının ana bileşenlerinden biri olan iki tip amino şekerden oluşan karmaşık bir polisakkarit üzerinde etki eder. Polisakkarit, hidrofobik ve hidrofilik kısımlarının sınırındaki boşluktaki lizozim molekülü tarafından, enzime 6 amino şeker halkası ve bunları bağlayan glikozidik bağlardan biri (4 ila 5 halka arasında) bağlanacak şekilde emilir. karboksillerin arasındadır. Lizozim karboksilleri ile glikosidik bağı oluşturan atomlar arasındaki etkileşimlerin yanı sıra substratın değerlik açılarının bozulması nedeniyle bağ aktive olur ve kırılır. Bu, bakteri hücre zarının tahrip olmasına yol açar.
Pirinç. Lizozimin yapısı. (N. A. Kravchenko)
Lizis mekanizması
Enzim, bakterilerin (özellikle gram pozitif olanların) hücre duvarlarını oluşturan peptidoglikanlara (özellikle murein) saldırır. Lizozim, N-asetilmuramik asit ve N-asetilglukozamin arasındaki (1,4)-glikosidik bağı hidrolize eder. Bu durumda peptidoglikan, enzimin iki yapısal alanı arasında bulunan aktif bölgesine (cep şeklinde) bağlanır. Aktif bölgedeki substrat molekülü geçiş durumuna yakın bir konformasyon benimser. Phillips mekanizmasına uygun olarak, lizozim bir heksasakkarite bağlanır ve daha sonra zincirdeki 4. kalıntıyı bir büküm sandalye konformasyonuna dönüştürür. Bu stresli durumda glikozidik bağ kolaylıkla kırılır.Glutamik asit (Glu35) ve aspartik asit (Asp52) kalıntıları enzim fonksiyonu için kritik öneme sahiptir. Glu35, substratın glikozidik bağı kırıldığında bağı yok ettiğinde proton donörü olarak görev yaparken Asp52, bir ara ürün olan glikosil enzimi oluştuğunda bir nükleofil görevi görür. Daha sonra glikosil enzimi bir su molekülü ile reaksiyona girer, bunun sonucunda enzim orijinal durumuna döner ve bir hidroliz ürünü oluşur.
Başvuru
İlaç lizozim gözlerin, nazofarinks, diş etleri, yanıkların tedavisinde, kadın doğumda vb. kullanılır. Gıda sektöründe gıda katkı maddesi E1105 olarak kayıtlıdır.
Çözüm.
Bu veriler, bakteriyolitik enzimlerin, aynı ekolojik ortamda bulunan bakteri ve bakteri topluluklarının hayati aktivitesinde oynadığı önemli rolü göstermektedir.Lizoamidaz ve lizozim ilacı örneğinde, bakteriyolitik enzimlerin, antibiyotiklere karşı çoklu dirençli olanlar da dahil olmak üzere patojenik bakterilerle mücadelede etkili bir terapötik ajan olarak kullanılmasına yönelik beklentiler gösterilmektedir.
Mikroorganizmaların enzimatik lizizi sorununa gösterilen büyük ilgiye rağmen, Rusya'da litik enzim preparatlarının endüstriyel üretimi bulunmamaktadır. Bu nedenle, litik enzimlerin biyosentezi için koşulların incelenmesi ve ulusal ekonominin ve tıbbın çeşitli sektörlerinde kullanılmak üzere litik etkili bir enzim preparatı elde etmek için bir teknolojinin geliştirilmesi ilgili ve umut vericidir.
Edebiyat.
1. Kulaev I.S., Severin A.I., Abramochkin G.V. Biyoloji ve tıpta mikrobiyal kökenli bakteriyolitik enzimler // Vestn. SSCB AMS. 1984. No. 8. S. 64-69.2. Saveliev E.P., Petrov G.I. Bakterilerin hücre duvarının yapısının moleküler bazları // Biyokimyadaki gelişmeler. 1978.T.19.S.106.
3. Zakharova I.Ya., Pavlova I.N. Mikroorganizmaların litik enzimleri. Kiev: Nauk. düşünce, 1985.
4. Skryabin G.K., Kulaev I.S. Lizoamidaz - mikroplara karşı bir meydan okuma // SSCB'de Bilim. 1990. No.2.S.52-53.
5. Kulaev I.S. Biyoloji ve tıpta mikrobiyal kökenli bakteriyolitik enzimler. // SOZH, 1997, Sayı 3, s. 23–31.
6. Phillips D., Enzim molekülünün üç boyutlu yapısı, koleksiyonda: Moleküller ve hücreler, çev. İngilizce'den, c. 3, M., 1968;
7. Vikipedi: özgür ansiklopedi [Elektronik kaynak]. – URL: http://ru.wikipedia.org/wiki/Lysozyme (erişim tarihi: 05/15/2010)
8. Akademisyenler: elektronik ansiklopediler [Elektronik kaynak]. – URL: http://dic.academic.ru/dic.nsf/bse/103560/lysozyme (erişim tarihi: 15.05.2010)
Proteinleri ve karbonhidratları parçalayan mikrobiyal sentez enzimleri
Amilorizin SH1X ve P10X. Aspergillus avamori mantarının kurutulmuş kültür kütlesi. Pektinesteraz, dekstrinaz, glikoamilaz, asit proteaz, selülaz, hemiselülaz içerir. Kuru ağırlığın %0,015'i oranında yeme ilave edilir.
Pektavamorin PX, PZH, P10X (Avamorin P). Aspergillus avamori mantarının kurutulmuş kültür kütlesi. Pektinesteraz, polimetilgalakteronaz, asit proteaz, selülaz, hemiselülaz içerir. Kuru ağırlığın %0,015'i oranında yeme ilave edilir.
Protosubtilin GZH. bakteriyel proteaz. Protein, karbonhidrat ve yağların daha iyi sindirilmesi amacıyla sığır yemlerine kuru ağırlık olarak %0,01 oranında ilave edilir.
Asit proteaz G10X. Aspergillus fostidus OV-208 mantarının, kültür sıvısının filtrelenmesi, filtratın aseton ile çökeltilmesi ve vakumla kurutulması yoluyla derin kültivasyonuyla elde edilen proteolitik enzim preparatı. İÇİNDE
1 g 100 birim içerir. oranında buzağılar için yeme ekleyin
0,2 g/yem birimler
Bulaşıcı hastalıkları olan hayvanların tedavisinde, gram pozitif mikroorganizmaların (stafilokok ve streptokok) duvarında% 95 içeren esas olarak heteroizomo-peptidoglikandan oluşan mikroorganizma duvarının bileşenlerini parçalayan enzim preparatları kullanılır ve Gram-negatif bakterilerin duvarında sadece %10. Mikroorganizma duvarının parçalanması üç tip enzim tarafından gerçekleştirilir: amilazlar, glikosidazlar ve proteazlar. Proteazlar, duvarın protein bileşenlerinin parçalanmasıyla eş zamanlı olarak, hücre içi parçalanmaya neden olan hücre içi bakteriyel enzimleri aktive eder ve bu da antimikrobiyal etkiyi arttırır.
Jinekolojik uygulamada lizozim, foliküler vestibülit, endometrit ve trikomoniyaz hastalarını tedavi etmek için kullanılır. Etiyolojik faktörün stafilokok olduğu bulaşıcı patolojide, lizostatin enzim preparatı kullanılır ve doğum kanalının mikotik lezyonları (kandidiyazis, aspergilloz vb.) durumunda, alt mantarlardan elde edilen kopran, bolbit reçete edilir. Hayvansal (tripsin, kimotripsin, pepsin vb.) ve bitki kökenli proteolitik enzimler, pürülan-nekrotik süreçlerin tedavisinde kısa süre etki gösterir. Canlı hücreler birçok anti-enzimatik bileşik içerdiğinden lizize uğramazlar.
Hareketsizleştirilmiş enzimler daha etkilidir. Profenzim, suda çözünür selüloz granülleri üzerinde immobilize edilir ve kompleks proteolitik ilaç imozin, suda çözünür bir polimer üzerinde immobilize edilir.
Lizosubtilin G10X (Lysosubtilinum G10X). Açık sarı ince toz, suda oldukça çözünür. Litik aktivitesi birim cinsinden ölçülür (1 g 1 milyon birim). Toz, 10 g'lık cam test tüplerinde ve 500, 1000 ve 2000 g'lık torbalarda üretilir.
İneklerde endometrit tedavisinde kullanılır. Bunun için
2 milyon ünite 100 ml distile suda eritilip enjekte edilir.
rahim. Buzağılarda ishalin önlenmesi için ilaç ilave edilir.
kolostrum (süt) 8-10 gün boyunca günde 2 kez 20 g/l. Tedavi amaçlı olarak iyileşene kadar günde 2 kez süte 25 g ekleyin.
Lizozim GZH (Lisocimum). Açık gri toz, kokusuz, suda çözünür. Lizozim üreticilerinin kültür sıvısının kurutulmasıyla elde edilen bir enzim preparatı. Proteolitik enzimler içerir.
15 kg'lık torbalarda paketlenmiş toz üretiyorlar. İçeri girin. Gram-pozitif ve gram-negatif mikroorganizmalarda poliaminosakkaritlerden oluşan bir duvarı lize eder. Besinlerin parçalanmasını ve emilimini artırır. Nötrofillerin fagositik aktivitesini arttırır ve proliferatif süreçleri uyarır.
Etlik piliçlerin beslenmesinde kuru ağırlığın %0,3 oranında yeme ilave edilerek kullanılır.
Buzağılara bronkopnömoni, ishal, osteodistrofi için karmaşık tedavide 5-20 gün boyunca 0.15-0.2 g/kg hayvan ağırlığı dozunda reçete edilir. Distrofili buzağıların tedavisinde ilaç günde 3 defa 2-4 g/l dozunda süte ilave edilir.
Pepsinorm. Enzim-bakteriyel preparat.
İki formda üretilir: pepsinorm-1 - belirli bir kokuya sahip grimsi sarı bir sıvı ve pepsinorm-2 - homojen süspansiyonların oluşumu ile suda kısmen çözünür, krem renkli toz halinde bir kütle.
Bakteriyolitik ve proteolitik enzimlerin varlığı nedeniyle sindirimi normalleştirir ve disbakteriyozu ortadan kaldırır.
Yeni doğan buzağıların akut gastrointestinal hastalıklarının tedavisinde ve önlenmesinde kullanılır. Tedavi amaçlı 50- " 100 ml sıvı veya 0,5-1 g kuru pepsinorm, 0,5 l kolostrum (süt) ile karıştırılarak ılık olarak içilir. Aynı zamanda spesifik terapötik ajanlar da reçete edilebilir.
Enzimler, doğanın çeşitli kimyasal işlemler için katalizör rolünü üstlendiği özel bir protein türüdür.
Bu terim sürekli duyulur, ancak herkes bir enzimin veya enzimin ne olduğunu, bu maddenin hangi işlevleri yerine getirdiğini, enzimlerin enzimlerden nasıl farklı olduğunu ve hiç farklı olup olmadıklarını anlamıyor. Bütün bunları şimdi öğreneceğiz.
Bu maddeler olmasaydı ne insanlar ne de hayvanlar yiyecekleri sindiremezdi. Ve insanlık ilk kez günlük yaşamda enzim kullanımına başvurdu, atalarımız sütü hayvanların midesinden "tabaklarda" saklamayı öğrendiğinde 5 bin yıldan daha uzun bir süre önce başvurdu. Bu koşullar altında peynir mayası etkisi altında peynire dönüştü. Ve bu, bir enzimin biyolojik süreçleri hızlandıran bir katalizör olarak nasıl çalıştığının sadece bir örneğidir. Günümüzde enzimler endüstrinin vazgeçilmezidir; deri, tekstil, alkol ve hatta beton üretiminde önemlidirler. Bu faydalı maddeler aynı zamanda deterjanlarda ve çamaşır tozlarında da bulunur; düşük sıcaklıklarda lekelerin çıkarılmasına yardımcı olurlar.
Keşif geçmişi
Enzim Yunanca'da "ekşi maya" anlamına gelir. Ve insanlık bu maddenin keşfini 16. yüzyılda yaşamış Hollandalı Jan Baptist Van Helmont'a borçludur. Bir zamanlar alkol fermantasyonuyla çok ilgilenmeye başladı ve araştırma sırasında bu süreci hızlandıran bilinmeyen bir madde buldu. Hollandalılar buna fermantasyon anlamına gelen fermentum adını verdi. Ardından, neredeyse üç yüzyıl sonra, fermantasyon süreçlerini gözlemleyen Fransız Louis Pasteur, enzimlerin canlı bir hücrenin maddelerinden başka bir şey olmadığı sonucuna vardı. Ve bir süre sonra Alman Eduard Buchner, enzimi mayadan çıkardı ve bu maddenin canlı bir organizma olmadığını belirledi. Ayrıca ona "zimaza" adını da verdi. Birkaç yıl sonra başka bir Alman Willy Kuehne, tüm protein katalizörlerini iki gruba ayırmayı önerdi: enzimler ve enzimler. Dahası, eylemleri canlı organizmaların dışına uzanan ikinci terime "ekşi maya" adını vermeyi önerdi. Ve yalnızca 1897, tüm bilimsel tartışmalara son verdi: Her iki terimin de (enzim ve enzim) mutlak eşanlamlı olarak kullanılmasına karar verildi.
Yapısı: binlerce amino asitten oluşan bir zincir
 Tüm enzimler proteindir ancak tüm proteinler enzim değildir. Diğer proteinler gibi enzimler de oluşur. Ve ilginçtir ki, her bir enzimin oluşumu, bir ipe dizilmiş inciler gibi yüz ila bir milyon arası amino asit gerektirir. Ancak bu iplik eşit değildir; genellikle yüzlerce kez bükülür. Böylece her enzime özel üç boyutlu bir yapı ortaya çıkar. Bu arada, enzim molekülü nispeten büyük bir oluşumdur ve yapısının yalnızca küçük bir kısmı, sözde aktif merkez, biyokimyasal reaksiyonlarda rol oynar.
Tüm enzimler proteindir ancak tüm proteinler enzim değildir. Diğer proteinler gibi enzimler de oluşur. Ve ilginçtir ki, her bir enzimin oluşumu, bir ipe dizilmiş inciler gibi yüz ila bir milyon arası amino asit gerektirir. Ancak bu iplik eşit değildir; genellikle yüzlerce kez bükülür. Böylece her enzime özel üç boyutlu bir yapı ortaya çıkar. Bu arada, enzim molekülü nispeten büyük bir oluşumdur ve yapısının yalnızca küçük bir kısmı, sözde aktif merkez, biyokimyasal reaksiyonlarda rol oynar.
Her amino asit spesifik bir kimyasal bağa bağlıdır ve her enzimin kendine özgü bir amino asit dizisi vardır. Çoğunu oluşturmak için yaklaşık 20 tür kullanılır. Amino asit dizisindeki küçük değişiklikler bile bir enzimin görünüşünü ve hissini önemli ölçüde değiştirebilir.
Biyokimyasal özellikler
Doğada enzimlerin katılımıyla çok sayıda reaksiyon meydana gelse de bunların hepsi 6 kategoriye ayrılabilir. Buna göre bu altı reaksiyonun her biri belirli bir enzim tipinin etkisi altında gerçekleşir.
Enzimleri içeren reaksiyonlar:
- Oksidasyon ve redüksiyon.
Bu reaksiyonlarda yer alan enzimlere oksidoredüktazlar denir. Örnek olarak, alkol dehidrojenazların birincil alkolleri aldehite nasıl dönüştürdüğünü hatırlayın.
- Grup transfer reaksiyonu.
Bu reaksiyonlardan sorumlu olan enzimlere transferaz denir. Fonksiyonel grupları bir molekülden diğerine taşıma yeteneğine sahiptirler. Bu, örneğin alanin aminotransferazlar alfa-amino gruplarını alanin ve aspartat arasında hareket ettirdiğinde meydana gelir. Transferazlar ayrıca fosfat gruplarını ATP ile diğer bileşikler arasında hareket ettirir ve bunları kalıntılardan oluşturur.
- Hidroliz.
 Reaksiyona katılan hidrolazlar, su elementleri eklenerek tekli bağları kırabilir.
Reaksiyona katılan hidrolazlar, su elementleri eklenerek tekli bağları kırabilir.
- Çift bağ oluşturun veya kaldırın.
Bu tip reaksiyon, liyazın katılımıyla hidrolitik olmayan bir şekilde meydana gelir.
- Fonksiyonel grupların izomerizasyonu.
Birçok kimyasal reaksiyonda, fonksiyonel grubun molekül içindeki konumu değişir, ancak molekülün kendisi, reaksiyon başlamadan öncekiyle aynı sayıda ve türde atomdan oluşur. Başka bir deyişle reaksiyonun substratı ve ürünü izomerlerdir. Bu tür dönüşüm izomeraz enzimlerinin etkisi altında mümkündür.
- Su elementinin ortadan kaldırılmasıyla tek bir bağın oluşması.
Hidrolazlar moleküle su elementleri ekleyerek bağları kırarlar. Liyazlar, sulu kısmı fonksiyonel gruplardan uzaklaştırarak ters reaksiyonu gerçekleştirir. Böylece basit bir bağlantı yaratılmış olur.
Vücutta nasıl çalışırlar?
Enzimler hücrelerde meydana gelen hemen hemen tüm kimyasal reaksiyonları hızlandırır. İnsanlar için hayati öneme sahiptirler, sindirimi kolaylaştırırlar ve metabolizmayı hızlandırırlar.
Bu maddelerin bazıları, çok büyük moleküllerin vücudun sindirebileceği daha küçük "parçalara" ayrılmasına yardımcı olur. Diğerleri ise tam tersine küçük molekülleri bağlar. Ancak bilimsel olarak enzimler son derece seçicidir. Bu, bu maddelerin her birinin yalnızca belirli bir reaksiyonu hızlandırabileceği anlamına gelir. Enzimlerin birlikte çalıştığı moleküllere substrat denir. Substratlar da enzimin aktif bölge adı verilen kısmı ile bir bağ oluşturur.
Enzimler ve substratlar arasındaki etkileşimin özelliklerini açıklayan iki prensip vardır. "Tuş kilidi" olarak adlandırılan modelde, enzimin aktif bölgesi, substratta kesin olarak tanımlanmış bir konfigürasyonun yerini alır. Başka bir modele göre, reaksiyondaki her iki katılımcı, yani aktif bölge ve substrat, bağlantı kurmak için şekillerini değiştirir.
Etkileşim prensibi ne olursa olsun sonuç her zaman aynıdır - enzimin etkisi altındaki reaksiyon birçok kez daha hızlı ilerler. Bu etkileşimin sonucunda yeni moleküller "doğar" ve bunlar daha sonra enzimden ayrılır. Ve katalizör maddesi işini yapmaya devam ediyor, ancak diğer parçacıkların katılımıyla.
Hiper ve hipoaktivite
Enzimlerin fonksiyonlarını yanlış yoğunlukta yerine getirdikleri zamanlar vardır. Aşırı aktivite, aşırı reaksiyon ürünü oluşumuna ve substrat eksikliğine neden olur. Sonuç kötü sağlık ve ciddi hastalıktır. Enzim hiperaktivitesinin nedeni genetik bir bozukluk, vitamin fazlalığı ya da reaksiyonda kullanılmış olabilir.
Enzim hipoaktivitesi, örneğin enzimler vücuttan toksinleri atamadığında veya ATP eksikliği oluştuğunda ölüme bile neden olabilir. Bu durumun nedeni aynı zamanda mutasyona uğramış genler veya tersine hipovitaminoz ve diğer besin maddelerinin eksikliği de olabilir. Ayrıca düşük vücut ısısı da benzer şekilde enzimlerin çalışmasını yavaşlatır.
Katalizör ve daha fazlası
 Günümüzde enzimlerin faydalarını sıklıkla duyabilirsiniz. Peki vücudumuzun performansının bağlı olduğu bu maddeler nelerdir?
Günümüzde enzimlerin faydalarını sıklıkla duyabilirsiniz. Peki vücudumuzun performansının bağlı olduğu bu maddeler nelerdir?
Enzimler, yaşam döngüleri doğum ve ölüm sınırlarıyla belirlenmeyen biyolojik moleküllerdir. Sadece çözünene kadar vücutta çalışırlar. Kural olarak, bu diğer enzimlerin etkisi altında gerçekleşir.
Biyokimyasal reaksiyon sırasında nihai ürünün parçası haline gelmezler. Reaksiyon tamamlandığında enzim substratı terk eder. Bundan sonra madde yeniden çalışmaya hazırdır, ancak farklı bir molekül üzerinde. Ve bu, vücudun ihtiyaç duyduğu sürece devam eder.
Enzimlerin benzersizliği, her birinin yalnızca atanmış bir işlevi yerine getirmesidir. Biyolojik bir reaksiyon ancak enzim kendisi için doğru substratı bulduğunda meydana gelir. Bu etkileşim, bir anahtarın ve bir kilidin çalışma prensibi ile karşılaştırılabilir - yalnızca doğru seçilmiş öğeler birlikte çalışabilir. Diğer bir özelliği ise düşük sıcaklıklarda ve orta pH'ta çalışabilmeleri ve katalizör olarak diğer kimyasallardan daha kararlı olmalarıdır.
Katalizör olarak enzimler metabolik süreçleri ve diğer reaksiyonları hızlandırır.
Kural olarak, bu süreçler her biri belirli bir enzimin çalışmasını gerektiren belirli aşamalardan oluşur. Bu olmadan dönüşüm veya hızlanma döngüsü tamamlanamaz.
Enzimlerin fonksiyonları arasında belki de en iyi bilineni katalizör rolüdür. Bu, enzimlerin kimyasalları, bir ürünü daha hızlı oluşturmak için gereken enerji maliyetlerini azaltacak şekilde birleştirdiği anlamına gelir. Bu maddeler olmasaydı kimyasal reaksiyonlar yüzlerce kat daha yavaş ilerlerdi. Ancak enzimlerin yetenekleri bununla bitmiyor. Tüm canlı organizmalar, yaşamaya devam etmek için ihtiyaç duydukları enerjiyi içerir. Adenozin trifosfat veya ATP, hücrelere enerji sağlayan bir tür şarjlı pildir. Ancak ATP'nin işleyişi enzimler olmadan mümkün değildir. Ve ATP'yi üreten ana enzim sentazdır. Enerjiye dönüştürülen her glikoz molekülü için sentaz yaklaşık 32-34 ATP molekülü üretir.
Ayrıca enzimler (lipaz, amilaz, proteaz) tıpta aktif olarak kullanılmaktadır. Özellikle hazımsızlığı tedavi etmek için kullanılan Festal, Mezim, Panzinorm, Pankreatin gibi enzimatik preparatların bir bileşeni olarak görev yaparlar. Ancak bazı enzimler dolaşım sistemini de etkileyebilir (kan pıhtılarını çözebilir), cerahatli yaraların iyileşmesini hızlandırabilir. Kansere karşı tedavide bile enzimlerin yardımına başvuruyorlar.
Enzimlerin aktivitesini belirleyen faktörler
Enzim reaksiyonları birçok kez hızlandırabildiğinden, aktivitesi devir sayısı olarak adlandırılan sayıya göre belirlenir. Bu terim, 1 enzim molekülünün 1 dakikada dönüştürebildiği substrat moleküllerinin (reaktif maddeler) sayısını ifade eder. Ancak reaksiyonun hızını belirleyen birçok faktör vardır:
- Substrat konsantrasyonu.
 Substrat konsantrasyonunun arttırılması reaksiyonun hızlanmasına yol açar. Aktif maddenin molekül sayısı arttıkça reaksiyon daha hızlı ilerler, çünkü daha fazla aktif merkez söz konusudur. Ancak hızlanma ancak tüm enzim molekülleri dahil olana kadar mümkündür. Bundan sonra substratın konsantrasyonunu arttırmak bile reaksiyonu hızlandırmayacaktır.
Substrat konsantrasyonunun arttırılması reaksiyonun hızlanmasına yol açar. Aktif maddenin molekül sayısı arttıkça reaksiyon daha hızlı ilerler, çünkü daha fazla aktif merkez söz konusudur. Ancak hızlanma ancak tüm enzim molekülleri dahil olana kadar mümkündür. Bundan sonra substratın konsantrasyonunu arttırmak bile reaksiyonu hızlandırmayacaktır.
- Sıcaklık.
Genellikle sıcaklıktaki bir artış reaksiyonların hızlanmasına yol açar. Bu kural çoğu enzimatik reaksiyon için geçerlidir, ancak yalnızca sıcaklık 40 santigrat derecenin üzerine çıkmadığı sürece. Bu işaretten sonra reaksiyon hızı tam tersine keskin bir şekilde azalmaya başlar. Sıcaklık kritik bir noktanın altına düşerse enzimatik reaksiyonların hızı tekrar artacaktır. Sıcaklık artmaya devam ederse kovalent bağlar kopar ve enzimin katalitik aktivitesi sonsuza kadar kaybolur.
- Asitlik.
Enzimatik reaksiyonların hızı da pH değerinden etkilenir. Her enzimin, reaksiyonun en uygun şekilde ilerleyeceği kendi optimal asitlik seviyesi vardır. PH seviyesinin değiştirilmesi enzimin aktivitesini ve dolayısıyla reaksiyonun hızını etkiler. Değişim çok büyükse substrat aktif çekirdeğe bağlanma yeteneğini kaybeder ve enzim artık reaksiyonu katalize edemez. Gerekli pH seviyesinin restorasyonu ile enzimin aktivitesi de eski haline döner.
İnsan vücudunda bulunan enzimler 2 gruba ayrılabilir:
- metabolik;
- sindirim.
Toksik maddeleri nötralize etmek için metabolik "çalışma" ve aynı zamanda enerji ve protein üretimine de katkıda bulunur. Ve elbette vücuttaki biyokimyasal süreçleri hızlandırırlar.
Sindirim organlarının nelerden sorumlu olduğu isminden de bellidir. Ancak burada bile seçicilik ilkesi işliyor: Belirli bir enzim türü yalnızca bir tür gıdayı etkiliyor. Bu nedenle sindirimi iyileştirmek için küçük bir numaraya başvurabilirsiniz. Vücut yiyeceklerden bir şeyi iyi sindiremezse, o zaman diyete, sindirimi zor yiyecekleri parçalayabilen bir enzim içeren bir ürünle takviye etmek gerekir.
Gıda enzimleri, gıdayı vücudun yararlı maddeleri emebileceği bir duruma getiren katalizörlerdir. Sindirim enzimleri çeşitli tiplerde gelir. İnsan vücudunda sindirim sisteminin farklı kısımlarında farklı türde enzimler bulunur.
Ağız boşluğu
 Bu aşamada alfa-amilaz gıdaya etki eder. Patates, meyve, sebze ve diğer gıdalarda bulunan karbonhidratları, nişastaları ve glikozu parçalar.
Bu aşamada alfa-amilaz gıdaya etki eder. Patates, meyve, sebze ve diğer gıdalarda bulunan karbonhidratları, nişastaları ve glikozu parçalar.
Karın
Burada pepsin, proteinleri peptitlere ayırır ve jelatinaz, ette bulunan jelatin ve kolajeni parçalar.
Pankreas
Bu aşamada "çalışma":
- Tripsin - proteinlerin parçalanmasından sorumludur;
- alfa-kimotripsin - proteinlerin emilimine yardımcı olur;
- elastaz - belirli protein türlerini parçalar;
- nükleazlar - nükleik asitlerin parçalanmasına yardımcı olur;
- steapsin - yağlı gıdaların emilimini arttırır;
- amilaz - nişastaların emiliminden sorumludur;
- lipaz – süt ürünleri, kuruyemişler, yağlar ve etlerde bulunan yağları (lipitleri) parçalar.
İnce bağırsak
Yiyecek parçacıklarının üzerinde "sihir yaratır":
- peptidazlar - peptid bileşiklerini amino asit seviyesine kadar parçalar;
- sükraz - karmaşık şekerlerin ve nişastaların emilmesine yardımcı olur;
- maltaz - disakkaritleri monosakkaritlerin (malt şekeri) durumuna ayırır;
- laktaz - laktozu (süt ürünlerinde bulunan glikoz) parçalar;
- lipaz - trigliseritlerin, yağ asitlerinin emilimini arttırır;
- erepsin - proteinleri etkiler;
- izomaltaz - maltoz ve izomaltoz ile "çalışır".
Kolon
 Burada enzimlerin işlevleri gerçekleştirilir:
Burada enzimlerin işlevleri gerçekleştirilir:
- coli - sindirimden sorumludur;
- laktobasiller - laktozu ve diğer bazı karbonhidratları etkiler.
Bu enzimlere ek olarak şunlar da vardır:
- diastaz - bitkisel nişastayı sindirir;
- invertaz - sükrozu (sofra şekeri) parçalar;
- glikoamilaz - glikoza dönüşür;
- alfa-galaktosidaz - fasulye, tohum, soya ürünleri, kök sebzeler ve yapraklı sebzelerin sindirimini destekler;
- bromelain - farklı protein türlerinin parçalanmasını teşvik eden, ortamın farklı asitlik seviyelerinde etkili olan ve anti-inflamatuar özelliklere sahip olan bir enzimden türetilmiştir;
- Ham papayadan izole edilen bir enzim olan papain, küçük ve büyük proteinlerin parçalanmasını destekler ve çok çeşitli substratlar ve asitlik üzerinde etkilidir.
- selülaz - selülozu, bitki liflerini (insan vücudunda bulunmayan) parçalar;
- endoproteaz - peptid bağlarını ayırır;
- öküz safrası ekstresi - hayvansal kökenli bir enzim, bağırsak hareketliliğini uyarır;
- pankreatin - hayvansal kökenli bir enzim, proteinlerin sindirimini hızlandırır;
- pankrelipaz - emilimi destekleyen bir hayvan enzimi
Fermente gıdalar, uygun sindirim için gerekli olan faydalı bakterilerin mükemmele yakın kaynağıdır. Eczane probiyotikleri yalnızca üst sindirim sisteminde "çalışırken" ve çoğu zaman bağırsaklara ulaşmazken, enzimatik ürünlerin etkisi gastrointestinal sistem boyunca hissedilir.
Örneğin kayısı, glikozun parçalanmasından sorumlu olan ve hızlı enerji salınımını destekleyen invertaz da dahil olmak üzere faydalı enzimlerin bir karışımını içerir.
Doğal bir lipaz kaynağı (lipitlerin daha hızlı sindirimini destekler) hizmet edebilir. Vücutta bu madde pankreas tarafından üretilir. Ancak bu vücut için hayatı kolaylaştırmak için, örneğin avokadolu bir salata ile kendinizi şımartabilirsiniz - lezzetli ve sağlıklı.
Belki de en ünlü kaynak olmasının yanı sıra vücuda amilaz ve maltaz da sağlar. Amilaz ayrıca ekmek ve tahıllarda da bulunur. Maltaz, bira ve mısır şurubunda bol miktarda bulunan malt şekeri adı verilen maltozun parçalanmasına yardımcı olur.
Başka bir egzotik meyve olan ananas, bromelain de dahil olmak üzere çok çeşitli enzimler içerir. Ve bazı çalışmalara göre kanser önleyici ve iltihap önleyici özelliklere de sahiptir.
Ekstremofiller ve endüstri
Ekstremofiller aşırı koşullarda hayatta kalabilen maddelerdir.
Canlı organizmalar ve onların fonksiyonlarını sağlayan enzimler, sıcaklığın kaynama noktasına yakın olduğu gayzerlerde, buzun derinliklerinde ve aşırı tuzluluk koşullarında (ABD'deki Ölüm Vadisi) bulunmuştur. Ek olarak, bilim adamları, pH seviyesinin etkili çalışma için temel bir gereklilik olmadığı ortaya çıkan enzimler de buldular. Araştırmacılar, endüstride yaygın olarak kullanılabilecek maddeler olarak ekstremofil enzimleri özellikle ilgiyle inceliyorlar. Her ne kadar bugün bile enzimler endüstrideki uygulamalarını biyolojik ve çevre dostu maddeler olarak bulmuşlardır. Enzimlerin kullanımına gıda endüstrisinde, kozmetolojide ve ev kimyasallarının üretiminde başvurulmaktadır.
Izvozchikova Nina Vladislavovna
Uzmanlık: bulaşıcı hastalıklar uzmanı, gastroenterolog, göğüs hastalıkları uzmanı.
Genel deneyim: 35 yıl .
Eğitim:1975-1982, 1MMI, San-Gig, en yüksek yeterlilik, bulaşıcı hastalıklar doktoru.
Bilim derecesi: en yüksek kategorideki doktor, tıp bilimleri adayı.