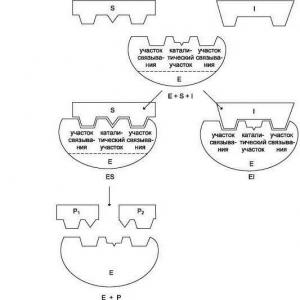
Yüksek oranda çözünür tuzlar nelerdir? Kimyada tuzlar: türleri ve özellikleri
Bir tuz, bir asit ve bir baz arasındaki reaksiyonla oluşan, ancak su olmayan bir bileşik olarak tanımlanabilir. Bu bölümde, iyonik denge ile ilişkili tuzların özellikleri ele alınacaktır.
suda tuz reaksiyonları
Bir süre sonra çözünürlüğün göreceli bir kavram olduğu gösterilecektir. Bununla birlikte, aşağıdaki tartışmanın amaçları doğrultusunda, tüm tuzları kabaca suda çözünen ve suda çözünmeyen tuzlar olarak sınıflandırabiliriz.
Bazı tuzlar suda çözündüklerinde nötr çözeltiler oluştururlar. Diğer tuzlar asidik veya alkali çözeltiler oluşturur. Bunun nedeni, tuz iyonları ve su arasında tersinir bir reaksiyonun meydana gelmesi ve bunun sonucunda konjuge asitlerin veya bazların oluşmasıdır. Bir tuz çözeltisinin nötr, asidik veya alkali olması tuzun türüne bağlıdır. Bu anlamda dört çeşit tuz vardır.
Kuvvetli asitler ve zayıf bazların oluşturduğu tuzlardır. Bu tür tuzlar suda çözündüklerinde asidik bir çözelti oluştururlar. Örnek olarak amonyum klorür NH4Cl'yi ele alalım. Bu tuz suda çözündüğünde, amonyum iyonu şu şekilde davranır:
Bu işlemde oluşan fazla miktardaki H3O+ iyonları çözeltinin asidik özelliklerini belirler.
Zayıf asit ve kuvvetli bazın oluşturduğu tuzlardır. Bu tür tuzlar suda çözündüklerinde alkali bir çözelti oluştururlar. Örnek olarak, sodyum asetatı ele alalım CH3COONa1 Asetat iyonu, bu durumda asit gibi davranan sudan bir proton alarak bir baz görevi görür:
Bu süreçte oluşan fazla OH- iyonları, çözeltinin alkalin özelliklerini belirler.
Kuvvetli asitler ve kuvvetli bazların oluşturduğu tuzlardır. Bu tür tuzlar suda çözüldüğünde nötr bir çözelti oluşur. Örnek olarak sodyum klorür NaCl'yi ele alalım. Bu tuz suda çözündüğünde tamamen iyonlaşır ve bu nedenle Na+ iyonlarının konsantrasyonu Cl- iyonlarının konsantrasyonuna eşittir. Hiçbir iyon su ile asit-baz reaksiyonlarına girmediğinden, çözeltide aşırı miktarda H3O + veya OH iyonu oluşumu yoktur. Bu nedenle, çözüm nötrdür.
Zayıf asitler ve zayıf bazların oluşturduğu tuzlar. Bu tip tuzların bir örneği amonyum asetattır. Suda çözündüğünde, amonyum iyonu su ile asit olarak reaksiyona girer ve asetat iyonu su ile baz olarak reaksiyona girer. Bu reaksiyonların her ikisi de yukarıda tarif edilmiştir. Zayıf bir asit ve zayıf bir bazın oluşturduğu sulu bir tuz çözeltisi, katyonların ve anyonların reaksiyonları sonucu oluşan H3O+ ve OH- iyonlarının bağıl konsantrasyonlarına bağlı olarak zayıf asidik, hafif alkali veya nötr olabilir. su ile tuz. Katyon ve anyonun ayrışma sabitlerinin değerleri arasındaki orana bağlıdır.
Sofra tuzu, gıda katkı maddesi ve gıda koruyucu olarak kullanılan sodyum klorürdür. Kimya sanayinde, tıpta da kullanılır. Kostik soda, soda ve diğer maddelerin üretimi için en önemli hammadde olarak hizmet vermektedir. Sofra tuzunun formülü NaCl'dir.
Sodyum ve klor arasında iyonik bağ oluşumu
Sodyum klorürün kimyasal bileşimi, eşit sayıda sodyum ve klor atomu hakkında bir fikir veren NaCl koşullu formülünü yansıtır. Ancak madde, iki atomlu moleküllerden oluşmaz, kristallerden oluşur. Bir alkali metal, güçlü bir ametal ile etkileştiğinde, her bir sodyum atomu daha fazla elektronegatif klor verir. Na + sodyum katyonları ve hidroklorik asit Cl - asit kalıntısının anyonları vardır. Zıt yüklü parçacıklar çekilerek iyonik kristal kafesli bir madde oluşturur. Büyük klorür anyonları arasında küçük sodyum katyonları bulunur. Sodyum klorür bileşimindeki pozitif parçacıkların sayısı, negatif olanların sayısına eşittir, madde bir bütün olarak nötrdür.
Kimyasal formül. Sofra tuzu ve halit
Tuzlar, adları asit kalıntısının adıyla başlayan karmaşık iyonik maddelerdir. Sofra tuzunun formülü NaCl'dir. Jeologlar bu bileşimdeki bir minerale “halit”, tortul kayaçlara ise “kaya tuzu” adını verirler. Endüstride sıklıkla kullanılan eski bir kimyasal terim "sodyum klorür" dür. Bu madde eski zamanlardan beri insanlar tarafından biliniyor, bir zamanlar "beyaz altın" olarak kabul ediliyordu. Modern okul çocukları ve öğrenciler, sodyum klorür içeren reaksiyonların denklemlerini okurken kimyasal işaretler ("sodyum klorür") derler.
Maddenin formülüne göre basit hesaplamalar yapacağız:
1) Bay (NaCl) \u003d Ar (Na) + Ar (Cl) \u003d 22.99 + 35.45 \u003d 58.44.
Göreli 58.44'tür (amu cinsinden).
2) Molar kütle sayısal olarak moleküler ağırlığa eşittir, ancak bu değer g / mol birimlerine sahiptir: M (NaCl) \u003d 58.44 g / mol.
3) 100 gr tuz numunesi 60.663 gr klor atomu ve 39.337 gr sodyum içerir.
Sofra tuzunun fiziksel özellikleri
Gevrek halit kristalleri renksiz veya beyazdır. Doğada ayrıca gri, sarı veya maviye boyanmış kaya tuzu birikintileri de vardır. Bazen mineral madde, safsızlıkların türleri ve miktarlarından kaynaklanan kırmızı bir tona sahiptir. Halitin sertliği sadece 2-2,5'dir, cam yüzeyinde bir çizgi bırakır.

Sodyum klorürün diğer fiziksel parametreleri:
- koku - yok;
- tat - tuzlu;
- yoğunluk - 2,165 g / cm3 (20 ° C);
- erime noktası - 801 ° C;
- kaynama noktası - 1413 ° C;
- suda çözünürlük - 359 g / l (25 ° C);
Laboratuvarda sodyum klorür elde edilmesi
Metalik sodyum, bir test tüpünde gaz halindeki klor ile etkileşime girdiğinde, beyaz bir madde oluşur - sodyum klorür NaCl (yaygın tuz formülü).

Kimya, aynı bileşiği elde etmenin farklı yolları hakkında fikir verir. İşte bazı örnekler:
NaOH (sulu) + HCI \u003d NaCl + H20.
Metal ve asit arasındaki redoks reaksiyonu:
2Na + 2HCl \u003d 2NaCl + H2.
Asidin metal oksit üzerindeki etkisi: Na2O + 2HCl (sulu) = 2NaCl + H20
Zayıf bir asidin tuz çözeltisinden daha güçlü olanla yer değiştirmesi:
Na2C03 + 2HCl (sulu) \u003d 2NaCl + H20 + CO2 (gaz).
Tüm bu yöntemler, endüstriyel ölçekte uygulanamayacak kadar pahalı ve karmaşıktır.
tuz üretimi
Uygarlığın şafağında bile insanlar tuzlamadan sonra et ve balığın daha uzun süre dayandığını biliyorlardı. Bazı eski ülkelerde para yerine şeffaf, düzenli şekilli halit kristalleri kullanılıyordu ve ağırlıkları altın değerindeydi. Halit yataklarının aranması ve geliştirilmesi, nüfusun ve endüstrinin artan ihtiyaçlarını karşılamayı mümkün kılmıştır. En önemli doğal sofra tuzu kaynakları:
- farklı ülkelerdeki maden halit yatakları;
- denizlerin, okyanusların ve tuz göllerinin suyu;
- tuzlu su kütlelerinin kıyısındaki kaya tuzu katmanları ve kabukları;
- volkanik kraterlerin duvarlarında halit kristalleri;
- tuz bataklıkları.

Endüstride sofra tuzu elde etmenin dört ana yöntemi kullanılır:
- yer altı katmanından halitin sızması, oluşan tuzlu suyun buharlaşması;
- madencilik;
- tuz göllerinin buharlaşması veya tuzlu suyu (kuru kalıntı kütlesinin %77'si sodyum klorürdür);
- tuzlu suyun tuzdan arındırılmasının bir yan ürününün kullanılması.
Sodyum klorürün kimyasal özellikleri

Bileşiminde NaCl, bir alkali ve çözünür bir asitten oluşan bir orta tuzdur. Sodyum klorür güçlü bir elektrolittir. İyonlar arasındaki çekim o kadar güçlü ki, yalnızca yüksek polar çözücüler onu yok edebilir. Suda maddeler ayrışır, katyonlar ve anyonlar (Na +, Cl -) açığa çıkar. Varlıkları, bir ortak tuz çözeltisine sahip olan elektriksel iletkenlikten kaynaklanmaktadır. Bu durumda formül, kuru madde - NaCl ile aynı şekilde yazılır. Sodyum katyonuna kalitatif reaksiyonlardan biri, brülör alevinin sarıya boyanmasıdır. Deneyin sonucunu elde etmek için temiz bir tel halka üzerinde biraz katı tuz toplayıp alevin orta kısmına eklemeniz gerekir. Sofra tuzunun özellikleri, klorür iyonuna kalitatif bir reaksiyondan oluşan anyonun özelliği ile de ilişkilidir. Çözeltideki gümüş nitrat ile etkileşime girdiğinde, beyaz bir gümüş klorür çökeltisi çökelir (fotoğraf). Hidrojen klorür, tuzdan hidroklorik asitten daha güçlü asitlerle yer değiştirir: 2NaCl + H2S04 = Na2S04 + 2HCl. Normal koşullar altında, sodyum klorür hidrolize uğramaz.
Kaya tuzunun uygulama alanları
Sodyum klorür buzun erime noktasını düşürür, bu nedenle kışın yollarda ve kaldırımlarda tuz ve kum karışımı kullanılır. Çözündüğünde nehirleri ve akarsuları kirletirken, büyük miktarda safsızlığı emer. Yol tuzu ayrıca araba gövdelerinin korozyon sürecini hızlandırır ve yol kenarlarına dikilen ağaçlara zarar verir. Kimya endüstrisinde, büyük bir kimyasal grubunun üretimi için hammadde olarak sodyum klorür kullanılır:
- hidroklorik asit;
- metalik sodyum;
- gaz klor;
- kostik soda ve diğer bileşikler.
Ayrıca sabun ve boya yapımında sofra tuzu kullanılmaktadır. Gıda antiseptiği olarak konserve, salamura mantar, balık ve sebzelerde kullanılır. Popülasyondaki tiroid bozukluklarıyla mücadele etmek için sofra tuzu formülü, örneğin KIO 3 , KI, NaI gibi güvenli iyot bileşikleri eklenerek zenginleştirilir. Bu tür takviyeler tiroid hormonu üretimini destekler, endemik guatr hastalığını önler.
İnsan vücudu için sodyum klorürün değeri

Sofra tuzunun formülü, bileşimi insan sağlığı için hayati hale geldi. Sodyum iyonları sinir uyarılarının iletilmesinde rol oynar. Midede hidroklorik asit üretimi için klor anyonları gereklidir. Ancak yiyeceklerde çok fazla tuz bulunması, yüksek tansiyona yol açabilir ve kalp ve damar hastalıklarına yakalanma riskini artırabilir. Tıpta, büyük bir kan kaybı olan hastalara fizyolojik salin enjekte edilir. Bunu elde etmek için 9 g sodyum klorür bir litre damıtılmış suda çözülür. İnsan vücudunun bu maddenin sürekli olarak gıda ile beslenmesine ihtiyacı vardır. Tuz, boşaltım organları ve deri yoluyla atılır. İnsan vücudundaki ortalama sodyum klorür içeriği yaklaşık 200 g'dır Avrupalılar günde yaklaşık 2-6 g sofra tuzu tüketir, sıcak ülkelerde bu rakam daha yüksek terleme nedeniyle daha yüksektir.
| katyonlar | anyonlar | |||||||||
| F- | Cl- | br- | BEN- | Ö2- | NUMARA 3 - | CO3 2- | SiO3 2- | SO 4 2- | PO 4 3- | |
| Na+ | R | R | R | R | R | R | R | R | R | R |
| B+ | R | R | R | R | R | R | R | R | R | R |
| NH4+ | R | R | R | R | R | R | R | R | R | R |
| Mg2+ | RK | R | R | R | M | R | H | RK | R | RK |
| Ca2+ | NK | R | R | R | M | R | H | RK | M | RK |
| Sr2+ | NK | R | R | R | R | R | H | RK | RK | RK |
| Ba 2+ | RK | R | R | R | R | R | H | RK | NK | RK |
| sn 2+ | R | R | R | M | RK | R | H | H | R | H |
| sayfa 2+ | H | M | M | M | RK | R | H | H | H | H |
| Al 3+ | M | R | R | R | G | R | G | NK | R | RK |
| Cr3+ | R | R | R | R | G | R | G | H | R | RK |
| Mn2+ | R | R | R | R | H | R | H | H | R | H |
| Fe2+ | M | R | R | R | H | R | H | H | R | H |
| Fe3+ | R | R | R | - | - | R | G | H | R | RK |
| Co2+ | M | R | R | R | H | R | H | H | R | H |
| Ni2+ | M | R | R | R | RK | R | H | H | R | H |
| Cu2+ | M | R | R | - | H | R | G | H | R | H |
| Zn2+ | M | R | R | R | RK | R | H | H | R | H |
| CD2+ | R | R | R | R | RK | R | H | H | R | H |
| Hg2+ | R | R | M | NK | NK | R | H | H | R | H |
| 2 2+ | R | NK | NK | NK | RK | R | H | H | M | H |
| Ag+ | R | NK | NK | NK | NK | R | H | H | M | H |
Efsane:
P - madde suda oldukça çözünür; M - az çözünür; H - pratik olarak suda çözünmez, ancak zayıf veya seyreltik asitlerde kolayca çözünür; RK - suda çözünmez ve sadece güçlü inorganik asitlerde çözünür; NK - ne suda ne de asitlerde çözünmez; G - çözünme üzerine tamamen hidrolize olur ve su ile temasta bulunmaz. Kısa çizgi, böyle bir maddenin hiç olmadığı anlamına gelir.
Sulu çözeltilerde, tuzlar tamamen veya kısmen iyonlara ayrışır. Zayıf asitlerin ve/veya zayıf bazların tuzları hidrolize uğrar. Sulu tuz çözeltileri, hidratlı iyonlar, iyon çiftleri ve hidroliz ürünleri vb. dahil olmak üzere daha karmaşık kimyasal formlar içerir. Bazı tuzlar ayrıca alkollerde, asetonda, asit amidlerde ve diğer organik çözücülerde çözünür.
Sulu çözeltilerden tuzlar, kristalli hidratlar biçiminde, sulu olmayan çözeltilerden - kristalli solvatlar biçiminde, örneğin CaBr2 3C2H5OH şeklinde kristalleşebilir.
Su-tuz sistemlerinde meydana gelen çeşitli işlemler, sıcaklık, basınç ve konsantrasyona bağlı olarak tuzların ortak mevcudiyetlerindeki çözünürlüğü, katı ve sıvı fazların bileşimi hakkında veriler, su-tuz sistemlerinin çözünürlük diyagramları incelenerek elde edilebilir.
Tuzların sentezi için genel yöntemler.
1. Orta tuzların elde edilmesi:
1) metal olmayan metal: 2Na + Cl 2 = 2NaCl
2) asitli metal: Zn + 2HCl = ZnCl2 + H2
3) daha az aktif bir metalin tuz çözeltisine sahip metal Fe + CuS04 = FeS04 + Cu
4) asit oksitli bazik oksit: MgO + CO2 = MgCO3
5) asitli bazik oksit CuO + H2S04 \u003d CuS04 + H20
6) asidik oksit Ba (OH) 2 + C02 = BaC03 + H20 içeren bazlar
7) asitli bazlar: Ca (OH) 2 + 2HCl \u003d CaCl2 + 2H20
8) asit tuzları: MgC03 + 2HCl = MgCl2 + H20 + CO2
BaCl2 + H2S04 \u003d BaSO4 + 2HCl
9) tuz çözeltisi içeren bir baz çözeltisi: Ba (OH) 2 + Na2S04 \u003d 2NaOH + BaS04
10) iki tuzun çözeltileri 3CaCl2 + 2Na3PO4 = Ca3(PO4)2+6NaCl
2. Asit tuzlarının elde edilmesi:
1. Bir asidin baz eksikliği ile etkileşimi. KOH + H2S04 \u003d KHSO4 + H20
2. Bir bazın fazla asit oksit ile etkileşimi
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Ortalama bir tuzun asit Ca3 (PO 4) 2 + 4H3 PO 4 \u003d 3Ca (H2P04) 2 ile etkileşimi
3. Temel tuzların elde edilmesi:
1. Zayıf baz ve kuvvetli asitten oluşan tuzların hidrolizi
ZnCl2 + H20 \u003d Cl + HCI
2. Orta metal tuzları AlCl 3 + 2NaOH = Cl + 2NaCl çözeltilerine küçük miktarlarda alkalilerin eklenmesi (damla damla)
3. Zayıf asit tuzlarının orta tuzlarla etkileşimi
2MgCl2 + 2Na2C03 + H20 \u003d 2 CO3 + CO2 + 4NaCl
4. Karmaşık tuzların elde edilmesi:
1. Tuzların ligandlarla reaksiyonları: AgCl + 2NH3 = Cl
FeCl3 + 6KCN] = K3 + 3KCI
5. Çift tuz elde etmek:
1. İki tuzun ortak kristalleşmesi:
Cr2 (S04) 3 + K2S04 + 24H20 \u003d 2 + NaCl
4. Katyon veya anyonun özelliklerinden kaynaklanan redoks reaksiyonları. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
2. Asit tuzlarının kimyasal özellikleri:
1. Orta tuz oluşumu ile termal ayrışma
Ca (HCO 3) 2 \u003d CaCO 3 + CO 2 + H 2 O
2. Alkali ile etkileşim. Orta tuz elde etmek.
Ba(HCO 3) 2 + Ba(OH) 2 = 2BaCO 3 + 2H 2 O
3. Bazik tuzların kimyasal özellikleri:
1. Termal ayrışma. 2 CO 3 \u003d 2CuO + CO 2 + H 2 O
2. Asit ile etkileşim: ortalama bir tuzun oluşumu.
Sn(OH)Cl + HCI = SnCl2 + H20
4. Karmaşık tuzların kimyasal özellikleri:
1. Az çözünen bileşiklerin oluşumu nedeniyle komplekslerin yok edilmesi:
2Cl + K2S \u003d CuS + 2KCl + 4NH3
2. Dış ve iç küreler arasında ligand değişimi.
K2 + 6H2O \u003d Cl2 + 2KCl
5. Çift tuzların kimyasal özellikleri:
1. Alkali çözeltilerle etkileşim: KCr(SO 4) 2 + 3KOH = Cr(OH) 3 + 2K 2 SO 4
2. Geri kazanım: KCr (S04) 2 + 2H ° (Zn, seyreltilmiş H2S04) \u003d 2CrS04 + H2S04 + K2S04
Bir dizi klorür tuzları, sülfatlar, karbonatlar, Na, K, Ca, Mg boratların endüstriyel üretimi için hammaddeler, deniz ve okyanus suyu, buharlaşması sırasında oluşan doğal tuzlu sular ve katı tuz birikintileridir. Sedimanter tuz birikintilerini (Na, K ve Mg'nin sülfatları ve klorürleri) oluşturan bir grup mineral için “doğal tuzlar” kod adı kullanılır. En büyük potasyum tuzları yatakları Rusya (Solikamsk), Kanada ve Almanya'da, güçlü fosfat cevheri yatakları - Kuzey Afrika, Rusya ve Kazakistan'da, NaNO3 - Şili'de bulunmaktadır.
Tuzlar gıda, kimya, metalürji, cam, deri, tekstil sanayi, tarım, ilaç vb. alanlarda kullanılmaktadır.
Başlıca tuz türleri
1. Boratlar (oksoboratlar), borik asit tuzları: metaborik HBO2, ortoborik H3BO3 ve serbest halde izole edilmemiş poliborik asitler. Moleküldeki bor atomlarının sayısına göre mono-, di, tetra-, hekzaboratlar vb. 1 mol bazik oksit başına. Bu nedenle, bir anyon B (OH) 4 veya bir zincir anyonu (BO 2) içeriyorlarsa, çeşitli metaboratlara monoboratlar denilebilir. n n - diboratlar - eğer bir zincir çift anyonu içeriyorlarsa (B 2 O 3 (OH) 2) n 2n- triboratlar - halka anyonu içeriyorsa (B 3 O 6) 3-.
Boratların yapıları, boron-oksijen gruplarını içerir - 1 ila 6 ve bazen 9 bor atomu içeren "bloklar", örneğin:
Bor atomlarının koordinasyon sayısı 3 (bor-oksijen üçgen grupları) veya 4'tür (dörtyüzlü gruplar). Bor-oksijen grupları sadece adanın değil, aynı zamanda daha karmaşık yapıların - zincir, katmanlı ve çerçeve polimerize edilmiş - temelidir. İkincisi, hidratlı boratların moleküllerindeki suyun ortadan kaldırılması ve oksijen atomları aracılığıyla köprü bağlarının ortaya çıkması sonucu oluşur; sürece bazen polianyonlar içindeki B-O bağının kırılması eşlik eder. Polianyonlar yan gruplar ekleyebilir - bor-oksijen tetrahedra veya üçgenler, bunların dimerleri veya yabancı anyonlar.
+1 oksidasyon durumundaki amonyum, alkali ve diğer metaller çoğunlukla MBO 2 tipi hidratlı ve susuz metaboratlar, M2B407 tetraboratlar, MB508 pentaboratlar ve ayrıca M4B10O17 oluşturur. dekaborat N H 2 O. Alkali toprak ve + 2 oksidasyon durumundaki diğer metaller genellikle hidratlı metaboratlar, M 2 B 6 O 11 triboratlar ve MB 6 O 10 hekzaboratlar verir. yanı sıra susuz meta-, orto- ve tetraboratlar. +3 oksidasyon durumundaki metaller, hidratlı ve susuz MBO 3 ortoboratları ile karakterize edilir.
Boratlar renksiz amorf maddeler veya kristallerdir (esas olarak düşük simetrik yapıya sahip - monoklinik veya eşkenar dörtgen). Susuz boratlar için erime noktaları 500 ila 2000 °C aralığındadır; en yüksek erime noktasına sahip metaboratlar, alkali ve toprak alkali metallerin orto- ve metaboratlarıdır. Çoğu borat, eriyikleri soğutulduğunda kolayca cam oluşturur. Hidratlı boratların Mohs ölçeğindeki sertliği 2-5, susuz - 9'a kadar.
Hidratlanmış monoboratlar ~180°C'ye kadar kristalleşme suyunu kaybeder, poliboratlar - 300-500°C'de; OH grupları nedeniyle suyun ortadan kaldırılması , bor atomları etrafında koordineli olarak ~750°C'ye kadar oluşur. Tam dehidrasyonla, çoğu durumda 500-800 ° C'de “borat yeniden düzenlemesine” maruz kalan amorf maddeler oluşur - kristalleşme, (poliboratlar için) B203'ün salınmasıyla kısmi ayrışma ile birlikte.
Alkali metal, amonyum ve T1(I) boratlar suda çözünür (özellikle meta- ve pentaboratlar), sulu çözeltilerde hidrolize olur (çözeltiler alkali reaksiyona sahiptir). Boratların çoğu asitler tarafından, bazı durumlarda C02'nin etkisiyle kolayca ayrıştırılır; ve SO2;. Alkali toprak boratları ve ağır metaller, alkali metallerin alkali, karbonat ve bikarbonat çözeltileri ile etkileşime girer. Susuz boratlar, hidratlı boratlardan kimyasal olarak daha kararlıdır. Bazı alkollerle, özellikle gliserolle, boratlar suda çözünür kompleksler oluşturur. Güçlü oksitleyici ajanların, özellikle H202'nin etkisi altında veya elektrokimyasal oksidasyon sırasında boratlar, peroksoboratlara dönüştürülür. .
Başlıca Na, Mg, Ca, Fe tuzları olan yaklaşık 100 doğal borat bilinmektedir.
Hidratlı boratlar şu şekilde elde edilir: H3BO3'ün metal oksitler, hidroksitler veya karbonatlar ile nötrleştirilmesi; alkali metal boratların, çoğunlukla Na'nın diğer metallerin tuzlarıyla değişim reaksiyonları; az çözünür boratların alkali metal boratların sulu çözeltileri ile karşılıklı dönüşümünün reaksiyonu; mineralleştirici katkı maddeleri olarak alkali metal halojenürlerin kullanıldığı hidrotermal prosesler. Susuz boratlar, B203'ün metal oksitler veya karbonatlar ile füzyonu veya sinterlenmesi veya hidratların dehidrasyonu ile elde edilir; tek kristaller, örneğin Bi203 gibi erimiş oksitlerdeki borat çözeltilerinde büyütülür.
Boratlar: diğer bor bileşiklerini elde etmek için; cam, sır, emaye, seramik üretiminde ücretin bileşenleri olarak; yangına dayanıklı kaplamalar ve emprenyeler için; metalin rafine edilmesi, kaynaklanması ve lehimlenmesi için eritkenlerin bileşenleri olarak”; boya ve verniklerin pigmentleri ve dolgu maddeleri olarak; boyamada mordan olarak, korozyon inhibitörleri, elektrolit bileşenleri, fosforlar vb. Boraks ve kalsiyum boratlar en yaygın şekilde kullanılır.
2. Halojenler, diğer elementlerle halojenlerin kimyasal bileşikleri. Halojenürler genellikle halojen atomlarının başka bir elementten daha yüksek elektronegatifliğe sahip olduğu bileşikleri içerir. Halojenürler He, Ne ve Ar'ı oluşturmaz. Basit veya ikili halojenürlere EX N (N- çoğunlukla monohalidler için 1'den IF 7 ve ReF 7 için 7'ye kadar bir tamsayı, ancak kesirli de olabilir, örneğin Bi 6 Cl 7 için 7/6), özellikle hidrohalik asitlerin tuzlarını ve interhalojen bileşikleri (için örneğin haloflorürler). Ayrıca karışık halidler, polihalidler, hidrohalidler, oksohalidler, oksihalidler, hidroksohalidler, tiyohalidler ve kompleks halojenürler de vardır. Halojenlerin halojenürlerdeki oksidasyon durumu genellikle -1'dir.
Element-halojen bağının doğasına göre, basit halojenürler iyonik ve kovalent olarak ayrılır. Gerçekte, ilişkiler, bir veya başka bir bileşenin katkısının baskın olduğu karışık bir yapıya sahiptir. Alkali ve toprak alkali metallerin halojenürleri ve diğer metallerin birçok mono- ve dihalidleri, bağın iyonik doğasının hakim olduğu tipik tuzlardır. Çoğu nispeten refrakter, düşük uçucu, suda yüksek oranda çözünür; sulu çözeltilerde neredeyse tamamen iyonlara ayrışırlar. Nadir toprak elementlerinin trihalidleri de tuzların özelliklerine sahiptir. İyonik halojenürlerin suda çözünürlüğü genellikle iyodürlerden florürlere doğru azalır. Klorürler, bromürler ve iyodürler Ag+ , Сu+ , Hg+ ve Pb2+ suda az çözünür.
Metal halojenürlerdeki halojen atomlarının sayısındaki veya metal yükünün iyonunun yarıçapına oranındaki bir artış, bağın kovalent bileşeninde bir artışa, halojenürlerin sudaki çözünürlüğünde ve termal kararlılığında bir azalmaya, bir artışa yol açar. uçuculukta, oksidasyonda artış, hidroliz yeteneği ve eğilimi. Bu bağımlılıklar, aynı dönemdeki metal halojenürler için ve aynı metalin halojenür serilerinde gözlenir. Termal özellikler örneğinde izlenmesi kolaydır. Örneğin, 4. periyottaki metal halojenürler için erime ve kaynama noktaları sırasıyla KC1 için 771 ve 1430°C, CaCl2 için 772 ve 1960°C, ScCl3 için 967 ve 975°C, -24.1 ve 136°C'dir. TiCl4 için. UF 3 için erime noktası ~1500°C, UF 4 1036°C, UF 5 348°C, UF 6 64,0°C'dir. EC bileşikleri serisinde N aynı ile N bağın kovalentliği genellikle florürlerden klorürlere geçerken artar ve ikincisinden bromürlere ve iyodürlere geçerken azalır. Yani AlF 3 için süblimasyon sıcaklığı 1280°C, A1C13 180°C, A1Br3'ün kaynama noktası 254.8°C, AlI3 407°C'dir. ZrF4 , ZrCl4 ZrBr4 , ZrI4 serilerinde süblimleşme sıcaklığı sırasıyla 906, 334, 355 ve 418°C'dir. MF saflarında N ve MS1 N burada M bir alt grubun metalidir, bağın kovalentliği metalin artan atomik kütlesi ile azalır. İyonik ve kovalent bağ bileşenlerinin yaklaşık olarak aynı katkısına sahip birkaç metal florür ve klorür vardır.
Ortalama element-halojen bağ enerjisi, florürlerden iyodüre geçerken ve arttıkça azalır. N(bkz. tablo).
İzole edilmiş veya köprü oluşturan O atomları (sırasıyla okso- ve oksihalidler) içeren birçok metal halojenür, örneğin vanadyum oksotriflorür VOF 3, niyobyum dioksiflorür Nb02F, tungsten dioksodiiyodür WO 2 I 2.
Kompleks halojenürler (halojenometalatlar), halojen atomlarının ligand olduğu kompleks anyonları içerir, örneğin potasyum hekzakloroplatinat (IV) K2 , sodyum heptaflorotantalat (V) Na, lityum hekzafloroarsenat (V) Li. Floro-, oksofloro- ve klorometalatlar en yüksek termal stabiliteye sahiptir. Bağların doğası gereği, NF 4 + , N 2 F 3 + , C1F 2 + , XeF + ve diğerleri katyonlarına sahip iyonik bileşikler, karmaşık halojenürlere yakındır.
Birçok halojenür, köprü bağlarının oluşumu ile sıvı ve gaz fazlarında birleşme ve polimerizasyon ile karakterize edilir. Buna en yatkın olanlar, grup I ve II metallerinin halojenürleri, AlCl3 , Sb'nin pentaflorürleri ve geçiş metalleri, MOF4 bileşiminin oksoflorürleridir. Örneğin metal-metal halojenürler bilinmektedir. Cl-Hg-Hg-Cl.
Florürler, özellikleri bakımından diğer halojenürlerden önemli ölçüde farklıdır. Bununla birlikte, basit halojenürlerde bu farklılıklar halojenlerin kendilerinden daha az belirgindir ve karmaşık halojenürlerde basit olanlardan daha az belirgindir.
Birçok kovalent halojenür (özellikle florürler) güçlü Lewis asitleridir, örn. AsF5, SbF5, BF3, A1C13. Florürler süper asitlerin bir parçasıdır. Daha yüksek halojenürler metaller ve hidrojen tarafından indirgenir, örneğin:
5WF 6 + W = 6WF 5
TiCl4 + 2Mg \u003d Ti + 2MgCl2
UF 6 + H 2 \u003d UF 4 + 2HF
Cr ve Mn hariç, V-VIII gruplarının metal halojenürleri H2 ile metallere indirgenir, örneğin:
WF 6 + ZN 2 = W + 6HF
Pek çok kovalent ve iyonik metal halojenür, örneğin karmaşık halojenürler oluşturmak için birbirleriyle etkileşime girer:
KC1 + TaCl 5 = K
Daha hafif halojenler, daha ağır olanları halojenürlerden uzaklaştırabilir. Oksijen, C12, Br2 ve I2'nin salınmasıyla halojenürleri okside edebilir. Kovalent halojenürlerin karakteristik reaksiyonlarından biri, su (hidroliz) veya ısıtıldığında buharları (pirohidroliz) ile etkileşimidir ve oksitlerin, oksi- veya okso halojenürlerin, hidroksitlerin ve hidrojen halojenürlerin oluşumuna yol açar.
Halojenürler, hidrojen halojenürlerin veya hidrohalik asitlerin elementler, oksitler, hidroksitler veya tuzlarla etkileşiminin yanı sıra değişim reaksiyonlarıyla doğrudan elementlerden elde edilir.
Halojenürler, mühendislikte halojenlerin, alkali ve toprak alkali metallerin üretimi için başlangıç malzemeleri olarak ve camların ve diğer inorganik malzemelerin bileşenleri olarak yaygın şekilde kullanılır; nadir ve bazı demir dışı metallerin, U, Si, Ge vb. üretiminde ara ürünlerdir.
Doğada halojenürler, florürleri (örn. florit, kriyolit mineralleri) ve klorürleri (sylvite, carnallite) içeren ayrı mineral sınıfları oluşturur. Brom ve iyot, bazı minerallerde izomorfik safsızlıklar olarak bulunur. Denizlerin ve okyanusların sularında, tuzlu ve yer altı tuzlu sularında önemli miktarda halojenür bulunur. NaCl, KC1, CaCl2 gibi bazı halojenürler canlı organizmaların bir parçasıdır.
3. Karbonatlar (lat. carbo'dan, case carbonis kömür cinsinden), karbonik asit tuzları. CO 3 2- anyonlu ve asidik orta karbonatlar veya HCO 3 - anyonlu bikarbonatlar (eski bikarbonatlar) vardır. Karbonatlar kristal maddelerdir. +2 oksidasyon durumundaki orta metal tuzlarının çoğu bir altıgen şeklinde kristalleşir. kafes tipi kalsit veya eşkenar dörtgen tipi aragonit.
Orta karbonatlardan sadece alkali metal tuzları, amonyum ve Tl(I) suda çözünür. Önemli hidrolizin bir sonucu olarak, çözeltileri alkali bir reaksiyona sahiptir. Oksidasyon durumunda en zor çözünen metal karbonatlar + 2. Aksine, tüm bikarbonatlar suda yüksek oranda çözünür. Sulu çözeltilerde metal tuzları ve Na2C03 arasındaki değişim reaksiyonları sırasında, çözünürlükleri karşılık gelen hidroksitlerinkinden çok daha düşük olduğunda orta karbonat çökeltileri oluşur. Ca, Sr ve analogları, lantanitler, Ag(I), Mn(II), Pb(II) ve Cd(II) için durum budur. Kalan katyonlar, hidrolizin bir sonucu olarak çözünmüş karbonatlarla etkileşime girdiklerinde ortalama değil, bazik karbonatlar ve hatta hidroksitler verebilir. Çoklu yüklü katyonlar içeren orta karbonatlar bazen büyük miktarda CO2 varlığında sulu çözeltilerden çökelebilir.
Karbonatların kimyasal özellikleri, zayıf asitlerin inorganik tuzları sınıfına ait olmalarından kaynaklanmaktadır. Karbonatların karakteristik özellikleri, zayıf çözünürlükleri ve ayrıca hem krabonatların kendilerinin hem de H2C03'ün termal kararsızlığı ile ilişkilidir. Bu özellikler, ya güçlü asitler tarafından ayrışmalarına ve bu durumda bir alkali çözelti tarafından salınan CO2'nin kantitatif absorpsiyonuna ya da çözeltiden CO32- iyonunun çökelmesine dayalı olarak crabonatların analizinde kullanılır. ВаСО formu 3 . Bir çözeltideki ortalama bir karbonatın çökeltisi üzerindeki fazla CO2'nin etkisi altında, bir bikarbonat oluşur, örneğin: CaC03 + H20 + CO2 \u003d Ca (HCO3) 2. Doğal sudaki bikarbonatların varlığı, geçici sertliğini belirler. Zaten düşük sıcaklıklarda hafif ısıtma üzerine hidrokarbonatlar, ısıtıldığında oksit ve C02'ye ayrışan orta karbonatlara tekrar dönüştürülür. Metal ne kadar aktifse, karbonatın ayrışma sıcaklığı o kadar yüksek olur. Böylece Na 2 CO 3 857 °C'de ayrışmadan erir ve Ca, Mg ve Al karbonatlar için sırasıyla 820, 350 ve 100 °C sıcaklıklarda denge bozunma basınçları 0,1 MPa'ya ulaşır.
CO 2 ve H 2 O'nun mineral oluşum süreçlerine katılımı nedeniyle karbonatlar doğada çok yaygındır. karbonatlar, atmosferdeki gaz halindeki CO2 ile çözünmüş CO2 arasındaki küresel dengelerde büyük bir rol oynar;
ve hidrosferdeki HCO 3 - ve CO 3 2- iyonları ve litosferdeki katı tuzlar. En önemli mineraller CaCO 3 kalsit, MgCO 3 manyezit, FeCO 3 siderit, ZnCO 3 smithsonit ve diğerleridir.Kireçtaşı esas olarak kalsit veya kalsit organizmaların iskelet kalıntılarından, nadiren aragonitten oluşur. Alkali metallerin ve Mg'nin doğal hidratlı karbonatları da bilinmektedir (örneğin, MgC03ZH20, Na2C0310H20), çift karbonatlar [örneğin, dolomit CaMg (C03)2, taht Na2C03NaHCO 3 2H 2 O] ve bazik [malahit CuCO 3 Cu(OH) 2, hidroserussit 2РbСО 3 Pb(OH) 2].
En önemlileri potasyum karbonat, kalsiyum karbonat ve sodyum karbonattır. Birçok doğal karbonat çok değerli metal cevherleridir (örneğin Zn, Fe, Mn, Pb, Cu karbonatları). Bikarbonatlar, kan pH'ının sabitliğini düzenleyen tampon maddeler olarak önemli bir fizyolojik rol oynarlar.
4. Nitratlar, nitrik asit HNO 3 tuzları. Hemen hemen tüm metallerle tanınan; her ikisi de susuz tuzlar M (NO 3) formunda bulunur N (N- M metalinin oksidasyon derecesi) ve kristal hidratlar M (NO 3) formunda N X H 2 O ( X= 1-9). Oda sıcaklığına yakın bir sıcaklıktaki sulu çözeltilerden, yalnızca alkali metal nitratlar susuz olarak kristalleşir, geri kalanı - kristalli hidratlar şeklinde. Aynı metalin susuz ve hidratlı nitratının fizikokimyasal özellikleri çok farklı olabilir.
D-element nitratların susuz kristalli bileşikleri renklidir. Geleneksel olarak nitratlar, ağırlıklı olarak kovalent tipte bir bağa (Be, Cr, Zn, Fe ve diğer geçiş metallerinin tuzları) ve ağırlıklı olarak iyonik tipte bir bağa (alkali ve toprak alkali metallerin tuzları) sahip bileşiklere ayrılabilir. İyonik nitratlar, daha yüksek termal kararlılık, daha yüksek simetriye (kübik) sahip kristal yapıların baskınlığı ve IR spektrumlarında nitrat iyon bantlarının bölünmesinin olmaması ile karakterize edilir. Kovalent nitratlar, organik çözücülerde daha yüksek çözünürlüğe, daha düşük termal kararlılığa sahiptir, IR spektrumları daha karmaşıktır; bazı kovalent nitratlar oda sıcaklığında uçucudur ve suda çözündüklerinde nitrojen oksitlerin salınmasıyla kısmen ayrışırlar.
Tüm susuz nitratlar, NO 3 - iyonunun varlığından dolayı güçlü oksitleyici özellikler gösterirken, iyonik nitratlardan kovalent nitratlara geçerken oksitleme yetenekleri artar. İkincisi 100-300°C aralığında, iyonik - 400-600°C'de ayrışır (NaNO 3 , KNO 3 ve diğerleri ısıtıldığında erir). Katı ve sıvı fazlarda bozunma ürünleri. sırayla nitritler, oksonitratlar ve oksitler, bazen - serbest metaller (oksit kararsız olduğunda, örneğin Ag20) ve gaz fazında - NO, NO2, O2 ve N2. Ayrışma ürünlerinin bileşimi, metalin doğasına ve oksidasyon derecesine, ısıtma hızına, sıcaklığa, gazlı ortamın bileşimine ve diğer koşullara bağlıdır. NH4NO3 patlar ve hızlı ısıtıldığında patlayarak ayrışabilir, bu durumda N2 , O2 ve H20 oluşur; yavaş ısıtıldığında N 2 O ve H 2 O'ya ayrışır.
Gaz fazındaki serbest NO 3 - iyonu, merkezinde bir N atomu, ONO açıları ~ 120° ve N-O bağ uzunlukları 0,121 nm olan bir eşkenar üçgenin geometrik yapısına sahiptir. Kristal ve gaz halindeki nitratlarda, NO 3 iyonu - temel olarak nitratların alanını ve yapısını belirleyen şeklini ve boyutunu korur. İyon NO 3 - bir mono-, bi-, tridentat veya köprü ligandı olarak işlev görebilir, bu nedenle nitratlar çok çeşitli kristal yapı tipleri ile karakterize edilir.
Sterik nedeniyle yüksek oksidasyon durumlarında geçiş metalleri. zorluklar susuz nitratlar oluşturamaz ve örneğin UO 2 (NO 3) 2, NbO (NO 3) 3 gibi oksonitratlarla karakterize edilirler. Nitratlar, iç kürede NO 3 iyonu ile çok sayıda çift ve kompleks tuz oluşturur. Sulu ortamda, hidrolizin bir sonucu olarak geçiş metali katyonları, katı halde de izole edilebilen değişken bileşimli hidroksonitratlar (temel nitratlar) oluşturur.
Hidratlı nitratlar, kristal yapılarında susuz olanlardan farklıdır, metal iyonu çoğu durumda NO3 iyonu ile değil, su molekülleri ile ilişkilidir. Bu nedenle, sudaki susuz nitratlardan daha iyi çözünürler, ancak daha kötüsü - organik çözücülerde, daha zayıf oksitleyici maddeler, 25-100°C aralığında kristalizasyon suyunda uyumsuz bir şekilde erir. Hidratlı nitratlar ısıtıldığında, kural olarak, susuz nitratlar oluşmaz, ancak hidroksonitratların ve ardından oksonitratların ve metal oksitlerin oluşumu ile termoliz meydana gelir.
Nitratlar, kimyasal özelliklerinin çoğunda diğer inorganik tuzlara benzer. Nitratların karakteristik özellikleri, suda çok yüksek çözünürlükleri, düşük termal kararlılıkları ve organik ve inorganik bileşikleri oksitleme yeteneklerinden kaynaklanmaktadır. Nitratların indirgenmesi sırasında, indirgeyici maddenin tipine, sıcaklığa, ortamın reaksiyonuna bağlı olarak nitrojen içeren ürünlerden NO 2 , NO, N20, N2 veya NH3 karışımı oluşur. ve diğer faktörler.
Nitrat elde etmeye yönelik endüstriyel yöntemler, NH3'ün HNO3 çözeltileri (NH4NO3 için) tarafından emilmesine veya nitröz gazların (NO + NO2) alkali veya karbonat çözeltileri (alkali metal nitratlar, Ca için) tarafından emilmesine dayanır. Mg, Ba), ayrıca metal tuzlarının HNO3 veya alkali metal nitratlarla çeşitli değişim reaksiyonlarında. Laboratuvarda susuz nitrat elde etmek için geçiş metallerinin veya bileşiklerinin sıvı N204 ile reaksiyonları ve bunun organik çözücülerle karışımları veya N205 ile reaksiyonları kullanılır.
Nitratlar Na, K (sodyum ve potasyum nitrat) doğal birikintiler halinde bulunur.
Nitratlar birçok endüstride kullanılmaktadır. Amonyum nitrit (amonyum nitrat) - azot içeren ana gübre; Alkali metallerin nitratları ve Ca da gübre olarak kullanılır. Nitratlar - roket yakıtlarının bileşenleri, piroteknik bileşimler, kumaşları boyamak için dekapaj çözeltileri; metalleri sertleştirmek, gıdaları korumak, ilaç olarak ve metal oksit üretimi için kullanılırlar.
Nitratlar zehirlidir. Akciğer ödemi, öksürük, kusma, akut kardiyovasküler yetmezlik vb. Neden olurlar. Nitratların insanlar için öldürücü dozu 8-15 g, izin verilen günlük alım miktarı 5 mg / kg'dır. Na, K, Ca, NH3 nitrat MPC toplamı için: suda 45 mg/l", toprakta 130 mg/kg (tehlike sınıfı 3); sebze ve meyvelerde (mg/kg) - patates 250, geç beyaz lahana 500, geç havuç 250, pancar 1400, soğan 80, kabak 400, kavun 90, karpuz, üzüm, elma, armut 60. Agroteknik tavsiyelere uyulmaması, aşırı gübreleme tarım ürünlerindeki nitrat içeriğini önemli ölçüde artırır, tarlalardan yüzey akışı ( 40-5500 mg/l), yer altı suyu.
5. Nitritler, nitröz asit HNO 2 tuzları. Her şeyden önce, alkali metallerin ve amonyumun nitritleri kullanılır, daha az - toprak alkali ve Z D-metaller, Pb ve Ag. Diğer metallerin nitritleri hakkında sadece parçalı bilgiler vardır.
+2 oksidasyon durumundaki metal nitritler, bir, iki veya dört su molekülü ile kristal hidratlar oluşturur. Nitritler, örneğin ikili ve üçlü tuzlar oluşturur. CsNO 2 AgNO 2 veya Ba (NO 2) 2 Ni (NO 2) 2 2KNO 2 ve ayrıca Na3 gibi kompleks bileşikler.
Kristal yapılar sadece birkaç susuz nitrit için bilinir. NO2 anyonunun doğrusal olmayan bir konfigürasyonu vardır; ONO açısı 115°, H-O bağ uzunluğu 0,115 nm; M-NO 2 bağlantı tipi iyonik-kovalenttir.
K, Na, Ba nitritler suda iyi çözünür, Ag, Hg, Cu nitritler az çözünür. Artan sıcaklıkla nitritlerin çözünürlüğü artar. Hemen hemen tüm nitritler alkollerde, eterlerde ve düşük polariteli çözücülerde az çözünür.
Nitritler termal olarak kararsızdır; sadece alkali metallerin nitritlerini bozunmadan eritin, diğer metallerin nitritlerini 25-300 °C'de bozunur. Nitrit ayrışma mekanizması karmaşıktır ve bir dizi paralel ardışık reaksiyon içerir. Ana gaz bozunma ürünleri NO, NO 2, N 2 ve O 2'dir, katı olanlar metal oksit veya elemental metaldir. Büyük miktarda gazın salınması, bazı nitritlerin, örneğin N2 ve H20'ye ayrışan NH4NO2 gibi patlayıcı ayrışmasına neden olur.
Nitritlerin karakteristik özellikleri, termal kararsızlıkları ve nitrit iyonunun ortama ve reaktiflerin doğasına bağlı olarak hem bir oksitleyici ajan hem de bir indirgeyici ajan olma yeteneği ile ilişkilidir. Nötr bir ortamda, nitritler genellikle NO'ya indirgenir, asidik bir ortamda nitratlara oksitlenirler. Oksijen ve C02, katı nitritler ve bunların sulu çözeltileri ile etkileşime girmez. Nitritler, nitrojen içeren organik maddelerin, özellikle aminler, amidler vb.nin ayrışmasına katkıda bulunur. Organik halojenürler RXH ile. hem RONO nitritleri hem de RNO 2 nitro bileşiklerini oluşturmak için reaksiyona girer.
Nitritlerin endüstriyel üretimi, nitröz gazının (bir NO + N02 karışımı) Na2C03 veya NaOH çözeltileri ile NaN02'nin art arda kristalleştirilmesiyle emilmesine dayanır; endüstride ve laboratuvarlarda diğer metallerin nitritleri, metal tuzlarının NaNO2 ile değişim reaksiyonuyla veya bu metallerin nitratlarının indirgenmesiyle elde edilir.
Nitritler, azo boyalarının sentezinde, kaprolaktam üretiminde, oksitleyici ve indirgeyici maddeler olarak kauçuk, tekstil ve metal işleme endüstrilerinde, gıda koruyucu olarak kullanılır. NaNO 2 ve KNO 2 gibi nitritler toksiktir, baş ağrısına, kusmaya, solunum depresyonuna vb. neden olur. NaNO 2 zehirlendiğinde kanda methemoglobin oluşur, eritrosit zarları zarar görür. Belki de doğrudan gastrointestinal sistemde NaNO 2 ve aminlerden nitrozamin oluşumu.
6. Sülfatlar, sülfürik asit tuzları. S042- anyonuna sahip orta sülfatlar, bilinen, asidik veya hidrosülfatlardır, HSO4- , bazik, anyonla birlikte S042- - OH grupları, örneğin Zn2(OH)2S04 içeren hidrosülfatlardır. İki farklı katyon içeren çift sülfatlar da vardır. Bunlar iki büyük sülfat grubunu içerir. - şap , yanı sıra şenitler M 2 E (S0 4) 2 6H 2 O , burada M, tek yüklü bir katyondur, E, Mg, Zn ve diğer çift yüklü katyonlardır. Bilinen üçlü sülfat K 2 SO 4 MgSO 4 2CaSO 4 2H 2 O (mineral polihalit), çift bazik sülfatlar, örneğin alünit ve jarosit gruplarının mineralleri M 2 SO 4 Al 2 (SO 4) 3 4Al (OH 3 ve M) 2 SO 4 Fe 2 (SO 4) 3 4Fe(OH) 3, burada M tek yüklü bir katyondur Sülfatlar karışık tuzların bir parçası olabilir, örneğin 2Na 2 SO 4 Na 2 CO 3 (mineral berkit), MgS04 KCl 3H 2 O (kainit) .
Sülfatlar, orta ve asidik kristalli maddelerdir, çoğu durumda suda yüksek oranda çözünürler. Kalsiyum, stronsiyum, kurşun ve diğer bazılarının az çözünür sülfatları, pratik olarak çözünmez BaS04 , RaS04 . Bazik sülfatlar genellikle idareli bir şekilde çözünür veya pratik olarak çözünmez veya su ile hidrolize edilir. Sülfatlar, sulu çözeltilerden kristalli hidratlar şeklinde kristalleşebilir. Bazı ağır metallerin kristal hidratlarına vitriol denir; bakır sülfat СuSO 4 5H 2 O, demir sülfat FeSO 4 7H 2 O.
Orta alkali metal sülfatlar termal olarak kararlıdır, asit sülfatlar ısıtıldığında ayrışır ve pirosülfatlara dönüşür: 2KHSO 4 \u003d H2O + K2S207. Diğer metallerin ortalama sülfatları ve ayrıca bazik sülfatlar, yeterince yüksek sıcaklıklara ısıtıldığında, kural olarak, metal oksitlerin oluşumu ve S03'ün salınması ile ayrışır.
Sülfatlar doğada yaygın olarak dağılmıştır. Alçı CaSO 4 H 2 O, mirabilit Na 2 SO 4 10H 2 O gibi mineraller şeklinde bulunurlar ve ayrıca deniz ve nehir suyunun bir parçasıdırlar.
Birçok sülfat, H2S04'ün metaller, bunların oksitleri ve hidroksitleri ile etkileşimi ve ayrıca uçucu asit tuzlarının sülfürik asit ile ayrışmasıyla elde edilebilir.
İnorganik sülfatlar yaygın olarak kullanılmaktadır. Örneğin, amonyum sülfat bir azotlu gübredir, sodyum sülfat cam, kağıt sanayi, viskon üretimi vb.
7.sülfitler, sülfürik asit H 2 S03 tuzları . S03 2- anyonuna sahip orta sülfitler ve HSO 3 - anyonuna sahip asidik (hidrosülfitler) vardır. . Orta sülfitler kristal maddelerdir. Amonyum ve alkali metal sülfitler suda oldukça çözünür; çözünürlük (100 g'da g): (NH 4) 2 S03 40.0 (13°C), K2S03 106.7 (20°C). Sulu çözeltilerde hidrosülfitler oluştururlar. Alkali toprağın sülfitleri ve diğer bazı metaller pratik olarak suda çözünmez; 100 g'da (40°C) MgS03 1 g çözünürlüğü. Bilinen kristal hidratlar (NH4)2S03H20, Na2S037H20, K2S032H20, MgS036H20, vb.
Susuz sülfitler, sızdırmaz kaplarda havaya erişim olmadan ısıtıldıklarında orantısız olarak sülfitlere ve sülfatlara dönüşürler, bir N2 akışında ısıtıldıklarında S02 kaybederler ve havada ısıtıldıklarında kolayca sülfatlara oksitlenirler. Su ortamındaki SO2 ile orta sülfitler hidrosülfitler oluşturur. Sülfitler nispeten güçlü indirgeyici ajanlardır; klor, brom, H 2 O 2 vb. ile çözeltilerde sülfatlara oksitlenirler. S02'nin salınmasıyla güçlü asitler (örneğin, HC1) tarafından ayrıştırılırlar.
Kristalin hidrosülfitler K, Rb, Cs, NH4+ olarak bilinirler, kararsızdırlar. Diğer hidrosülfitler yalnızca sulu çözeltilerde bulunur. Yoğunluk NH4HS03 2.03 g/cm3 ; suda çözünürlük (100 g'da g): NH 4 HSO 3 71.8 (0°C), KHSO 3 49 (20°C).
Kristalin hidrosülfitler Na veya K ısıtıldığında veya M2S03 hamurunun bulamaç çözeltisi S02 ile doyurulduğunda, pirosülfitler (eski - metabisülfitler) M2S205 oluşur - serbest ortamda bilinmeyen pirosülfürik asit tuzları durum H2S205; kristaller, kararsız; yoğunluk (g / cm3): Na2S205 1.48, K2S205 2.34; ~ 160 °С'nin üzerinde SO2'nin salınmasıyla ayrışırlar; suda çözün (HS03-'e ayrışma ile), çözünürlük (100 g'da g): Na2S205 64.4, K2S205 44.7; hidratlar Na2S2057H20 ve ZK2S2052H20 oluşturur; indirgeyici ajanlar.
Orta alkali metal sülfitler, sulu bir M2C03 (veya MOH) çözeltisinin S02 ve MS03 ile S02'nin sulu bir MCO3 süspansiyonundan geçirilmesiyle reaksiyona sokulmasıyla elde edilir; esas olarak SO 2, kontakt sülfürik asit üretiminin çıkış gazlarından kullanılır. Sülfitler kumaşların, liflerin, tahıl muhafaza amaçlı derilerin, yeşil yemlerin, endüstriyel yem atıklarının (NaHSO 3 ,
Na2S205). CaSO 3 ve Ca(HSO 3) 2 - şarapçılık ve şeker endüstrisindeki dezenfektanlar. NaНS03 , MgS03 , NH4 НSO3 - hamurlaştırma sırasında sülfit sıvısının bileşenleri; (NH 4) 2 S03 - S02 emici; NaHSO 3, kükürt boyalarının üretiminde indirgeyici bir madde olan, üretim atık gazlarından kaynaklanan bir H2S emicidir. K 2 S 2 O 5 - fotoğrafçılıkta asit sabitleyicilerin bileşeni, antioksidan, antiseptik.
Karışım ayırma yöntemleri
Filtreleme, homojen olmayan sistemlerin sıvı - katı parçacıklar (süspansiyonlar) ve gaz - katı parçacıkların sıvı veya gazın geçmesine izin veren ancak katı parçacıkları tutan gözenekli filtre bölmeleri (FP) kullanılarak ayrılması. Sürecin itici gücü, FP'nin her iki tarafındaki basınç farkıdır.
Süspansiyonları ayırırken, katı parçacıklar genellikle FP üzerinde, gerekirse su veya başka bir sıvı ile yıkanan ve ayrıca içinden hava veya başka bir gaz üflenerek kurutulan bir ıslak tortu tabakası oluşturur. Filtreleme, sabit bir basınç farkında veya sabit bir işlem hızında gerçekleştirilir. w(birim zamanda FP yüzeyinin 1 m2'sinden geçen m3 cinsinden filtrat miktarı). Sabit bir basınç farkında süspansiyon, filtreye vakum veya aşırı basınç altında ve ayrıca bir pistonlu pompa ile beslenir; santrifüj pompa kullanıldığında basınç farkı artar ve işlem hızı düşer.
Süspansiyon konsantrasyonuna bağlı olarak, birkaç filtrasyon türü ayırt edilir. %1'den fazla bir konsantrasyonda, bir çökelti oluşumu ile ve %0.1'den daha düşük bir konsantrasyonda, FP'nin gözeneklerinin tıkanmasıyla (sıvıların arıtılması) filtrasyon meydana gelir. FP üzerinde yeterince yoğun bir tortu tabakası oluşmaz ve katı parçacıklar süzüntüye girerse, daha önce FP'ye uygulanan veya süspansiyona eklenen ince dağılmış yardımcı malzemeler (diatomit, perlit) kullanılarak süzülür. %10'dan daha düşük bir başlangıç konsantrasyonunda, süspansiyonların kısmen ayrılması ve koyulaştırılması mümkündür.
Sürekli ve aralıklı filtreler arasında bir ayrım yapılır. İkincisi için, işin ana aşamaları filtrasyon, tortunun yıkanması, dehidrasyonu ve boşaltılmasıdır. Aynı zamanda en yüksek verimlilik ve en düşük maliyetler kriterlerine göre optimizasyon uygulanmaktadır. Eğer yıkama ve dehidrasyon yapılmaz ve bölmenin hidrolik direnci ihmal edilebilirse, filtrasyon süresi yardımcı işlemlerin süresine eşit olduğunda en yüksek verim elde edilir.
Pamuklu, yünlü, sentetik ve cam kumaşlardan yapılmış esnek FP'nin yanı sıra doğal ve sentetik elyaflardan ve esnek olmayan - seramik, sermet ve köpük plastikten dokunmamış FP uygulanabilir. Süzüntünün hareket yönleri ve yerçekimi eylemi zıt olabilir, çakışabilir veya karşılıklı olarak dik olabilir.
Filtre tasarımları çeşitlidir. En yaygın olanlardan biri döner tamburlu vakum filtresidir. (santimetre.Şekil), süzüntünün hareket yönlerinin ve yerçekimi etkisinin zıt olduğu sürekli eylem. Şalt bölümü, bölgeleri I ve II'yi bir vakum kaynağına ve bölgeleri III ve IV'ü bir basınçlı hava kaynağına bağlar. Bölge I ve II'den gelen süzüntü ve yıkama sıvısı ayrı alıcılara girer. Yatay hazneli otomatik aralıklı filtre pres, sonsuz bant şeklindeki filtre bezi ve presleme ile çamur susuzlaştırma için elastik membranlar da yaygınlaştı. Hazneleri bir süspansiyonla doldurma, tortuyu filtreleme, yıkama ve kurutma, bitişik hazneleri ayırma ve tortuyu çıkarma gibi dönüşümlü işlemleri gerçekleştirir.
SALT, bir kimyasal bileşik sınıfı. "Tuzlar" kavramının genel kabul görmüş bir tanımı ve ayrıca tuzların etkileşim ürünleri olan "asitler ve bazlar" terimleri şu anda mevcut değildir. Tuzlar, metal iyonları, NH4+, CH3NH3+ ve diğer katyonlar veya asit anyonları (örneğin, Cl-, SO42-) yerine baz OH gruplarının yerine asit hidrojen protonlarının ikame edilmesinin ürünleri olarak düşünülebilir.
sınıflandırma
Tam ikame ürünleri, örneğin orta tuzlardır. Na2S04 , MgCl2 , kısmen asidik veya bazik tuzlar, örneğin KHS04 , СuСlOH. Ayrıca, bir tür katyon ve bir tür anyon (örneğin, NaCl) dahil olmak üzere basit tuzlar, iki tür katyon içeren çift tuzlar (örneğin, KAl (S04) 2 12H20), aşağıdakileri içeren karışık tuzlar vardır. iki tip asit kalıntısı (örn. AgClBr). Kompleks tuzlar, K4 gibi kompleks iyonlar içerir.
Fiziki ozellikleri
Tipik tuzlar, CsF gibi iyonik yapıya sahip kristalli maddelerdir, AlCl3 gibi kovalent tuzlar da vardır. Aslında, birçok tuzun kimyasal bağı v'nin doğası karışıktır.
Suda çözünürlük ile çözünür, az çözünür ve pratik olarak çözünmez tuzlar ayırt edilir. Çözünür, suda hidrolize olan polivalan metallerin tuzları ve birçok asidik tuzlar dışında, hemen hemen tüm sodyum, potasyum ve amonyum tuzlarını, birçok nitratı, asetatı ve klorürü içerir.
Tuzların oda sıcaklığında suda çözünürlüğü
| katyonlar | anyonlar | |||||||||
| F- | Cl- | br- | BEN- | Ö2- | NUMARA 3 - | CO3 2- | SiO3 2- | SO 4 2- | PO 4 3- | |
| Na+ | R | R | R | R | R | R | R | R | R | R |
| B+ | R | R | R | R | R | R | R | R | R | R |
| NH4+ | R | R | R | R | R | R | R | R | R | R |
| Mg2+ | RK | R | R | R | M | R | H | RK | R | RK |
| Ca2+ | NK | R | R | R | M | R | H | RK | M | RK |
| Sr2+ | NK | R | R | R | R | R | H | RK | RK | RK |
| Ba 2+ | RK | R | R | R | R | R | H | RK | NK | RK |
| sn 2+ | R | R | R | M | RK | R | H | H | R | H |
| sayfa 2+ | H | M | M | M | RK | R | H | H | H | H |
| Al 3+ | M | R | R | R | G | R | G | NK | R | RK |
| Cr3+ | R | R | R | R | G | R | G | H | R | RK |
| Mn2+ | R | R | R | R | H | R | H | H | R | H |
| Fe2+ | M | R | R | R | H | R | H | H | R | H |
| Fe3+ | R | R | R | - | - | R | G | H | R | RK |
| Co2+ | M | R | R | R | H | R | H | H | R | H |
| Ni2+ | M | R | R | R | RK | R | H | H | R | H |
| Cu2+ | M | R | R | - | H | R | G | H | R | H |
| Zn2+ | M | R | R | R | RK | R | H | H | R | H |
| CD2+ | R | R | R | R | RK | R | H | H | R | H |
| Hg2+ | R | R | M | NK | NK | R | H | H | R | H |
| 2 2+ | R | NK | NK | NK | RK | R | H | H | M | H |
| Ag+ | R | NK | NK | NK | NK | R | H | H | M | H |
Efsane:
P - madde suda oldukça çözünür; M - az çözünür; H - pratik olarak suda çözünmez, ancak zayıf veya seyreltik asitlerde kolayca çözünür; RK - suda çözünmez ve sadece güçlü inorganik asitlerde çözünür; NK - ne suda ne de asitlerde çözünmez; G - çözünme üzerine tamamen hidrolize olur ve su ile temasta bulunmaz. Kısa çizgi, böyle bir maddenin hiç olmadığı anlamına gelir.
Sulu çözeltilerde, tuzlar tamamen veya kısmen iyonlara ayrışır. Zayıf asitlerin ve/veya zayıf bazların tuzları hidrolize uğrar. Sulu tuz çözeltileri, hidratlı iyonlar, iyon çiftleri ve hidroliz ürünleri vb. dahil olmak üzere daha karmaşık kimyasal formlar içerir. Bazı tuzlar ayrıca alkollerde, asetonda, asit amidlerde ve diğer organik çözücülerde çözünür.
Sulu çözeltilerden tuzlar, kristalli hidratlar biçiminde, sulu olmayan çözeltilerden - kristalli solvatlar biçiminde, örneğin CaBr2 3C2H5OH şeklinde kristalleşebilir.
Su-tuz sistemlerinde meydana gelen çeşitli işlemler, sıcaklık, basınç ve konsantrasyona bağlı olarak tuzların ortak mevcudiyetlerindeki çözünürlüğü, katı ve sıvı fazların bileşimi hakkında veriler, su-tuz sistemlerinin çözünürlük diyagramları incelenerek elde edilebilir.
Tuzların sentezi için genel yöntemler.
1. Orta tuzların elde edilmesi:
1) metal olmayan metal: 2Na + Cl 2 = 2NaCl
2) asitli metal: Zn + 2HCl = ZnCl2 + H2
3) daha az aktif bir metalin tuz çözeltisine sahip metal Fe + CuS04 = FeS04 + Cu
4) asit oksitli bazik oksit: MgO + CO2 = MgCO3
5) asitli bazik oksit CuO + H2S04 \u003d CuS04 + H20
6) asidik oksit Ba (OH) 2 + C02 = BaC03 + H20 içeren bazlar
7) asitli bazlar: Ca (OH) 2 + 2HCl \u003d CaCl2 + 2H20
8) asit tuzları: MgC03 + 2HCl = MgCl2 + H20 + CO2
BaCl2 + H2S04 \u003d BaSO4 + 2HCl
9) tuz çözeltisi içeren bir baz çözeltisi: Ba (OH) 2 + Na2S04 \u003d 2NaOH + BaS04
10) iki tuzun çözeltileri 3CaCl2 + 2Na3PO4 = Ca3(PO4)2+6NaCl
2. Asit tuzlarının elde edilmesi:
1. Bir asidin baz eksikliği ile etkileşimi. KOH + H2S04 \u003d KHSO4 + H20
2. Bir bazın fazla asit oksit ile etkileşimi
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Ortalama bir tuzun asit Ca3 (PO 4) 2 + 4H3 PO 4 \u003d 3Ca (H2P04) 2 ile etkileşimi
3. Temel tuzların elde edilmesi:
1. Zayıf baz ve kuvvetli asitten oluşan tuzların hidrolizi
ZnCl2 + H20 \u003d Cl + HCI
2. Orta metal tuzları AlCl 3 + 2NaOH = Cl + 2NaCl çözeltilerine küçük miktarlarda alkalilerin eklenmesi (damla damla)
3. Zayıf asit tuzlarının orta tuzlarla etkileşimi
2MgCl2 + 2Na2C03 + H20 \u003d 2 CO3 + CO2 + 4NaCl
4. Karmaşık tuzların elde edilmesi:
1. Tuzların ligandlarla reaksiyonları: AgCl + 2NH3 = Cl
FeCl3 + 6KCN] = K3 + 3KCI
5. Çift tuz elde etmek:
1. İki tuzun ortak kristalleşmesi:
Cr2 (S04) 3 + K2S04 + 24H20 \u003d 2 + NaCl
4. Katyon veya anyonun özelliklerinden kaynaklanan redoks reaksiyonları. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
2. Asit tuzlarının kimyasal özellikleri:
Orta tuza termal ayrışma
Ca (HCO 3) 2 \u003d CaCO 3 + CO 2 + H 2 O
Alkali ile etkileşim. Orta tuz elde etmek.
Ba(HCO 3) 2 + Ba(OH) 2 = 2BaCO 3 + 2H 2 O
3. Bazik tuzların kimyasal özellikleri:
Termal ayrışma. 2 CO 3 \u003d 2CuO + CO 2 + H 2 O
Asit ile etkileşim: ortalama bir tuz oluşumu.
Sn(OH)Cl + HCI = SnCl2 + H20
4. Karmaşık tuzların kimyasal özellikleri:
1. Az çözünen bileşiklerin oluşumu nedeniyle komplekslerin yok edilmesi:
2Cl + K2S \u003d CuS + 2KCl + 4NH3
2. Dış ve iç küreler arasında ligand değişimi.
K2 + 6H2O \u003d Cl2 + 2KCl
5. Çift tuzların kimyasal özellikleri:
Alkali çözeltilerle etkileşim: KCr(SO 4) 2 + 3KOH = Cr(OH) 3 + 2K2 SO 4
2. Geri kazanım: KCr (S04) 2 + 2H ° (Zn, seyreltilmiş H2S04) \u003d 2CrS04 + H2S04 + K2S04
Bir dizi klorür tuzları, sülfatlar, karbonatlar, Na, K, Ca, Mg boratların endüstriyel üretimi için hammaddeler, deniz ve okyanus suyu, buharlaşması sırasında oluşan doğal tuzlu sular ve katı tuz birikintileridir. Sedimanter tuz birikintilerini (Na, K ve Mg'nin sülfatları ve klorürleri) oluşturan bir grup mineral için “doğal tuzlar” kod adı kullanılır. En büyük potasyum tuzları yatakları Rusya (Solikamsk), Kanada ve Almanya'da, güçlü fosfat cevheri yatakları - Kuzey Afrika, Rusya ve Kazakistan'da, NaNO3 - Şili'de bulunmaktadır.
Tuzlar gıda, kimya, metalürji, cam, deri, tekstil sanayi, tarım, ilaç vb. alanlarda kullanılmaktadır.
Başlıca tuz türleri
1. Boratlar(oksoboratlar), borik asit tuzları: metaborik HBO2, ortoborik H3BO3 ve serbest halde izole edilmemiş poliborik asitler. Moleküldeki bor atomlarının sayısına göre mono-, di, tetra-, hekzaboratlar vb. 1 mol bazik oksit başına. Bu nedenle, bir anyon B (OH) 4 veya bir zincir anyonu (BO 2) n n-diborat içeriyorsa, çeşitli metaboratlar monoboratlar olarak adlandırılabilir - eğer bir çift zincir anyonu (B 2 O 3 (OH) 2) n 2n- içerirlerse triboratlar - halka anyonu içeriyorsa (B 3 O 6) 3-.
Tuzlar, bir asitteki hidrojen atomlarının bir metal yerine ikame edilmesinin ürünüdür. Sodadaki çözünür tuzlar, bir metal katyonuna ve bir asit kalıntısı anyonuna ayrışır. Tuzlar ayrılır:
Orta
Temel
karmaşık
Çift
Karışık
Orta tuzlar. Bunlar, bir asitteki hidrojen atomlarının metal atomlarla veya bir grup atomla (NH4 +) tamamen değiştirilmesinin ürünleridir: MgS04, Na2S04, NH4Cl, Al2(S04)3.
Orta tuzların isimleri metallerin ve asitlerin isimlerinden gelir: CuSO 4 - bakır sülfat, Na3P04 - sodyum fosfat, NaNO 2 - sodyum nitrit, NaClO - sodyum hipoklorit, NaClO 2 - sodyum klorit, NaClO 3 - sodyum klorat , NaClO 4 - sodyum perklorat, CuI - bakır (I) iyodür, CaF2 - kalsiyum florür. Ayrıca birkaç önemsiz ismi de hatırlamanız gerekir: NaCl-sofra tuzu, KNO3-potasyum nitrat, K2CO3-potas, Na2CO3-soda külü, Na2CO3∙10H2O-kristal soda, CuSO4-bakır sülfat,Na 2 B 4 O 7 . 10H 2 O- boraks, Na 2 SO 4 . 10H 2 O-Glauber tuzu. Çift tuzlar. Bu tuz iki tip katyon içeren (hidrojen atomları çok tabanlı asitler iki farklı katyon ile değiştirilir): MgNH 4 PO 4 , KAl (SO 4 ) 2 , NaKSO 4 .Çift tuzlar, bireysel bileşikler olarak sadece kristal formda bulunurlar. Suda çözündüklerinde tamamenmetal iyonlarına ve asit kalıntılarına ayrışır (eğer tuzlar çözünürse), örneğin:
NaKSO 4 ↔ Na + + K + + SO 4 2-
Çift tuzların sulu çözeltilerde ayrışmasının 1 adımda gerçekleşmesi dikkat çekicidir. Bu tür tuzları adlandırmak için, anyonun ve iki katyonun adlarını bilmeniz gerekir: MgNH4PO4 - magnezyum amonyum fosfat.
karmaşık tuzlar.Bunlar parçacıklardır (nötr moleküller veyaiyonlar ), bunun birleştirilmesi sonucu oluşan iyon (veya atom) ), isminde kompleks yapıcı, nötr moleküller veya diğer iyonlar denir ligandlar. Karmaşık tuzlar ayrılır:
1) katyon kompleksleri
Cl2 - tetraamminzinc(II) diklorür
Cl2- di heksaaminkobalt(II) klorür
2) anyon kompleksleri
K2- potasyum tetrafloroberilat(II)
Li-lityum tetrahidridoalüminat(III)
K3-potasyum hekzasiyanoferrat(III)
Karmaşık bileşiklerin yapısı teorisi, İsviçreli kimyager A. Werner tarafından geliştirilmiştir.
Asit tuzları metal katyonları için polibazik asitlerdeki hidrojen atomlarının eksik ikamesinin ürünleridir.
Örneğin: NaHCO3
Kimyasal özellikler:
Hidrojenin solundaki voltaj serisindeki metallerle reaksiyona girer.
2KHSO 4 + Mg → H 2 + Mg (SO) 4 + K 2 (SO) 4
Bu tür reaksiyonlar için alkali metalleri almanın tehlikeli olduğuna dikkat edin, çünkü önce suyla büyük bir enerji salınımı ile reaksiyona girecekler ve tüm reaksiyonlar çözeltilerde meydana geldiğinden bir patlama meydana gelecektir.
2NaHCO 3 + Fe → H 2 + Na 2 CO 3 + Fe 2 (CO 3) 3 ↓
Asit tuzları, orta tuzları ve suyu oluşturmak için alkali çözeltilerle reaksiyona girer:
NaHC03 +NaOH→Na2CO3 +H20
2KHSO 4 +2NaOH→2H 2 O+K 2 SO 4 +Na 2 SO 4
Asit tuzları, gaz salınırsa, bir çökelti oluşursa veya su salınırsa, orta tuz çözeltileriyle reaksiyona girer:
2KHSO 4 + MgCO 3 → MgSO 4 + K 2 SO 4 + CO 2 + H 2 O
2KHS04 +BaCl2 →BaSO4 ↓+K2SO4 +2HCl
Asit tuzları, reaksiyonun asit ürünü eklenenden daha zayıf veya daha uçucu ise asitlerle reaksiyona girer.
NaHCO 3 +HCl→NaCl+CO2 +H20
Asit tuzları, su ve ara tuzların salınmasıyla bazik oksitlerle reaksiyona girer:
2NaHCO3 + MgO → MgCO3 ↓ + Na2CO3 + H2O
2KHSO 4 + BeO → BeSO 4 + K 2 SO 4 + H 2 O
Asit tuzları (özellikle hidrokarbonatlar) sıcaklığın etkisi altında ayrışır:
2NaHCO 3 → Na 2 CO 3 + CO 2 + H 2 O
Fiş:
Asit tuzları, alkali bir polibazik asit çözeltisinin fazlasına maruz kaldığında oluşur (nötralizasyon reaksiyonu):
NaOH + H2S04 → NaHS04 + H20
Mg (OH) 2 + 2H 2 SO 4 → Mg (HSO 4) 2 + 2H 2 O
Asit tuzları, bazik oksitlerin polibazik asitlerde çözülmesiyle oluşur:
MgO + 2H 2 SO 4 → Mg (HSO 4) 2 + H 2 O
Asit tuzları, metaller bir polibazik asit çözeltisinin fazlasında çözüldüğünde oluşur:
Mg + 2H 2 SO 4 → Mg (HSO 4) 2 + H 2
Asit tuzları, ortalama tuz ile ortalama tuzun anyonunu oluşturan asidin etkileşiminin bir sonucu olarak oluşur:
Ca 3 (PO 4) 2 + H 3 PO 4 → 3CaHPO 4
Temel tuzlar:
Bazik tuzlar, asit kalıntıları için poliasit bazlarının moleküllerinde hidrokso grubunun eksik ikamesinin ürünüdür.
Örnek: MgOHNO3 ,FeOHCl.
Kimyasal özellikler:
Bazik tuzlar, orta düzeyde bir tuz ve su oluşturmak için fazla asitle reaksiyona girer.
MgOHNO 3 + HNO 3 → Mg (NO 3) 2 + H 2 O
Bazik tuzlar sıcaklıkla ayrışır:
2 CO 3 →2CuO + CO 2 + H 2 O
Bazik tuzların elde edilmesi:
Zayıf asit tuzlarının orta tuzlarla etkileşimi:
2MgCl2 + 2Na2CO3 + H20 → 2CO3 + CO2 + 4NaCl
Zayıf bir baz ve güçlü bir asit tarafından oluşturulan tuzların hidrolizi:
ZnCl2 + H20 → Cl + HCI
Çoğu temel tuz idareli bir şekilde çözünür. Birçoğu mineraldir, örneğin malakit Cu2C03(OH)2 ve hidroksilapatit Ca5(PO4)3OH.
Karışık tuzların özellikleri okul kimya dersinde ele alınmaz, ancak tanımını bilmek önemlidir.
Karışık tuzlar, iki farklı asidin asidik kalıntılarının bir metal katyona bağlandığı tuzlardır.
İyi bir örnek, Ca(OCl)Cl ağartıcıdır (ağartıcı).
isimlendirme:
1. Tuz karmaşık bir katyon içerir
Önce katyon adlandırılır, ardından iç küreye giren ve "o" ile biten ligandlar-anyonlar ( Cl - - kloro, OH - -hidrokso), sonra nötr moleküller olan ligandlar ( NH3-amin, H20 -aquo).1'den fazla özdeş ligand varsa, bunların sayısı Yunan rakamlarıyla gösterilir: 1 - mono, 2 - di, 3 - üç, 4 - tetra, 5 - penta, 6 - heksa, 7 - hepta, 8 - okta, 9 - nona, 10 - deka. İkincisi, değişken ise değerini parantez içinde gösteren kompleks oluşturucu iyon olarak adlandırılır.
[ Ag (NH 3 ) 2 ](OH )-gümüş diamin hidroksit ( BEN)
[ Co (NH 3 ) 4 Cl2 ] Cl2-klorür dikloro o kobalt tetraamin ( III)
2. Tuz, karmaşık bir anyon içerir.
Önce anyon ligandları adlandırılır, ardından iç küreye giren ve sayıları "o" ile biten nötr moleküller Yunan rakamlarıyla belirtilir.İkincisi, parantez içindeki değerliliği gösteren "at" soneki ile Latince'de kompleks oluşturucu iyon olarak adlandırılır. Daha sonra dış kürede bulunan katyonun adı yazılır, katyon sayısı belirtilmez.
K 4 -hekzasiyanoferrat (II) potasyum (Fe3+ iyonları için reaktif)
K3 - potasyum hekzasiyanoferrat (III) (Fe2+ iyonları için reaktif)
Na2-sodyum tetrahidroksozinkat
Çoğu kompleks oluşturan iyonlar metallerdir. Kompleks oluşumuna en büyük eğilim, d elementleri ile gösterilir. Merkezi kompleks oluşturucu iyonun çevresinde zıt yüklü iyonlar veya nötr moleküller vardır - ligandlar veya ek maddeler.
Kompleks oluşturan iyon ve ligandlar, kompleksin iç küresini oluşturur (köşeli parantez içinde), merkezi iyon etrafında koordine olan ligandların sayısına koordinasyon sayısı denir.
İç küreye girmeyen iyonlar dış küreyi oluşturur. Eğer kompleks iyon bir katyon ise dış kürede anyonlar vardır ve bunun tersi de geçerlidir, eğer kompleks iyon bir anyon ise dış kürede katyonlar vardır. Katyonlar genellikle alkali ve toprak alkali metal iyonları, amonyum katyonudur. Ayrıştığında, karmaşık bileşikler, çözeltilerde oldukça kararlı olan karmaşık karmaşık iyonlar verir:
K 3 ↔3K + + 3-
Asit tuzlarından bahsediyorsak, formülü okurken hidro- ön eki telaffuz edilir, örneğin:
Sodyum hidrosülfür NaHS
Sodyum bikarbonat NaHC03
Bazik tuzlarda önek kullanılır hidrokso- veya dihidrokso-
(tuzdaki metalin oksidasyon derecesine bağlıdır), örneğin:
magnezyum hidroksoklorürMg(OH)Cl, alüminyum dihidroksoklorür Al(OH) 2 Cl
Tuz elde etme yöntemleri:
1. Metalin ametal ile doğrudan etkileşimi . Bu şekilde anoksik asitlerin tuzları elde edilebilir.
Zn+Cl2 →ZnCl2
2. Asit ve baz arasındaki reaksiyon (Nötrleştirme reaksiyonu). Bu tür reaksiyonlar büyük pratik öneme sahiptir (çoğu katyona karşı niteliksel reaksiyonlar), bunlara her zaman su salınımı eşlik eder:
NaOH+HCl→NaCl+H20
Ba(OH) 2 + H 2 SO 4 → BaSO 4 ↓ + 2H 2 O
3. Bazik oksidin asit ile etkileşimi :
SO3 +BaO→BaSO4 ↓
4. Asit oksit ve bazın reaksiyonu :
2NaOH + 2NO 2 → NaNO 3 + NaNO 2 + H 2 O
NaOH + CO 2 →Na 2 CO 3 + H 2 O
5. Bazik oksit ve asidin etkileşimi :
Na2O + 2HCl → 2NaCl + H2O
CuO + 2HNO 3 \u003d Cu (NO 3) 2 + H 2 O
6. Metalin asitle doğrudan etkileşimi. Bu reaksiyona hidrojenin evrimi eşlik edebilir. Hidrojenin salınıp salınmayacağı metalin aktivitesine, asidin kimyasal özelliklerine ve konsantrasyonuna bağlıdır (bkz. Konsantre sülfürik ve nitrik asitlerin özellikleri).
Zn + 2HCl \u003d ZnCl2 + H2
H2S04 + Zn \u003d ZnS04 + H2
7. tuzun asitle reaksiyonu . Bu reaksiyon, tuzu oluşturan asidin, reaksiyona giren asitten daha zayıf veya daha uçucu olması koşuluyla gerçekleşir:
Na 2 CO 3 + 2HNO 3 \u003d 2NaNO 3 + CO 2 + H 2 O
8. Tuzun asidik oksit ile reaksiyonu. Reaksiyonlar yalnızca ısıtıldığında meydana gelir, bu nedenle reaksiyona giren oksit, reaksiyondan sonra oluşandan daha az uçucu olmalıdır:
CaCO3 + SiO2 \u003d CaSiO3 + CO2
9. Metal olmayan bir maddenin alkali ile etkileşimi . Alkalilerle etkileşime giren halojenler, kükürt ve diğer bazı elementler oksijensiz ve oksijen içeren tuzlar verir:
Cl2 + 2KOH \u003d KCl + KClO + H20 (reaksiyon ısınmadan ilerler)
Cl2 + 6KOH \u003d 5KCl + KClO3 + 3H20 (reaksiyon ısıtma ile devam eder)
3S + 6NaOH \u003d 2Na2S + Na2S03 + 3H20
10. iki tuz arasındaki etkileşim Bu, tuz elde etmenin en yaygın yoludur. Bunun için reaksiyona giren her iki tuzun da yüksek oranda çözünür olması gerekir ve bu bir iyon değiştirme reaksiyonu olduğu için sonuna kadar gidebilmesi için reaksiyon ürünlerinden birinin çözünmez olması gerekir:
Na2C03 + CaCl2 \u003d 2NaCl + CaCO3 ↓
Na2S04 + BaCl2 \u003d 2NaCl + BaSO4 ↓
11. Tuz ve metal arasındaki etkileşim . Metal, tuzda bulunanın solundaki metallerin voltaj serisindeyse reaksiyon devam eder:
Zn + CuSO 4 \u003d ZnS04 + Cu ↓
12. Tuzların termal bozunması . Bazı oksijen içeren tuzlar ısıtıldığında, daha düşük oksijen içeriğine sahip veya hiç içermeyen yeni tuzlar oluşur:
2KNO3 → 2KNO2 + Ö2
4KClO3 → 3KClO4 +KCI
2KClO3 → 3O2 +2KCI
13. Metal olmayanların tuzla etkileşimi. Bazı metal olmayanlar, yeni tuzlar oluşturmak için tuzlarla birleşebilir:
Cl 2 +2KI=2KCI+I 2 ↓
14. Bazın tuzla reaksiyonu . Bu bir iyon değiştirme reaksiyonu olduğundan, sonuna kadar gidebilmesi için reaksiyon ürünlerinden 1 tanesinin çözünmez olması gerekir (bu reaksiyon asit tuzlarını orta tuzlara dönüştürmek için de kullanılır):
FeCl3 + 3NaOH \u003d Fe (OH) 3 ↓ + 3NaCl
NaOH+ZnCl2 = (ZnOH)Cl+NaCl
KHSO 4 + KOH \u003d K2S04 + H20
Aynı şekilde çift tuzlar elde edilebilir:
NaOH + KHS04 \u003d KNaS04 + H20
15. Metalin alkali ile etkileşimi. Amfoterik olan metaller, alkalilerle reaksiyona girerek kompleksler oluşturur:
2Al+2NaOH+6H2O=2Na+3H2
16. Etkileşim ligandlı tuzlar (oksitler, hidroksitler, metaller):
2Al+2NaOH+6H2O=2Na+3H2
AgCl+3NH4OH=OH+NH4Cl+2H20
3K 4 + 4FeCl3 \u003d Fe3 3 + 12KCl
AgCl+2NH4OH=Cl+2H20
Editör: Kharlamova Galina Nikolaevna