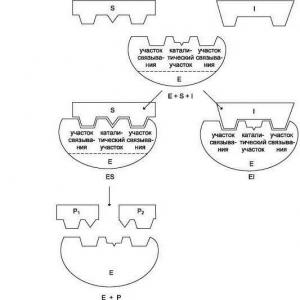
Nahco3'ün ayrışma reaksiyonu. Karbonatlar
Bazen çocukluktan kalma tamamen sıradan ve tanıdık bir madde, birçok hastalık ve rahatsızlık için neredeyse her derde deva haline gelir. Sadece herkes bunu bilmiyor. Bu bileşiklerden biri herkesin mutfak dolabında bulunan olağan bir bileşiktir. Sadece pişirme kalitesini artırmanın bir yolu olarak değil, aynı zamanda bir ilaç, yağ giderici, ağartıcı ve hatta dezenfektan olarak da hizmet ettiği ortaya çıktı. Bu maddeyi daha detaylı tanıyalım.
Sodanın kimyasal temeli
Bu bileşiğin kimya açısından doğru adı sodyum bikarbonattır. Günlük yaşamda ve kimyada bu maddeye atıfta bulunmak için kullanılan birkaç isim vardır:
- bikarbonat soda;
- karbonat;
- soda içmek;
- sodyum bikarbonat;
- katkı maddesi E 500.
Ancak bunlardan herhangi biri tek gerçek özü yansıtır - bu sodadır.
Ampirik formül
Kabartma tozunun formülü NaHC03'tür. Yani doğası gereği bu madde asidik kategorisine aittir. Bileşik güçlü bir alkali ve zayıf bir asitten oluştuğundan, hidroliz sırasında (sulu bir çözelti içinde) ortamda alkalin bir reaksiyon meydana gelecektir. Sudaki kabartma tozu çözeltisinin pH'ı 8,1'dir. karbonik asitin etkileşimi ile kolayca oluştuğundan, süreç aşağıdaki reaksiyon denklemiyle ifade edilir:
NaOH + H2C03 \u003d NaHCO3 + H20
Kabartma tozu ampirik formülü, bileşiğin niceliksel ve niteliksel bileşimini gösterir; buna dayanarak molekülün uzaysal yapısı hakkında bir sonuca varmak mümkündür: dış kürede pozitif yüklü bir Na + katyonu ve negatif yüklü İçteki HCO 3 hidrokarbonat iyonu.
Karbon atomu kendi etrafında üç oksijen atomunu koordine eder ve bunlardan biri çift bağ oluşturur. Ayrıca oksijen atomlarından biri bir hidrojen katyonuyla birleşerek bir hidrokso grubu oluşturur. İyon formundaki üçüncü oksijen atomu, sodyum katyonunun yakınında ilişkilidir. Böylece bu bileşiğin parçası olan her bir elementin değerleri telafi edilir.
Fiziki ozellikleri
Bu maddeye ne ad verirsek verelim (kabartma tozu, içme suyu, karbonat, sodyum bikarbonat) formülü hala aynıdır ve hakkında fikir verir. Yani sodanın görünümü ince bir tozdur. Rengi beyazdır. Suda iyice çözünelim ve organik çözücülerde (örneğin alkol) pratik olarak çözünmez. Açık havada ayrışmaz. Ortamın yüksek neminde parçalanmaya başlar. Artan sıcaklıkla tamamen ayrışmanın ürünleri sodyum karbonat (orta tuz), karbondioksit ve sudur:
NaHCO3 \u003d Na2C03 + CO2 + H20

Sodyum bikarbonat kokusuzdur, hafif tuzlu ve alkali bir tada sahiptir. Suda çözündüğünde çeşitli konsantrasyonlarda alkali çözeltiler verir.
Sodanın keşfi ve kullanımının tarihçesi hakkında kısa bilgi
Sodyum bikarbonat ile ilgili ilk bilgiler eski Mısır uygarlığında ortaya çıktı. Doğal soda kaynakları içeren birkaç göl bu kısımlarda dağılmıştı. Bu göller kuruyunca beyaz toz halinde soda dağıtılıyor ve insanlar bunu topluyordu. Mısırlılar tarafından mumyalama aletlerinin üretiminde kullanılan bileşenlerden biri olarak kullanılmıştır. O zamanlar kabartma tozunun formülü henüz bilinmiyordu.
Spesifik olarak, kimyasal bir bileşik olarak madde çok daha sonra, 18. yüzyıl civarında incelenmiştir. O zaman bilim adamları doğal olarak oluşan bu tozla ilgilenmeye başladılar. Bileşimin kapsamlı bir analizi, bileşiğin niteliksel ve niceliksel bileşenlerinin belirlenmesini mümkün kıldı. Modern karbonat formülü böyle doğdu.
Madde ve özellikleri hakkındaki fikirlerin geliştirilmesine büyük katkı İtalyan hekim Tullio Simoncini tarafından yapılmıştır. Sodanın kanserli tümörler için olası bir tedavi seçeneği olduğu sonuçlarına göre deneylere sahiptir. Ancak bugüne kadar bunu doğrulayan kesin bir veri yoktur.

Kullanım alanları
Suda iyi çözünme yeteneğinin yanı sıra asitlerle etkileşime girerek reaksiyon sonucu karbondioksit oluşturması nedeniyle soda, endüstrinin ve günlük yaşamın çeşitli alanlarında kullanılmaktadır. Yani, örneğin:
- eczacılık ve tıp;
- kimyasal endüstri;
- hafif sanayi;
- Gıda endüstrisi.
Yönlerin her birini daha ayrıntılı olarak ele alalım.
Tıpta uygulama
Bir maddenin tıpta kullanımının dayandığı ana şey, gastrointestinal sistemdeki su-alkali dengesini yeniden sağlama yeteneğidir. Bileşik NaHC03 antasit tedavilerini ifade eder. Kabartma tozu formülü, vücuttaki yüksek asitliği nötrleştirme işlevini yerine getiren hidroksit iyonlarının varlığını gösterir. Bu nedenle, mide ekşimesi semptomlarını ortadan kaldırmak için çoğu zaman sudaki bir sodyum bikarbonat çözeltisi kullanılır. Ancak maddenin kullanılabileceği tek hastalık alanı bu değil.
- Soğuk algınlığı tedavisinde karbonat, balgamın akciğerlerden ve bronşlardan incelmesine ve atılmasına yardımcı olduğundan öksürüğü hafifletir. Ayrıca SARS ile soluma yapabilirsiniz.
- Kabartma tozu ayrıca bakteri yok edici ve antiinflamatuar bir madde olarak da kullanılır. Formülü, bu etkiyi sağlayan H+ hidrojen katyonlarının varlığını yansıtır.
- Kardiyovasküler hastalıkların (aritmiler ve hipertansiyon) tedavisi için sudaki zayıf bir sodyum bikarbonat çözeltisi kullanılır.
- İshal ve kusma ile sodanın tuzla birlikte kullanılması vücudun su tedarikini yenilemenize ve gerekli dengeyi yeniden sağlamanıza olanak tanır.
- Bu madde mantar hastalıklarını yok edebilir, bu nedenle ayak mantarını ortadan kaldırmak, pamukçuk için bir solüsyonla duş yapmak ve konjonktiva iltihabı için gözleri yıkamak için kullanılır.
- Beyazlatma özelliğinden dolayı diş fırçalamada kabartma tozu kullanılır.
- Zayıf bir çözüm, deri döküntüleri (veya böcek ısırıkları) ile kaşıntıdan kurtulmanızı sağlar.
- Birincil yanıkların tedavisi.
- Vücudun ağır metal tuzlarından muaf tutulması.
- NaHCO3 ve esansiyel yağlarla ılık bir banyo kullanıldığında aşırı kilolardan kurtulmanın yanı sıra yorgunluk da vardır.

Kozmetoloji de dahil olmak üzere tıbbi amaçlarla kullanıldığında kabartma tozunun yararları ve zararları hakkında çok şey söylenebilir. Bu ilacı kullanmanın ana kuralı, diğer ilaçlar gibi, dozaj önerilerini ihmal etmemektir. Yanlış kullanım sağlığa zararlı olabilir.
Kabartma tozu: kimya endüstrisinde formül ve kullanım
Sodyum bikarbonatın kullanıldığı başlıca alan ev kimyasallarıdır. Kabartma tozu, yüzeylerin temizlenmesi ve yağdan arındırılması için hafif bir aşındırıcı görevi görebilir. Ayrıca boya, köpük ve flor bileşiklerinin üretiminde hammadde olarak kullanılır. Ayrıca yangın söndürme maddeleri NaHCO 3 bazında yapılmaktadır.
Sodyum bikarbonat olmadan ev kimyasallarının nasıl gelişeceğini hayal etmek imkansızdır. Kabartma tozu birçok kimyasal sentez için önemli ve gerekli bir bileşendir.
Hafif sanayi
Kabartma tozu, kauçuk, kauçuk taban ve ürünlerin imalatında yüzey işleminde kullanılır. Hafif sanayide sodyum bikarbonatın formülü, uygulaması, zararları ve faydaları ayrı bir çalışma konusudur. Kısaca NaHCO3'ün rolü tekstil ve suni deri üretiminde kullanılmaya indirgenmiştir. Bu durumda zarar, maddeyle temasın çok uzun sürmesi ve ellerin korunmaması durumunda yanık görünümüyle kendini gösterir. Bunun faydası, sodanın deri tabaklama ve üretiminde mükemmel bir katkı maddesi ve yağ giderici olmasının yanı sıra tekstil işinde iyi bir kumaş ağartıcı olmasıdır.
Gıda endüstrisi
Kimyadaki kabartma tozu formülü, asitlerle reaksiyonlardaki işlemlerin özünü yansıtır. Örneğin asetik asit ile etkileşim aşağıdaki denklemle açıklanacaktır:
NaHCO3 + CH3COOH \u003d CH3COONa + H2C03
Bu durumda, ortaya çıkan çok kararsız olan karbonik asit, derhal CO2 ve H20'ya ayrışır. Gıda endüstrisinde sodyum bikarbonatın kullanımı, reaksiyonların gidişatının bu özelliğine dayanmaktadır. Nitekim fırıncılık üretimi için sodayı sirke ile söndürmek, elde edilen karışımı gözenekliliği ve daha iyi yapısı için hamura eklemek gerekir. Soda söndürme reaksiyonu bu tiptedir ve buna muhteşem bir köpüklenme ve tıslama etkisi eşlik eder.

Soda kullanımı hamur işlerini çok yumuşak, hoş kokulu ve güzel hale getirir, dolayısıyla gıda endüstrisi bu maddenin geniş ölçekte kullanıldığı ana endüstrilerden biridir. Sodyum bikarbonat ayrıca fırınlamada, çeşitli şekerleme ürünlerinin imalatında da kullanılır. Ayrıca gazlı içeceklerde (gazlı su, şampanya ve köpüklü şaraplar, maden suyu) gaz kabarcığı oluşturmak için de kullanılır.
Kabartma tozu: özellikleri ve tedavisi. Kullanım için zarar ve kontrendikasyonlar
Aslında sodanın kullanımı, daha önce de gördüğümüz gibi, çeşitli endüstrilerde ve evlerde oldukça geniştir. Sıra dışı iyileştirici, antibakteriyel, beyazlatıcı, rahatlatıcı ve iyileştirici özellikleri çeşitli rahatsızlıkların tedavisinde kullanılmaktadır. Ancak diğer ilaçlar gibi sodanın da karşıt bir tarafı vardır. Sağlığa zararlı ve çok tehlikeli olabilir. Kullanım endikasyonları açıktır, ancak daha ayrıntılı olarak ele alacağımız kontrendikasyonlar da daha az önemli değildir.

Kullanım için zarar ve kontrendikasyonlar
Sodanın bir arkadaş ve yardımcı değil de düşman haline gelmesinin birkaç ana nedeni vardır.

Bu nedenle kabartma tozunun kişi için sadece olumlu bir rol oynamadığı açıktır. Fayda ve zarar, tedavi belirsiz yönlerdir. Çeşitli rahatsızlıklardan kurtulmak için sodyum bikarbonatı her yerde kullanmadan önce mutlaka doktorunuza danışmalısınız. Günlük yaşamda soda kullanılıyorsa (yüzeylerin temizlenmesi, kumaşların ağartılması vb.), o zaman maddenin temassız kullanımı için en basit koruma araçlarını ihmal etmemelisiniz.
Üretici firma: Rusya, Türkiye
Paket:
Çantalar 25kg
40kg'lık torbalar
Ek nakliye bilgileri:
Kabartma tozu (sodyum bikarbonat, sodyum bikarbonat, sodyum bikarbonat) kapalı araçlarla tüm taşıma araçlarıyla (hava hariç) taşınır. Sodyum bikarbonatın, özel taşıma araçları (un kamyonu gibi) kullanılarak veya özel olarak yapılmış paslanmaz çelik kaplar kullanılarak karayoluyla toplu olarak taşınmasına izin verilir. Özel esnek konteynerler, yük taşıma olmadan, gönderenin (alıcının) yan taraflarında yükleme ve boşaltma ile, açık demiryolu araçlarıyla, araç yükü sevkiyatlarında demiryolu ile taşınır. Kabartma tozu kapalı depolarda saklanır. Doldurulmuş özel yumuşak kaplar hem kapalı depolarda hem de açık alanlarda 2-3 kat yükseklikte depolanır.
Öneriler:
Kabartma tozu, beyaz renkli, kokusuz, ince öğütülmüş kristal bir tozdur. Ayırt edici bir özellik, hayvan ve bitki dokuları üzerinde zararlı etkisi olmayan hafif alkalin özellikleridir. Kaynama noktası - 851 ° C, erime noktası - 270 ° C. Yoğunluk - 2.159 g / cm³. Kimya, gıda, hafif, tıbbi, ilaç endüstrileri, demir dışı metalurji ve perakende ticaret için tasarlanmıştır. Kimyasal formül: NaHCO3.
Üretim teknolojisi:
Soda artık endüstriyel amonyak yöntemiyle (Solvay yöntemi) çıkarılıyor. Eşit molar miktarlarda gaz halindeki amonyak ve karbon dioksit, doymuş bir sodyum klorür çözeltisine aktarılır, yani sanki amonyum bikarbonat NH4HCO3 eklenmiş gibi: NH3 + CO2 + H2O + NaCl → NaHC03 + NH4Cl. Az çözünür (20 ° C'de 100 g su başına 9,6 g) sodyum bikarbonatın çökelmiş kalıntısı filtrelenir ve 140 - 160 ° C'ye ısıtılarak kalsine edilir (susuzlaştırılır), bu sırada sodyum karbonata geçer: 2NaHCO3 → (t) Na2CO3 + CO2 + H2O Prosesin ilk aşamasında 2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O reaksiyonuna göre ana likörden ayrılan karbondioksit ve amonyak üretim döngüsüne geri döndürülür. Çözeltinin amonizasyonu, doymuş bir çözeltide az miktarda çözünen karbondioksitin içine dahil edilmesi için gereklidir. Kristaller halinde çökeltilen sodyum bikarbonat, amonyum klorür ve reaksiyona girmemiş NaCl içeren bir çözeltiden süzülerek ayrılır ve kalsine edilir (kalsine edilir). Bu durumda soda külü oluşumu meydana gelir. Kalsinasyon sırasında açığa çıkan ve karbondioksit CO2 içeren gazlar karbonizasyon için kullanılır. Böylece harcanan karbondioksitin bir kısmı yeniden üretilir. İşlem için gerekli olan karbondioksit, kireçtaşı veya tebeşirin kavrulmasıyla elde edilir. Yanmış kireç CaO su ile söndürülür. Sönmüş kireç Ca(OH)2 su ile karıştırılır. Elde edilen kireç sütü, bikarbonatın ayrılmasından sonra elde edilen ve amonyum klorür içeren çözeltiden (filtre sıvısı) amonyağın yeniden üretilmesi için kullanılır. Soda üretimi için, doğal koşullarda tuz yataklarının yer altı liçi ile elde edilen yaklaşık 310 g / l konsantrasyona sahip bir sofra tuzu (tuzlu su) çözeltisi kullanılır. Doğal tuzlu su, NaCl'ye ek olarak genellikle kalsiyum ve magnezyum tuzlarını da içerir. Tuzlu suyun amonizasyonu ve karbonizasyonu sırasında, bu safsızlıkların NH3 ve CO2 ile etkileşimi sonucunda çökelme meydana gelecek ve bu da cihazın kirlenmesine, ısı transferinin bozulmasına ve sürecin normal seyrine yol açacaktır. Bu nedenle, salamura, safsızlıklardan önceden temizlenir: salamuraya kesin olarak tanımlanmış miktarda reaktif eklenerek çökeltilir - saflaştırılmış salamura ve kireç sütünde bir soda süspansiyonu. Bu temizleme yöntemine soda-kireç denir. Elde edilen magnezyum hidrat ve kalsiyum karbonat çökeltileri çökeltme tanklarında ayrılır. Saflaştırılmış ve berraklaştırılmış ortak tuz tuzlu suyu, kabarcık emme kolonuna gönderilir. Kolonun üst kısmı, vakum pompası tarafından vakum filtrelerinden emilen gazı ve karbonizasyon kolonlarından gelen gazı tuzlu suyla yıkamak için kullanılır. Bu gazlar az miktarda amonyak ve karbondioksit içerir; bunların taze tuzlu suyla yıkanması ve dolayısıyla üretimde daha tam olarak kullanılması tavsiye edilir. Kolonun alt kısmı, tuzlu suyun damıtma kolonundan gelen amonyakla doyurulmasına hizmet eder. Elde edilen amonyak-tuzlu tuzlu su daha sonra kabarcıklı karbonizasyon kolonuna gönderilir; burada ham maddenin sodyum bikarbonata dönüştürülmesinin ana reaksiyonu gerçekleşir. Bu amaç için gerekli olan karbondioksit CO2, şaft kireç fırınından ve sodyum bikarbonat kalsinatöründen gelir ve kolona alttan enjekte edilir. Amonyak-tuzlu tuzlu suyun karbonizasyonu, soda üretiminde en önemli aşamadır. Karbonizasyon sırasında sodyum bikarbonatın oluşumu, karbonizasyon kolonunda meydana gelen karmaşık kimyasal işlemlerin bir sonucu olarak meydana gelir. Kolonun üst kısmında, tuzlu suyun içerdiği amonyak ve kolona verilen karbondioksitten amonyum karbonat oluşur. Tuzlu su kolondan yukarıdan aşağıya geçerken, kolonun tabanından gelen fazla karbondioksit ile reaksiyona giren amonyum karbonat, amonyum bikarbonata (amonyum bikarbonat) geçer. Kolonun soğutulmamış üst kısmının yaklaşık olarak ortasında, sodyum bikarbonat kristallerinin çökelmesi ve çözeltide amonyum klorür oluşumu ile birlikte değişim ayrışma reaksiyonu başlar. Ekzotermik reaksiyon nedeniyle sodyum bikarbonat kristallerinin oluşumunun meydana geldiği kolonun orta kısmında, tuzlu suyun sıcaklığı hafifçe yükselir (60 - 65 ° C'ye kadar), ancak soğutulması gerekli değildir, çünkü bu sıcaklık daha büyük, iyi filtrelenmiş sodyum bikarbonat kristallerinin oluşumuna katkıda bulunur. Kolonun alt kısmında, sodyum bikarbonatın çözünürlüğünü azaltmak ve verimini arttırmak için soğutma gereklidir. Sıcaklığa, salamuradaki NaCl içeriğine, amonyak ve karbondioksite doygunluk derecesine ve diğer faktörlere bağlı olarak bikarbonat verimi %65-75'tir. Sofra tuzunu tamamen sodyum bikarbonat çökeltisine dönüştürmek neredeyse imkansızdır. Bu, amonyak yöntemiyle soda üretiminin önemli dezavantajlarından biridir.
Başvuru:
Sodyum bikarbonat (bikarbonat) kimya, gıda, hafif, tıbbi, ilaç endüstrilerinde, demir dışı metalurjide kullanılır ve perakende ticarete tedarik edilir. Gıda katkı maddesi E500 olarak kayıtlıdır. Yaygın olarak aşağıdaki alanlarda kullanılır: - kimya endüstrisi - boyaların, köpük plastiklerin ve diğer organik ürünlerin, flor reaktiflerinin, ev kimyasallarının, yangın söndürücülerdeki dolgu maddelerinin üretiminde, karbondioksit ve hidrojen sülfürün gaz karışımlarından ayrılması için (gaz, bir yüksek basınç ve düşük sıcaklıkta bikarbonat çözeltisi, çözelti ısıtılarak ve azaltılarak indirgenir). - hafif sanayi - taban kauçuk ve suni deri üretiminde, deri üretiminde (derinin tabaklanması ve nötrleştirilmesi). - tekstil endüstrisi (ipek ve pamuklu kumaşların terbiyesi). Kauçuk ürünlerinin üretiminde sodyum bikarbonatın kullanımı aynı zamanda ısıtıldığında CO2 salınımından kaynaklanmaktadır ve bu da kauçuğa gerekli gözenekli yapının verilmesine katkıda bulunmaktadır. - gıda endüstrisi - fırıncılık, şekerleme, içecekler. - tıp endüstrisi - enjeksiyon çözeltilerinin, tüberküloz önleyici ilaçların ve antibiyotiklerin hazırlanması için. - metalurji - nadir toprak metallerinin çökeltilmesinde ve cevherlerin yüzdürülmesinde.
Paketleme ve depolama:
Kabartma tozu, dört, beş katmanlı kağıt torbaların yanı sıra polietilen astarlı özel yumuşak tek kullanımlık kaplarda paketlenir. Ürün raf ömrü. Üretim tarihinden itibaren 1 yıl.
Niteliksel göstergeler:
Sodyum bikarbonat, ortalama kristal boyutu 0,05 - 0,20 mm olan beyaz kristal bir tozdur. Bileşiğin moleküler ağırlığı 84,01, yoğunluğu 2200 kg/m³, kütle yoğunluğu 0,9 g/cm³'tür. Sodyum bikarbonatın çözünme ısısı 1 kg NaHC03 başına 205 kJ (48,8 kcal) olarak hesaplanır, ısı kapasitesi 1,05 kJ/kg K'ye (0,249 kcal/kg °C) ulaşır. Sodyum bikarbonat termal olarak kararsızdır ve ısıtıldığında katı sodyum karbonat oluşturacak şekilde ayrışır ve karbondioksitin yanı sıra suyu da gaz fazına salar: kJ (- 30 kcal) Sodyum bikarbonatın sulu çözeltileri benzer şekilde ayrışır: 2NaHCO3 (r.) ↔ Na2CO3 ( r.) + CO2 (g.) + H2O (buhar) - 20,6 kJ (- 4,9 kcal) Sulu çözelti sodyum bikarbonat hafif alkali karakterde olduğundan hayvan ve bitki dokularına etki etmez. Sodyum bikarbonatın sudaki çözünürlüğü düşüktür ve sıcaklık arttıkça biraz artar: 0 ° C'de 100 g su başına 6,87 g'dan 80 ° C'de 100 g su başına 19,17 g'a. Düşük çözünürlük nedeniyle yoğunluk, Sodyum bikarbonatın doymuş sulu çözeltilerinin yoğunluğu, saf suyun yoğunluğundan nispeten az farklılık gösterir. Kaynama noktası (ayrışır): 851° C; Erime noktası: 270°C; Yoğunluk: 2,159 g/cm³; Suda çözünürlük, 20°C'de g/100 ml: 9.
Fonksiyonel özellikler:
Kimyasal özellikler. Sodyum bikarbonat, karbonik asidin asidik sodyum tuzudur. Molekül ağırlığı (1971 uluslararası atom kütlelerine göre) - 84.00. Asitlerle reaksiyon. Sodyum bikarbonat asitlerle reaksiyona girerek bir tuz ve karbonik asit oluşturur ve bu hemen karbondioksit ve suya ayrışır: Pişirme sırasında NaHCO3 + HCl → NaCl + H2CO3 H2CO3 → H2O + CO2, asetik asit ile böyle bir reaksiyon oluşumuyla daha yaygındır. sodyum asetat: NaHCO3 + CH3COOH → CH3COONa + H2O + CO2 Soda suda iyi çözünür. Sulu bir kabartma tozu çözeltisi hafif alkali bir reaksiyona sahiptir. Kabartma tozunun tıslaması, kimyasal reaksiyonların bir sonucu olarak karbondioksit (CO2) salınımının sonucudur. Termal ayrışma. 60° C sıcaklıkta, sodyum bikarbonat, sodyum karbonat, karbon dioksit ve suya ayrışır (ayrışma süreci en çok 200° C'de etkilidir): 2NaHCO3 → Na2CO3 + H2O + CO2 sodyum karbonat, karbondioksit ve sodyum okside ayrışır: Na2CO3 → Na2O + CO2.
Kabartma tozu veya içme sodası tıpta, yemek pişirmede ve ev tüketiminde yaygın olarak bilinen bir bileşiktir. Bu, molekülü, karbonik asidin asit kalıntısının bir anyonu olan pozitif yüklü sodyum ve hidrojen iyonlarından oluşan bir asit tuzudur. Sodanın kimyasal adı sodyum bikarbonat veya sodyum bikarbonattır. Bileşiğin Hill sistemine göre formülü: CHNaO3 (genel formül).
Ekşi tuz ve orta arasındaki fark
Karbonik asit iki grup tuz oluşturur: karbonatlar (orta) ve bikarbonatlar (asit). Karbonatların önemsiz adı - soda - antik çağda ortaya çıktı. Ortalama ve asidik tuzları isimlere, formüllere ve özelliklere göre ayırmak gerekir.
Na2C03 - sodyum karbonat, karbonik asidin disodyum tuzu, yıkama soda külü. Cam, kağıt, sabun üretiminde hammadde görevi görür ve deterjan olarak kullanılır.
NaHC03 - sodyum bikarbonat. Bileşim, maddenin karbonik asidin monosodyum tuzu olduğunu öne sürüyor. Bu bileşik, iki farklı pozitif iyonun - Na + ve H + - varlığıyla ayırt edilir. Dışa doğru kristal beyaz maddeler benzerdir, bunları birbirlerinden ayırmak zordur.
NaHC03 maddesi susuzluğu gidermek için yutulduğu için değil, içme sodası olarak kabul edilir. Bu maddenin yardımıyla gazlı bir içecek yapabilirsiniz. Bu bikarbonatın bir çözeltisi, mide suyunun artan asitliği ile ağızdan alınır. Bu durumda mide duvarlarını tahriş eden, ağrı ve yanmaya neden olan H+ protonlarının fazlalığı nötralize edilir.
Kabartma tozunun fiziksel özellikleri
Bikarbonat beyaz monoklinik kristallerdir. Bu bileşik sodyum (Na), hidrojen (H), karbon (C) ve oksijen atomlarını içerir. Maddenin yoğunluğu 2,16 g/cm3'tür. Erime sıcaklığı - 50-60 ° C Sodyum bikarbonat, suda çözünen, katı, ince kristalli bir bileşik olan süt beyazı bir tozdur. Kabartma tozu yanmaz ve 70 ° C'nin üzerine ısıtıldığında sodyum karbonat, karbondioksit ve suya ayrışır. Üretim koşullarında granüler bikarbonat daha sık kullanılır.

İnsanlar için kabartma tozu güvenliği
Bileşiğin kokusu yoktur, tadı acı-tuzludur. Ancak maddenin koklanması ve tadına bakılması önerilmez. Sodyum bikarbonatın solunması hapşırmaya ve öksürüğe neden olabilir. Bir kullanım, kabartma tozunun kokulu maddeleri nötralize etme yeteneğine dayanır. Hoş olmayan kokulardan kurtulmak için toz spor ayakkabılara uygulanabilir.
Kabartma tozu (sodyum bikarbonat) ciltle teması halinde zararsızdır, ancak katı halde gözlerin ve yemek borusunun mukoza zarlarını tahriş edebilir. Düşük konsantrasyonlarda çözelti toksik değildir, ağızdan alınabilir.
Sodyum bikarbonat: bileşik formülü
Ampirik formül CHNaO3, kimyasal reaksiyon denklemlerinde nadiren bulunur. Gerçek şu ki, sodyum bikarbonatı oluşturan parçacıklar arasındaki ilişkiyi yansıtmamaktadır. Bir maddenin fiziksel ve kimyasal özelliklerini karakterize etmek için yaygın olarak kullanılan formül NaHC03'tür. Atomların karşılıklı dizilişi molekülün küresel çubuk modeliyle yansıtılır:

Periyodik tablodan sodyum, oksijen, karbon ve hidrojenin atom kütlelerinin değerlerini öğrenirseniz. daha sonra sodyum bikarbonat maddesinin molar kütlesini hesaplayabilirsiniz (naHCO3 formülü):
Ar(Na) - 23;
Ar(O)-16;
Ar(C)-12;
Ar(H)-1;
M (CHNaO3) \u003d 84 g / mol.
Maddenin yapısı
Sodyum bikarbonat iyonik bir bileşiktir. Kristal kafesin bileşimi, karbonik asitteki bir hidrojen atomunun yerini alan sodyum katyonu Na +'yı içerir. Anyonun bileşimi ve yükü - HCO3 -. Çözündüğünde, sodyum bikarbonat oluşturan iyonlara kısmi ayrışma meydana gelir. Yapısal formül şuna benzer:

Kabartma tozunun suda çözünürlüğü
100 gr suda 7,8 gr sodyum bikarbonat çözünür. Madde hidrolize uğrar:
NaHCO 3 \u003d Na ++ HCO 3 -;
H20 ↔ H++ + OH-;
Denklemleri toplarken, çözeltide hidroksit iyonlarının biriktiği ortaya çıkar (zayıf alkali reaksiyon). Sıvı fenolftaleini pembeye dönüştürür. Soda çözeltisindeki kağıt şeritler şeklindeki evrensel göstergelerin rengi sarı-turuncudan griye veya maviye değişir.
Diğer tuzlarla değişim reaksiyonu
Yeni elde edilen maddelerden birinin çözünmemesi koşuluyla, sulu bir sodyum bikarbonat çözeltisi diğer tuzlarla iyon değişim reaksiyonlarına girer; veya reaksiyon küresinden uzaklaştırılan bir gaz oluşur. Aşağıdaki diyagramda gösterildiği gibi kalsiyum klorür ile etkileşime girdiğinde hem beyaz bir kalsiyum sarbonat çökeltisi hem de karbondioksit elde edilir. Sodyum ve klorür iyonları çözeltide kalır. Moleküler reaksiyon denklemi:

İçme sodasının asitlerle etkileşimi
Sodyum bikarbonat asitlerle etkileşime girer. İyon değiştirme reaksiyonuna tuz ve zayıf karbonik asit oluşumu eşlik eder. Alındığı anda suya ve karbondioksite ayrışır (uçar).
İnsan midesinin duvarları iyon formunda bulunan hidroklorik asit üretir.
H+ ve Cl-. Sodyum bikarbonat ağızdan alınırsa, mide suyu çözeltisinde iyonların katılımıyla reaksiyonlar meydana gelir:
NaHCO 3 \u003d Na ++ HCO 3 -;
HCl \u003d H + + Cl -;
H20 ↔ H++ + OH-;
HCO3 - + H + \u003d H2O + CO2.
Doktorlar midenin aşırı asiditesi için sürekli olarak sodyum bikarbonat kullanılmasını önermezler. Hazırlık talimatları, sodanın günlük ve uzun süreli kullanımının çeşitli yan etkilerini listeler:
- artan kan basıncı;
- geğirme, mide bulantısı ve kusma;
- kaygı, zayıf uyku;
- iştah kaybı;
- karın ağrısı.

Kabartma tozu almak
Laboratuvarda soda külünden sodyum bikarbonat elde edilebilmektedir. Aynı yöntem daha önce kimyasal üretimde de kullanılıyordu. Modern endüstriyel yöntem, amonyağın karbondioksit ile etkileşimine ve kabartma tozunun soğuk sudaki düşük çözünürlüğüne dayanmaktadır. Amonyak ve karbondioksit (karbon dioksit), bir sodyum klorür çözeltisinden geçirilir. Amonyum klorür ve sodyum bikarbonat çözeltisi oluşur. Soğutulduğunda kabartma tozunun çözünürlüğü azalır, daha sonra madde filtrasyonla kolayca ayrılır.
Sodyum bikarbonat nerede kullanılır? Kabartma tozunun tıpta kullanımı
Birçok kişi metalik sodyum atomlarının suyla, hatta havadaki buharıyla bile güçlü bir etkileşime girdiğini biliyor. Reaksiyon aktif olarak başlar ve buna büyük miktarda ısının salınması (yanma) eşlik eder. Atomlardan farklı olarak sodyum iyonları, canlı bir organizmaya zarar vermeyen kararlı parçacıklardır. Tam tersine fonksiyonlarının düzenlenmesinde aktif rol alırlar.
İnsanlar için toksik olmayan ve birçok açıdan faydalı olan sodyum bikarbonat nasıl kullanılır? Uygulama kabartma tozunun fiziksel ve kimyasal özelliklerine dayanmaktadır. En önemli alanlar ev tüketimi, gıda endüstrisi, sağlık hizmetleri, geleneksel tıp ve içeceklerdir.
Sodyum bikarbonatın temel özellikleri arasında mide suyunun artan asitliğinin nötralizasyonu, mide suyunun hiperasiditesinde, mide ülseri ve duodenal ülserde ağrının kısa süreli ortadan kaldırılması yer alır. Kabartma tozu çözeltisinin antiseptik etkisi boğaz ağrısı, öksürük, zehirlenme, hareket hastalığının tedavisinde kullanılır. Onları ağız ve burunla, gözlerin mukozalarıyla yıkayın.

Sodyum bikarbonatın çeşitli dozaj formları, örneğin çözünmüş ve infüzyon için kullanılan tozlar yaygın olarak kullanılmaktadır. Hastalara oral uygulama için çözümler atayın, yanıkları asitlerle yıkayın. Sodyum bikarbonat ayrıca tablet ve rektal fitiller yapımında da kullanılır. Preparatlara yönelik talimatlar, farmakolojik etkinin ve endikasyonların ayrıntılı bir tanımını içerir. Kontrendikasyonların listesi çok kısadır - maddeye karşı bireysel hoşgörüsüzlük.
Evde karbonat kullanmak
Sodyum bikarbonat, mide yanması ve zehirlenme için bir "ambulanstır". Evde soda içmenin yardımıyla dişleri beyazlatın, sivilcelerdeki iltihabı azaltın, fazla yağlı salgıları gidermek için cildi silin. Sodyum bikarbonat suyu yumuşatır, çeşitli yüzeylerdeki kirlerin temizlenmesine yardımcı olur.
Yünlü trikoları elde yıkarken suya karbonat ekleyebilirsiniz. Bu madde kumaşın rengini tazeler ve ter kokusunu giderir. Çoğu zaman ipek ürünleri ütülerken ütüden sarı yanık izleri ortaya çıkar. Bu durumda kabartma tozu ve sudan oluşan bir bulamaç yardımcı olacaktır. Maddeler en kısa sürede karıştırılıp lekeye uygulanmalıdır. Yulaf ezmesi kuruduğunda fırçalanmalı ve ürün soğuk suyla durulanmalıdır.
Asetik asit ile reaksiyonda sodyum asetat elde edilir ve karbondioksit hızla salınarak tüm kütlenin köpürmesi sağlanır: NaHC03 + CH3COOH = Na + + CH3COO - + H20 + CO2. Bu işlem, gazlı içeceklerin ve şekerlemelerin imalatında kabartma tozunun sirke ile "sulandırıldığı" durumlarda meydana gelir.

Mağazadan satın alınan sentetik sirke değil limon suyu kullanırsanız, pişirmenin tadı daha yumuşak olacaktır. Aşırı durumlarda, 1/2 çay kaşığı karışımla değiştirebilirsiniz. sitrik asit tozu ve 1 yemek kaşığı. l. su. Hamurun hemen fırına verebilmesi için son malzemeler arasına asitli karbonat da eklenir. Sodyum bikarbonatın yanı sıra, bazen mayalama maddesi olarak amonyum bikarbonat da kullanılır.
Tamburun (7) içindeki hava, filtrelenmiş sıvı ve yıkama suyu ayırıcıya (11) gider, burada hava sıvı fazdan ayrılır ve PVFL'ye gider.
Ayırıcıdan (11) gelen süzüntü, barometrik tüpten (12) geçerek filtre sıvısının (13) toplanmasına gider ve buradan da damıtma için pompa (14) tarafından dışarı pompalanır.
Tambur döndüğünde, filtre yüzeyine yapışan sodyum bikarbonat tabakası, hava ve yıkama suyunun tambura girebileceği tortu yüzeyinde oluşan çatlakları ortadan kaldırmak için sıkma silindirinin (6) altına düşer. Sıkma silindirinden sonra çökelti, suyu yıkamak için basınç tankından (4) gelen zayıf bir sıvı veya suyla, suyu tamburun genişliği boyunca eşit bir akış halinde dağıtan oluğa (3) yıkanır. Yıkama için sağlanan su miktarı, basınç tankı (4) ile oluk (3) arasına monte edilen bir musluk tarafından düzenlenir. Yıkama suyu, tamburun içindeki filtre sıvısı ile karıştırılır ve onunla birlikte ayırıcıya (11) gider.
Yıkanan sodyum bikarbonat, tamburun dönme yönünde ikinci sıkma silindiri (6) tarafından tekrar sıkıştırılır, boru hattı (5) aracılığıyla sağlanan tortu tabakasından emilen hava ile kurutulur ve filtre bezinden bir bıçakla (8) kesilerek filtre bezine kadar kesilir. Soda fırınına ham sodyum bikarbonat sağlayan konveyör (10).
Sodyum bikarbonat kalsinasyonu
Kalsinasyon - sodyum bikarbonatın termal ayrışması - soda külü üretiminde son aşamadır. Kalsinasyon bölümünün temel amacı belli miktarda soda külünün sürekli bir malzeme akışı halinde elde edilmesidir.
Teknik sodyum bikarbonat beyaz olmalıdır. Rengin ortaya çıkması, emme ve karbonizasyon bölümlerindeki çelik kapların korozyonunu gösterir. Çökelti, korozyon sonucu içine giren demir oksit ile renklendirilir.
Kalsinasyon işlemi aşağıdaki denklemle gösterilebilir:
2 NaHCO3 (katı) \u003d Na2CO3 (katı) + CO2 (gaz) + H2O (buhar).
Bu ana reaksiyona ek olarak teknik bikarbonat ısıtıldığında başka reaksiyonlar da meydana gelebilir:
(NH4)2CO3↔2NH3(gaz)+CO2(gaz)+H2O(buhar),
NH4 HCO3↔2NH3(gaz)+CO2(gaz)+H2O(buhar).
Amonyum klorür, reaksiyona göre sodyum bikarbonat ile ısıtıldığında reaksiyona girer
NH4Cl (sol.) + NaHC03 (katı) ↔NaCl (katı) + NH3 (gaz) + CO2 (gaz) + H2O.
Sodyum karbamat su varlığında ısıtıldığında reaksiyona göre sodaya dönüşür.
2NaCO2NH2 + H2O ↔ Na2CO3 (katı) + CO2 (gaz) + 2NH3 (gaz).
Böylece kalsinasyon sonucunda Na2CO3 ve NaCl katı fazda kalırken, NH3, CO2 ve H2O gaz fazına geçer.
Islak sodyum bikarbonat düşük akışlı olduğundan, topaklaştığından ve cihazın duvarlarına yapıştığından, bikarbonattaki nemin varlığı enstrümantasyonu karmaşık hale getirir. İkincisi, doymuş bir NaHC03 çözeltisi olan nemin sıcak bir yüzeyle temas ettiğinde hızla buharlaşmasıyla açıklanmaktadır. Çöken katı faz kristalleşerek yüzeye sıkı bir şekilde yapışan bir kabuk oluşturur.
Isı iletkenliği düşük olan katı soda tabakası ısı transferini bozar ve baca gazları ile dışarıdan ısıtılan soda sobalarında fırın duvarının aşırı ısınmasına ve yanmasına neden olur. Bu olguyla mücadele etmek için ıslak sodyum bikarbonat, sıcak soda (retur) ile karıştırılır. Bu durumda yeni bir katı faz oluşur - trona (NaHCO3 Na2CO3 2H2O). Serbest nem kristalleşmeye bağlanır ve ürün serbest akışlı hale gelir.
Sodyum bikarbonat ve tronanın kalsinasyonu sırasında CO2, NH3 ve su buharı gaz fazına salınır. Amonyak ve karbondioksit üretime geri döndürülmelidir. Karbondioksit, yüksek CO2 içeriğine sahip bir gaza sahip olmanın faydalı olduğu amonyaklı tuzlu suyun karbonizasyonu sürecinde kullanılır.
Kristalizasyon süreci üç zaman dilimine ayrılabilir. İlk dönem sıcaklıktaki hızlı bir artışla karakterize edilir. Bikarbonatın ayrışması gözlenmez ve ısının tamamı malzemenin ısıtılması, tronadan kristalizasyon suyunun uzaklaştırılması ve karbon amonyum tuzlarının ayrıştırılması için harcanır. İkinci periyot malzemenin sıcaklığının sabit kalması (t~125°C) ile karakterize edilir. Sağlanan ısı, NaHCO3'ün termal ayrışmasına harcanır. üçüncü periyotta reaksiyon kütlesinin sıcaklığı keskin bir şekilde yükselmeye başlar. Bu, bikarbonatın ayrışma sürecinin sona erdiğini ve sağlanan ısının, elde edilen sodayı ısıtmak için harcandığını gösterir. Uygulamada, NaHC03'ün ayrışma sürecini hızlandırmak için fırın çıkışındaki soda sıcaklığı 140–160°C arasında tutulur.
Kalsinasyon sürecinin teknolojik şeması
Pirinç. 11. Kalsinasyon ayırma şeması:
1- buhar yoğunlaştırıcı; 2- besleme karıştırıcısı; 3.15 - hücre besleyicileri; 4.10 - bantlı konveyörler; 5 - titreşimli besleyici; 6 kanallı bunker; 7 pulluklu ejektör; 8,9,14,16 konveyör; 11-siklon; 12-kalsinasyon gazı toplayıcı; 13-ayırıcı; 17-yoğuşma toplayıcı; 18 santrifüj pompa; 19-zayıf sıvı toplayıcı; 20-kalsinasyon gazlı buzdolabı, 21-indirgeyici soğutma ünitesi (ROU); 22-kalsinasyon gazı yıkayıcı; 23-yıkama sıvısı toplayıcı.
Bir pulluk ejektörü (7) ile ortak bir bantlı konveyörden (10) filtreler üzerinde yıkanan ıslak sodyum bikarbonat, titreşimli besleyicinin (5) hunisine (6) beslenir, buradan titreşimli besleyici ve bantlı konveyör (4) aracılığıyla karıştırıcıya (2) beslenir. hücre besleyici 3. siklon 11'de.
Mikserde hazırlanan taht, kalsinatör tamburunun (1) halka şeklindeki boşluğuna gönderilir. Isıl işlem sonucunda tahtlar soda külü ve kalsinasyon gazlarını alır. Soda külü, hücre besleyicisi (15) aracılığıyla kalsinatörden çıkarılır ve konveyörler (8, 9, 16) sistemine girer. Soda, eğimli konveyörden (8) besleyici aracılığıyla karıştırıcıya alınır. Soda konveyörlerinin (9, 14) geri kalanı depoya beslenir.
Kalsinasyon gazları, bir kompresör aracılığıyla bir vakumun oluşturulduğu karıştırıcı 2 aracılığıyla kalsinatörden çıkarılır. Kompresöre giderken, gazlar siklonlarda (11) kuru temizlemeye ve atölye kalsinasyon gazı toplayıcısında (12) ve yıkayıcıda (22) ıslak temizlemeye tabi tutulur. Yıkayıcıdan önce, kalsinasyon gazları buzdolabında (20) soğutulur.
Sulama için, kalsinasyon gazı soğutucusunda su buharının yoğunlaşması sırasında oluşan kalsinasyon gazı toplayıcıya zayıf sıvı adı verilen sıvı verilir. Gazla temas halinde olan bu sıvı, amonyak ve soda tozunu kısmen emer ve daha sonra toplama 19'a boşalır.
Buzdolabında (20) gaz, halka şeklindeki boşluktan yukarıdan aşağıya doğru geçer ve soğutma suyu, tüplerin içinde ters akımla hareket eder. Buzdolabı tüplerinin kristalleşmesini önlemek ve gazı soda tozundan daha iyi temizlemek için halka şeklindeki boşluk zayıf bir sıvı ile sulanır. Yıkayıcıda gaz su ile sulanırken, ayrıca soğutulur ve soda ve amonyaktan tamamen yıkanır.
Kalsinatörü ısıtmak için yüksek basınçlı buhar sağlanır. Kalsinatöre beslenmeden önce, sıcaklığının 270°C'ye ve basıncın 3 MPa'ya düşürüldüğü bir indirgeme soğutma ünitesinden (ROU) geçer. Kalsinatörün tüplerinde buhar yoğunlaşarak kalsine edilmiş malzemeye ısı verir. Kalsinatörden gelen yoğuşma suyu, yoğuşma suyu toplayıcıya (17) ve ayrıca düşük basınçlı buhara dönüştürüldüğü genişleticilere boşaltılır.
Sodyum karbonat Na2C03. soda külü. Beyazdır, ısıtıldığında erir ve ayrışır. Havadaki neme ve karbondioksite karşı hassastır. Bir dekahidrat oluşturur ( kristal soda). Suda iyice çözünür, anyon üzerinde hidrolize olur, çözeltide kuvvetli alkali ortam oluşturur. Güçlü asitlerle ayrışır. Kola ile restore edildi. İyon değişim reaksiyonlarına girer.
Kalitatif reaksiyon CO 3 2- iyonunda - karbondioksit salınımıyla güçlü asitler (HCl, HNO3) tarafından ayrıştırılan beyaz bir baryum karbonat çökeltisinin oluşumu.
Sodyum bileşiklerinin sentezi, tatlı suyun "kalıcı" sertliğinin ortadan kaldırılması, cam, sabun ve diğer deterjanlar, selüloz, mineral boyalar ve emayelerin üretiminde kullanılır. Doğada yer salamuralarında, tuz göllerinin salamuralarında bulunur.
En önemli reaksiyonların denklemleri:

Fiş V endüstri (solva yolu, 1861–1863):
a) NH3 ve CO2 karışımı doymuş bir NaCl çözeltisinden geçirilir:
NaCl + NH3 + H2O + CO2 = NH4Cl + NaHC03 ↓
(bu koşullar altında kabartma tozu az çözünür);
b) NaHC03 çökeltisi dehidrasyona tabi tutulur ( kalsinasyon):
2NaHC03 = Na2CO3+ H 2 O + CO 2
Potasyum karbonat K2C03. Oksosol. teknik ad potas. Beyaz, higroskopik. Ayrışmadan erir, daha fazla ısıtıldığında ayrışır. Havadaki neme ve karbondioksite karşı hassastır. Suda çok iyi çözünür, anyon üzerinde hidrolize olur, çözeltide kuvvetli alkali ortam oluşturur. Güçlü asitlerle ayrışır. İyon değişim reaksiyonlarına girer.
Optik cam, sıvı sabun, mineral boyalar, birçok potasyum bileşiğinin üretiminde dehidrasyon maddesi olarak kullanılır.
En önemli reaksiyonların denklemleri:

Fiş V endüstri :
a) potasyum sülfatın ısıtılması [doğal hammaddeler - mineraller Cainit KMg(SO 4)Cl 3H 2 O ve şönit K 2 Mg (SO 4) 2 6H 2 O] CO atmosferinde sönmüş kireç Ca (OH) 2 ile (basınç = 15 atm):
K 2 SO 4 + Ca (OH) 2 + 2CO \u003d 2K (HCOO) + CaS04
b) potasyum format K(HCOO)'nun havada kalsinasyonu:
2K(HCOO) + O2 \u003d K2CO3 + H2O + CO2
Sodyum bikarbonat NaHC03. Asit oksosalt. teknik ad soda içmek. Beyaz gevşek toz. Hafif ısıtıldığında erimeden ayrışır, ıslandığında ise oda sıcaklığında ayrışmaya başlar. Suda orta derecede çözünelim, anyon üzerinde az miktarda hidrolize olur. Asitlerle ayrıştırılır, alkalilerle nötrleştirilir. İyon değişim reaksiyonlarına girer.
Kalitatif reaksiyon HCOd iyonu üzerinde - barit suyunun etkisi altında beyaz bir baryum karbonat çökeltisinin oluşumu ve çökeltinin karbondioksit salınımı ile güçlü asitlerle (HCl, HNO3) ayrışması. Gıda endüstrisinde ilaç olarak kullanılır.
En önemli reaksiyonların denklemleri:

Fiş: Na2C03 çözeltisinin (bkz.) karbondioksitle doyması.
Kalsiyum karbonat CaCO3. Oksosol. Yaygın bir doğal madde, tortul kayaçların ana bileşeni kireçtaşıdır (çeşitleri tebeşir, mermer, kalkerli tüf, marndır), doğada saf CaCO3 bir mineraldir kalsit. Beyaz, tutuşturulduğunda ayrışır, aşırı CO2 basıncı altında erir. Suda çözünmez (= 0,0007 g/100 g H2O).
Asitlerle, sıcak çözeltideki amonyum tuzlarıyla, kokla reaksiyona girer. Tatlı suyun "geçici" sertliğini (magnezyum ve demir tuzları ile birlikte) belirleyen bikarbonat Ca (HCO3)2 (yalnızca çözeltide bulunur) oluşumu ile fazla karbondioksitin etkisiyle çözeltiye aktarılır. Sertliğin giderilmesi (suyun yumuşatılması), kaynatma veya sönmüş kireç ile nötralizasyon yoluyla gerçekleştirilir.
CaO, CO2, çimento, cam ve mineral gübrelerin üretiminde kullanılır. kireç nitrat Ca (NO 3) 2 4H 2 O], kağıt ve kauçuk, inşaat taşı (kırma taş) ve beton ve arduvaz bileşeni için dolgu maddesi olarak, çökeltilmiş toz formunda - okul boya kalemleri, diş tozlarının imalatı için ve macunlar, badana odaları için karışımlar.
En önemli reaksiyonların denklemleri: