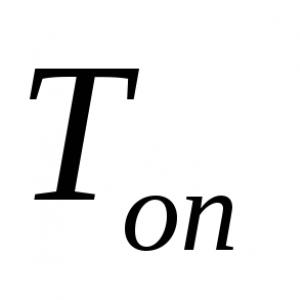Elektriksel iletkenlik, sulu bir çözeltinin elektrik akımını iletme yeteneğinin sayısal bir ifadesidir. Doğal suyun elektriksel iletkenliği temel olarak şunlara bağlıdır:
Uzunluk ve mesafe dönüştürücü Kütle dönüştürücü Toplu ürünlerin ve gıda ürünlerinin hacim ölçüleri dönüştürücüsü Alan dönüştürücü Mutfak tariflerinde hacim ve ölçü birimleri dönüştürücüsü Sıcaklık dönüştürücü Basınç, mekanik stres, Young modülü dönüştürücüsü Enerji ve iş dönüştürücüsü Güç dönüştürücüsü Kuvvet dönüştürücüsü Zaman dönüştürücü Doğrusal hız dönüştürücü Düz açı dönüştürücü termal verim ve yakıt verimliliği Çeşitli sayı sistemlerindeki sayıların dönüştürücüsü Bilgi miktarı ölçüm birimlerinin dönüştürücüsü Döviz kurları Kadın giyim ve ayakkabı bedenleri Erkek giyim ve ayakkabı bedenleri Açısal hız ve dönüş frekans dönüştürücü İvme dönüştürücü Açısal ivme dönüştürücü Yoğunluk dönüştürücü Özgül hacim dönüştürücü Atalet momenti dönüştürücü Kuvvet momenti dönüştürücü Tork dönüştürücü Yanma dönüştürücünün özgül ısısı (kütlece) Enerji yoğunluğu ve yanmanın özgül ısısı dönüştürücü (hacimce) Sıcaklık farkı dönüştürücü Isıl genleşme dönüştürücünün katsayısı Isıl direnç dönüştürücü Termal iletkenlik dönüştürücü Spesifik ısı kapasitesi dönüştürücü Enerjiye maruz kalma ve termal radyasyon güç dönüştürücü Isı akısı yoğunluğu dönüştürücü Isı transfer katsayısı dönüştürücü Hacim akış hızı dönüştürücü Kütle akış hızı dönüştürücü Molar akış hızı dönüştürücü Kütle akış yoğunluğu dönüştürücü Molar konsantrasyon dönüştürücü Çözelti dönüştürücüdeki kütle konsantrasyonu Dinamik (mutlak) viskozite dönüştürücü Kinematik viskozite dönüştürücü Yüzey gerilimi dönüştürücü Buhar geçirgenliği dönüştürücü Su buharı akış yoğunluğu dönüştürücü Ses seviyesi dönüştürücü Mikrofon hassasiyeti dönüştürücü Dönüştürücü Ses Basıncı Seviyesi (SPL) Seçilebilir Referans Basıncına sahip Ses Basıncı Seviyesi Dönüştürücü Parlaklık Dönüştürücü Işık Yoğunluğu Dönüştürücü Aydınlık Dönüştürücü Bilgisayar Grafikleri Çözünürlük Dönüştürücü Frekans ve Dalgaboyu Dönüştürücü Diyoptri Gücü ve Odak Uzaklığı Diyoptri Gücü ve Mercek Büyütme (×) Dönüştürücü elektrik yükü Doğrusal yük yoğunluğu dönüştürücü Yüzey yük yoğunluğu dönüştürücü Hacim yük yoğunluğu dönüştürücü Elektrik akımı dönüştürücü Doğrusal akım yoğunluğu dönüştürücü Yüzey akım yoğunluğu dönüştürücü Elektrik alan kuvveti dönüştürücü Elektrostatik potansiyel ve gerilim dönüştürücü Elektrik direnç dönüştürücü Elektrik direnç dönüştürücü Elektrik iletkenlik dönüştürücü Elektrik iletkenlik dönüştürücü Elektrik kapasitans Endüktans Dönüştürücü American Wire Gauge Converter dBm (dBm veya dBm), dBV (dBV), watt, vb. cinsinden seviyeler. birimler Manyetomotor kuvvet dönüştürücü Manyetik alan kuvveti dönüştürücü Manyetik akı dönüştürücü Manyetik indüksiyon dönüştürücü Radyasyon. İyonlaştırıcı radyasyon emilen doz hızı dönüştürücü Radyoaktivite. Radyoaktif bozunum dönüştürücü Radyasyon. Maruz kalma dozu dönüştürücü Radyasyon. Emilen doz dönüştürücü Ondalık önek dönüştürücü Veri aktarımı Tipografi ve görüntü işleme birimi dönüştürücü Kereste hacmi birim dönüştürücü Molar kütlenin hesaplanması D. I. Mendeleev tarafından kimyasal elementlerin periyodik tablosu
1 geleneksel elektrik iletkenlik birimi = metre başına 0,0001 siemens [S/m]
Başlangıç değeri
Dönüştürülen değer
metre başına siemens metre başına mo metre başına mo santimetre başına abmo metre başına abmo santimetre başına statmo metre başına statmo santimetre başına siemens santimetre başına milisiemens metre başına milisiemens santimetre başına mikrosiemens metre başına mikrosiemens santimetre başına geleneksel elektrik iletkenliği birimi geleneksel elektrik iletkenliği katsayısı ppm , katsayısı. yeniden hesaplama 700 ppm, katsayı. yeniden hesaplama 500 ppm, katsayı. yeniden hesaplama 640 TDS, ppm, katsayı. yeniden hesaplama 640 TDS, ppm, katsayı. yeniden hesaplama 550 TDS, ppm, katsayı. yeniden hesaplama 500 TDS, ppm, katsayı. yeniden hesaplama 700
Elektrik iletkenliği hakkında daha fazla bilgi
Giriş ve Tanımlar
Elektriksel iletkenlik (veya elektriksel iletkenlik) bir maddenin elektrik akımını iletme veya içindeki elektrik yüklerini hareket ettirme yeteneğinin bir ölçüsüdür. Bu, akım yoğunluğunun elektrik alan kuvvetine oranıdır. Bir kenarı 1 metre olan iletken malzemeden bir küp düşünürsek, iletkenlik bu küpün iki zıt tarafı arasında ölçülen elektrik iletkenliğine eşit olacaktır.
Spesifik iletkenlik aşağıdaki formülle iletkenlikle ilişkilidir:
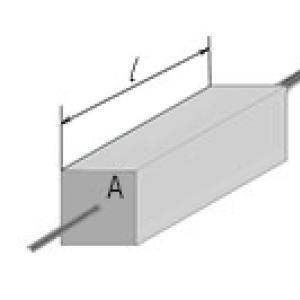
G = σ(A/l)

Nerede G- elektiriksel iletkenlik, σ - spesifik elektrik iletkenliği, A- iletkenin elektrik akımı yönüne dik kesiti ve ben- iletkenin uzunluğu. Bu formül herhangi bir silindir veya prizma şeklindeki iletkenle kullanılabilir. Bu formülün dikdörtgen paralel boru için de kullanılabileceğini unutmayın, çünkü bu, tabanı dikdörtgen olan prizmanın özel bir durumudur. Elektriksel iletkenliğin elektriksel direncin karşılığı olduğunu hatırlayalım.
Bir iletkenin iletkenliği ile bir maddenin spesifik iletkenliği arasındaki farkı anlamak fizik ve teknolojiden uzak insanlar için zor olabilir. Bu arada elbette bunlar farklı fiziksel büyüklüklerdir. İletkenlik, belirli bir iletkenin veya cihazın (bir direnç veya kaplama banyosu gibi) bir özelliği iken iletkenlik, o iletkenin veya cihazın yapıldığı malzemenin doğal bir özelliğidir. Örneğin, bakır bir nesnenin şekli ve boyutu ne kadar değişirse değişsin, bakırın iletkenliği her zaman aynıdır. Aynı zamanda bakır telin iletkenliği uzunluğuna, çapına, kütlesine, şekline ve diğer bazı faktörlere bağlıdır. Elbette, daha yüksek iletkenliğe sahip malzemelerden yapılmış benzer nesneler daha yüksek iletkenliğe sahiptir (her zaman olmasa da).

Uluslararası Birimler Sisteminde (SI), elektriksel iletkenlik birimi Metre başına Siemens (S/m). İçinde yer alan iletkenlik birimi, Alman bilim adamı, mucit ve girişimci Werner von Siemens'in (1816–1892) adını almıştır. 1847 yılında onun tarafından kurulan Siemens AG (Siemens), elektrik, elektronik, enerji, ulaşım ve tıbbi ekipman üreten en büyük şirketlerden biridir.

Elektriksel iletkenlik aralığı çok geniştir: cam (bu arada kırmızı ısıtıldığında elektriği iyi iletir) veya polimetil metakrilat (pleksiglas) gibi yüksek dirence sahip malzemelerden gümüş, bakır veya altın gibi çok iyi iletkenlere kadar. Elektriksel iletkenlik, yüklerin (elektronlar ve iyonlar) sayısı, hareket hızları ve taşıyabilecekleri enerji miktarı ile belirlenir. Örneğin kaplama banyolarında kullanılan çeşitli maddelerin sulu çözeltileri ortalama iletkenlik değerlerine sahiptir. Ortalama iletkenlik değerlerine sahip elektrolitlere bir diğer örnek ise vücudun iç ortamıdır (kan, plazma, lenf ve diğer sıvılar).
Metallerin, yarı iletkenlerin ve dielektriklerin iletkenliği, Physical Quantity Converter web sitesinin aşağıdaki makalelerinde ayrıntılı olarak ele alınmaktadır: ve Elektriksel iletkenlik. Bu yazıda elektrolitlerin spesifik iletkenliğinin yanı sıra bunu ölçmek için yöntemler ve basit ekipmanı daha ayrıntılı olarak tartışacağız.
Elektrolitlerin spesifik elektriksel iletkenliği ve ölçümü

Yüklü iyonların hareketi sonucu bir elektrik akımının ortaya çıktığı sulu çözeltilerin spesifik iletkenliği, yük taşıyıcıların sayısı (çözeltideki maddenin konsantrasyonu), hareket hızları (iyonların hareketliliği) ile belirlenir. sıcaklığa bağlıdır) ve taşıdıkları yüke (iyonların değerliğine göre belirlenir). Bu nedenle çoğu sulu çözeltide konsantrasyondaki bir artış iyon sayısında bir artışa ve dolayısıyla iletkenlikte bir artışa yol açar. Ancak belirli bir maksimuma ulaştıktan sonra çözeltinin spesifik iletkenliği, çözelti konsantrasyonunun daha da artmasıyla azalmaya başlayabilir. Bu nedenle aynı tuzun iki farklı konsantrasyonuna sahip çözeltiler aynı iletkenliğe sahip olabilir.
Sıcaklık aynı zamanda iletkenliği de etkiler çünkü sıcaklık arttıkça iyonlar daha hızlı hareket eder ve bu da iletkenliğin artmasına neden olur. Saf su zayıf bir elektrik iletkenidir. Dengede havadaki karbondioksiti içeren ve toplam mineralizasyonu 10 mg/l'den az olan sıradan damıtılmış suyun özgül elektrik iletkenliği yaklaşık 20 mS/cm'dir. Çeşitli çözeltilerin spesifik iletkenliği aşağıdaki tabloda verilmiştir.


Bir çözeltinin spesifik iletkenliğini belirlemek için bir direnç ölçer (ohmmetre) veya iletkenlik kullanılır. Bunlar neredeyse aynı cihazlardır, yalnızca ölçek açısından farklılık gösterir. Her ikisi de devrenin, elektrik akımının cihazın pilinden aktığı bölümündeki voltaj düşüşünü ölçer. Ölçülen iletkenlik değeri manuel veya otomatik olarak belirli iletkenliğe dönüştürülür. Bu, ölçüm cihazının veya sensörün fiziksel özellikleri dikkate alınarak yapılır. İletkenlik sensörleri basittir: bir elektrolite batırılmış bir çift (veya iki çift) elektrottur. İletkenliği ölçmek için sensörler aşağıdakilerle karakterize edilir: iletkenlik sensörü sabiti en basit durumda elektrotlar arasındaki mesafenin oranı olarak tanımlanır D akım akışına dik olan alana (elektrot) A
Bu formül, elektrotların alanı aralarındaki mesafeden önemli ölçüde daha büyükse işe yarar, çünkü bu durumda elektrik akımının çoğu elektrotlar arasında akar. Örnek: 1 santimetreküp sıvı için K = D/A= 1 cm/1 cm² = 1 cm⁻¹. Nispeten büyük bir mesafe boyunca aralıklı küçük elektrotlara sahip iletkenlik sensörlerinin, 1,0 cm⁻¹ ve daha yüksek sensör sabit değerleri ile karakterize edildiğini unutmayın. Aynı zamanda, birbirine yakın yerleştirilmiş nispeten büyük elektrotlara sahip sensörlerin sabiti 0,1 cm⁻¹ veya daha azdır. Çeşitli cihazların elektrik iletkenliğini ölçmek için kullanılan sensör sabiti 0,01 ile 100 cm⁻¹ arasında değişir.

Teorik sensör sabiti: sol - k= 0,01 cm⁻¹, sağ - k= 1 cm⁻¹
Ölçülen iletkenlikten iletkenliği elde etmek için aşağıdaki formül kullanılır:
σ = K ∙ G
σ - S/cm cinsinden çözeltinin spesifik iletkenliği;
k- cm⁻¹ cinsinden sensör sabiti;
G- Siemens'teki sensörün iletkenliği.
Sensör sabiti genellikle geometrik boyutlarından hesaplanmaz, ancak belirli bir ölçüm cihazında veya iletkenliği bilinen bir çözüm kullanılarak belirli bir ölçüm düzeneğinde ölçülür. Ölçülen bu değer, çözeltinin ölçülen iletkenlik veya direnç değerlerinden iletkenliği otomatik olarak hesaplayan iletkenlik ölçere girilir. İletkenliğin çözeltinin sıcaklığına bağlı olması nedeniyle, bunu ölçen cihazlar genellikle sıcaklığı ölçen ve ölçümlerin otomatik sıcaklık telafisini sağlayan, yani sonuçları 25 ° C'lik standart bir sıcaklığa normalleştiren bir sıcaklık sensörü içerir. .
İletkenliği ölçmenin en basit yolu, bir çözeltiye batırılmış iki düz elektrota voltaj uygulamak ve akan akımı ölçmektir. Bu yönteme potansiyometrik denir. Ohm kanununa göre iletkenlik G akımın oranı BEN gerilime sen:
Ancak her şey yukarıda anlatıldığı kadar basit değildir; iletkenliği ölçerken birçok sorun vardır. Doğru akım kullanıldığında iyonlar elektrotların yüzeylerinde toplanır. Ayrıca elektrotların yüzeylerinde kimyasal reaksiyon meydana gelebilir. Bu durum elektrot yüzeylerinde polarizasyon direncinin artmasına ve dolayısıyla hatalı sonuçlara yol açmaktadır. Örneğin bir sodyum klorür çözeltisinin direncini geleneksel bir test cihazıyla ölçmeye çalışırsanız, dijital cihazın ekranındaki okumaların artan direnç yönünde nasıl hızla değiştiğini açıkça göreceksiniz. Polarizasyonun etkisini ortadan kaldırmak için genellikle dört elektrottan oluşan bir sensör tasarımı kullanılır.
Ölçüm sırasında doğru akım yerine alternatif akım kullanırsanız ve hatta iletkenliğe bağlı olarak frekansı ayarlarsanız polarizasyon da önlenebilir veya her durumda azaltılabilir. Düşük frekanslar, polarizasyonun etkisinin küçük olduğu düşük iletkenliği ölçmek için kullanılır. Yüksek iletkenlikleri ölçmek için daha yüksek frekanslar kullanılır. Tipik olarak frekans, ölçüm işlemi sırasında çözeltinin elde edilen iletkenlik değerleri dikkate alınarak otomatik olarak ayarlanır. Modern dijital iki elektrotlu iletkenlik ölçerler genellikle karmaşık AC akım dalga formlarını ve sıcaklık telafisini kullanır. Fabrikada kalibre edilirler ancak ölçüm hücresinin (sensör) sabiti zamanla değiştiğinden, çalışma sırasında sıklıkla yeniden kalibrasyon gerekir. Örneğin sensörler kirlendiğinde veya elektrotlar fiziksel ve kimyasal değişikliklere uğradığında değişebilir.
Geleneksel iki elektrotlu iletkenlik ölçerde (deneyimizde kullanacağımız cihaz budur), iki elektrot arasına alternatif bir voltaj uygulanır ve elektrotlar arasında akan akım ölçülür. Bu basit yöntemin bir dezavantajı vardır; yalnızca çözümün direnci değil, aynı zamanda elektrotların polarizasyonunun neden olduğu direnç de ölçülür. Polarizasyonun etkisini en aza indirmek için dört elektrotlu bir sensör tasarımının yanı sıra elektrotların platin siyahı ile kaplanması kullanılır.
Genel mineralizasyon
Elektriksel iletkenlik ölçüm cihazları genellikle belirlemek için kullanılır. toplam mineralizasyon veya katı madde içeriği(İng. toplam çözünmüş katılar, TDS). Bir sıvının çeşitli formlarda içerdiği organik ve inorganik maddelerin toplam miktarının ölçüsüdür: iyonize, moleküler (çözünmüş), koloidal ve süspansiyon halinde (çözünmemiş). Çözünen maddeler herhangi bir inorganik tuzu içerir. Bunlar esas olarak kalsiyum, potasyum, magnezyum, sodyumun klorürleri, bikarbonatları ve sülfatlarının yanı sıra suda çözünmüş bazı organik maddelerdir. Maddelerin toplam mineralizasyon olarak sınıflandırılabilmesi için ya çözünmüş olması ya da gözenek çapı 2 mikrometreden küçük olan filtrelerden geçen çok ince parçacıklar halinde olması gerekir. Çözeltide sürekli askıda kalan ancak böyle bir filtreden geçemeyen maddelere denir. askıda katı maddeler(İng. toplam askıda katı madde, TSS). Toplam askıda katı maddeler genellikle su kalitesini belirlemek için ölçülür.

Katı içeriğini ölçmek için iki yöntem vardır: gravimetrik analiz En doğru yöntem olan ve iletkenlik ölçümü. İlk yöntem en doğrudur, ancak kuru bir kalıntı elde etmek için suyun buharlaştırılması gerektiğinden çok fazla zaman ve laboratuvar ekipmanı gerektirir. Bu genellikle laboratuvar koşullarında 180°C'de yapılır. Tamamen buharlaştıktan sonra kalıntı hassas bir terazide tartılır.
İkinci yöntem gravimetrik analiz kadar doğru değildir. Ancak ucuz bir ölçüm cihazı ile birkaç saniyede gerçekleştirilen basit bir iletkenlik ve sıcaklık ölçümü olduğundan oldukça kullanışlı, yaygın ve en hızlı yöntemdir. Spesifik elektrik iletkenliğini ölçme yöntemi, suyun spesifik iletkenliğinin doğrudan içinde çözünen iyonize maddelerin miktarına bağlı olması nedeniyle kullanılabilir. Bu yöntem özellikle içme suyunun kalitesini izlemek veya bir çözeltideki toplam iyon sayısını tahmin etmek için uygundur.
Ölçülen iletkenlik çözeltinin sıcaklığına bağlıdır. Yani, sıcaklık arttıkça iletkenlik de artar, çünkü çözeltideki iyonlar sıcaklık arttıkça daha hızlı hareket eder. Sıcaklıktan bağımsız ölçümler elde etmek için, ölçüm sonuçlarının indirgendiği standart (referans) sıcaklık kavramı kullanılır. Referans sıcaklığı, farklı sıcaklıklarda elde edilen sonuçları karşılaştırmanıza olanak tanır. Böylece, bir iletkenlik ölçer gerçek iletkenliği ölçebilir ve ardından sonucu otomatik olarak 20 veya 25°C'lik bir referans sıcaklığa ayarlayacak bir düzeltme fonksiyonu kullanabilir. Çok yüksek doğruluk gerekiyorsa, numune bir inkübatöre yerleştirilebilir ve ardından ölçüm cihazı, ölçümlerde kullanılacak sıcaklıkta kalibre edilebilir.
Çoğu modern iletkenlik ölçer, hem sıcaklık düzeltmesi hem de sıcaklık ölçümü için kullanılan yerleşik bir sıcaklık sensörüne sahiptir. En gelişmiş cihazlar, ölçülen değerleri iletkenlik, direnç, tuzluluk, toplam tuzluluk ve konsantrasyon birimlerinde ölçme ve görüntüleme yeteneğine sahiptir. Ancak tüm bu cihazların yalnızca iletkenlik (direnç) ve sıcaklığı ölçtüğünü bir kez daha belirtelim. Ekranda gösterilen tüm fiziksel büyüklükler, otomatik sıcaklık kompanzasyonu ve ölçülen değerlerin standart sıcaklığa getirilmesi için kullanılan, ölçülen sıcaklık dikkate alınarak cihaz tarafından hesaplanır.
Deney: toplam mineralizasyon ve iletkenliğin ölçülmesi
Son olarak, ucuz bir TDS-3 toplam mineralizasyon ölçer (aynı zamanda salinometre, salinometre veya iletkenlik ölçer olarak da bilinir) kullanarak iletkenliği ölçmek için çeşitli deneyler gerçekleştireceğiz. "İsimsiz" TDS-3 cihazının eBay'deki fiyatı, bu yazının yazıldığı sırada teslimat dahil 3,00 ABD Dolarından azdır. Tamamen aynı cihaz, ancak üreticinin adıyla birlikte, 10 kat daha pahalı. Ancak her iki cihazın da aynı fabrikada üretilme ihtimali çok yüksek olsa da bu, markaya para ödemeyi sevenler için. TDS-3 sıcaklık dengelemesi yapar ve bu amaçla elektrotların yanında bulunan bir sıcaklık sensörüyle donatılmıştır. Bu nedenle termometre olarak da kullanılabilir. Cihazın aslında mineralizasyonun kendisini değil, iki tel elektrot arasındaki direnci ve çözeltinin sıcaklığını ölçtüğünü bir kez daha belirtmek gerekir. Kalibrasyon faktörlerini kullanarak diğer her şeyi otomatik olarak hesaplar.

Toplam mineralizasyon ölçer, örneğin içme suyunun kalitesini izlerken veya bir akvaryumdaki veya tatlı su havuzundaki suyun tuzluluğunu belirlerken katı madde içeriğini belirlemenize yardımcı olabilir. Filtrenin veya membranın ne zaman değiştirilme zamanının geldiğini bilmek için su filtreleme ve arıtma sistemlerindeki su kalitesini izlemek için de kullanılabilir. Cihaz fabrikada 342 ppm (milyonda parça veya mg/L) sodyum klorür çözeltisi NaCl ile kalibre edilmiştir. Cihazın ölçüm aralığı 0–9990 ppm veya mg/l'dir. PPM - milyon başına parça, temel göstergenin 1 10⁻⁶'sine eşit, göreceli değerlerin boyutsuz bir ölçüm birimi. Örneğin, 5 mg/kg'lık bir kütle konsantrasyonu = 1.000.000 mg'da 5 mg = 5 ppm veya ppm. Yüzdenin yüzde biri olduğu gibi, ppm de milyonda birdir. Yüzdeler ve ppm anlam olarak birbirine çok benzer. Yüzdelerin aksine milyon başına parça, çok zayıf çözeltilerin konsantrasyonunu belirtmek için kullanışlıdır.
Cihaz, iki elektrot arasındaki elektriksel iletkenliği (yani direncin tersini) ölçer, ardından yukarıdaki iletkenlik formülünü kullanarak, sensör sabitini hesaba katarak sonucu spesifik elektriksel iletkenliğe (İngilizce literatürde EC kısaltması sıklıkla kullanılır) dönüştürür. K, daha sonra elde edilen iletkenliği 500 dönüşüm faktörüyle çarparak başka bir dönüşüm gerçekleştirir. Sonuç, milyonda bir (ppm) cinsinden toplam tuzluluk değeridir. Bununla ilgili daha fazla ayrıntıyı aşağıda bulabilirsiniz.

Bu toplam mineralizasyon ölçer, yüksek tuz içeriğine sahip suyun kalitesini test etmek için kullanılamaz. Yüksek tuz içeriğine sahip maddelere örnek olarak bazı gıdalar (normal tuz içeriği 10 g/l olan normal çorba) ve deniz suyu verilebilir. Bu cihazın ölçebildiği maksimum sodyum klorür konsantrasyonu 9990 ppm veya yaklaşık 10 g/l'dir. Bu, gıdalardaki tipik tuz konsantrasyonudur. Bu cihaz aynı zamanda deniz suyunun tuzluluğunu da ölçemez; zira tuzluluk genellikle 35 g/l veya 35.000 ppm olup cihazın ölçebileceğinden çok daha yüksektir. Bu kadar yüksek bir konsantrasyonu ölçmeye çalışırsanız cihaz Err hata mesajını görüntüleyecektir.
TDS-3 tuzluluk ölçer spesifik iletkenliği ölçer ve kalibrasyon ve konsantrasyona dönüştürme için "500 ölçeği" (veya "NaCl ölçeği") adı verilen ölçeği kullanır. Bu, ppm konsantrasyonunu elde etmek için mS/cm cinsinden iletkenlik değerinin 500 ile çarpılması anlamına gelir. Yani örneğin 1,0 mS/cm 500 ile çarpılarak 500 ppm elde edilir. Farklı endüstriler farklı ölçekler kullanır. Örneğin hidroponikte üç ölçek kullanılır: 500, 640 ve 700. Aralarındaki tek fark kullanımdır. 700 ölçeği, bir çözeltideki potasyum klorür konsantrasyonunun ölçülmesine dayanır ve spesifik iletkenliğin konsantrasyona dönüşümü aşağıdaki şekilde gerçekleştirilir:
1,0 mS/cm x 700, 700 ppm verir
640 ölçeği, mS'yi ppm'ye dönüştürmek için 640 dönüşüm faktörünü kullanır:
1,0 mS/cm x 640, 640 ppm verir
Deneyimizde öncelikle damıtılmış suyun toplam mineralizasyonunu ölçeceğiz. Tuzluluk ölçer 0 ppm'yi gösteriyor. Multimetre 1,21 MOhm'luk bir direnç gösterir.

Deney için konsantrasyonu 1000 ppm olan bir sodyum klorür NaCl çözeltisi hazırlayacağız ve konsantrasyonu TDS-3 kullanarak ölçeceğiz. 100 ml çözelti hazırlamak için 100 mg sodyum klorürü çözüp 100 ml'ye damıtılmış su eklememiz gerekir. 100 mg sodyum klorürü tartın ve bir ölçüm silindirine yerleştirin, biraz damıtılmış su ekleyin ve tuz tamamen eriyene kadar karıştırın. Daha sonra 100 ml işaretine kadar su ekleyin ve tekrar iyice karıştırın.
TDS-3 elektrotlarıyla aynı malzemeden ve aynı boyutlarda yapılmış iki elektrot arasındaki direncin ölçümü; multimetre 2,5 kOhm'u gösteriyor
İletkenliği deneysel olarak belirlemek için TDS-3 elektrotlarıyla aynı malzemeden yapılmış ve aynı boyutlarda iki elektrot kullandık. Ölçülen direnç 2,5 KOhm idi.
Artık sodyum klorürün direncini ve ppm konsantrasyonunu bildiğimize göre, yukarıdaki formülü kullanarak TDS-3 tuzluluk ölçerin hücre sabitini yaklaşık olarak hesaplayabiliriz:
K = σ/G= 2 mS/cm x 2,5 kOhm = 5 cm⁻¹

Bu 5 cm⁻¹ değeri, aşağıda belirtilen elektrot boyutlarıyla TDS-3 ölçüm hücresinin hesaplanan sabit değerine yakındır (bkz. şekil).
- D = 0,5 cm - elektrotlar arasındaki mesafe;
- W = 0,14 cm - elektrotların genişliği
- L = 1,1 cm - elektrotların uzunluğu
TDS-3 sensör sabiti K = D/A= 0,5/0,14x1,1 = 3,25 cm⁻¹. Bu yukarıda elde edilen değerden pek farklı değildir. Yukarıdaki formülün sensör sabitinin yalnızca yaklaşık bir tahminine izin verdiğini hatırlayalım.
Ölçü birimlerini bir dilden diğerine çevirmeyi zor mu buluyorsunuz? Meslektaşlarınız size yardım etmeye hazır. TCTerms'e bir soru gönderin ve birkaç dakika içinde bir cevap alacaksınız.
Elektrolitlerin üzerlerine elektrik akımı uygulandığında iletken hale gelme yeteneğine elektrolitik iletkenlik denir. Sulu çözeltilerle ilgili baz elektrolitlerin yanı sıra tuz ve asit elektrolitlerini de ele alalım. Bu maddeler, elektrolitik ayrışma 2 nedeniyle içlerinde oluşan anyonların (negatif yüklü iyonlar) ve katyonların (pozitif yüklü iyonlar) konsantrasyonunun oldukça yüksek olması bakımından farklılık gösterir. Elektrolit çözeltileri ikinci tip iletkenlere aittir. Birinci iletken grubunun aksine, elektrik alanındaki iletkenlikleri iyonik aktiviteden kaynaklanmaktadır.
İletkenler (R) direncine sahiptir. Ohm kanununa göre bu miktar iletkenin uzunluğuyla doğru orantılıdır ( ben ) ve kesitinin alanı (S) ile ters orantılıdır. Orantılılık katsayısı - 1 cm2 kesitli santimetre uzunluğunda bir iletkenin direncinin (ρ) bir göstergesi:
Elektriksel iletkenlik Cm (S) olarak belirlenmiştir ve SI birimlerinde - siemens cinsinden ölçülür. Şu ifadeyi elde ederiz: Ohm −1 = kg −1 .m −2 .s 3 A 2 .
Ayırt etmek elektriksel iletkenliğe özgü ( k- kappa) ve azı dişleriya da başka eş değer ( Λ - lambda) 3 .
Not 1: Konsantrasyonlar çözeltinin kilogramı başına gram cinsinden verilmiştir.
Not 2:"Elektrolitik ayrışma" terimi çözünebilir maddenin katyonlarına ve anyonlarına kısmi veya tam moleküler ayrışmayı belirtir.
Not 3: “Eşdeğer elektrik iletkenliği” teriminin kullanılması önerilmez. Temel, Temel ve Uygulamalı Kimya Birliği Komisyonu tarafından hazırlanan talimatlardır. IUPAC uluslararası elektrokimyasal terminoloji bu terimi benimsemiştir. "molar iletkenlik".
1. Elektrik iletkenliği
Elektrolit çözeltilerinin akımı iletme yeteneğini ölçmek için kullanılır. Spesifik direncin tersidir - birbirinden santimetre mesafeye yerleştirilmiş 1 cm2'lik elektrotlar arasındaki boşluğu dolduran çözeltinin bir göstergesi:


Bu değer elektrolit çözeltisinin doğasına, sıcaklığına ve doygunluğuna göre belirlenir. Spesifik elektriksel iletkenlik, artan sıcaklıkla birlikte artar; bu, bu tür elektrolitlerin birinci tür iletkenlerle karşılaştırıldığında ayırt edici bir özelliğidir. İyonların çözünmesindeki azalma ve çözeltinin viskozitesindeki azalma nedeniyle iyonların hareket hızı artar.
Şekil 1, spesifik elektrik iletkenliğinin çözeltilerin konsantrasyonuna bağlı olarak nasıl değiştiğini açıkça göstermektedir. Bu değerin ölçü birimi S/m – siemens per metredir (1 S/m = 1 Ohm-1m-1). En yaygın kullanılan türev µS/cm'dir.
Spesifik elektriksel iletkenlik ilk önce doygunluğun artmasıyla artar ve belirli bir maksimuma ulaştıktan sonra azalır. Güçlü elektrolitler için bağımlılığın açıkça ifade edildiği, ancak zayıf çözeltiler için bu bağımlılığın çok daha zayıf olduğu belirtilmelidir. Güçlü çözeltilerin eğrilerinde sınırlayıcı değerlere sahip göstergelerin varlığı, seyreltik elektrolitlerdeki iyonik hareket hızının doygunluklarına yalnızca biraz bağlı olduğunu ve başlangıçta iyon sayısıyla doğru orantılı olarak arttığını gösterir. Konsantrasyon arttıkça iyonların etkileşimi artar ve bu da hareket hızının azalmasına yol açar. Zayıf elektrolit eğrisindeki maksimum bölüm, konsantrasyondaki artışın neden olduğu ayrışma derecesindeki azalmadan kaynaklanmaktadır. Belirli bir doygunluğa ulaşıldığında konsantrasyon, çözeltideki iyonların sayısal içeriğinden daha hızlı artar. İyonik etkileşimin ve elektrolitlerin doygunluğunun elektriksel iletkenlikleri üzerindeki etkisini tanımlamak için “kavramı”molar iletkenlik ».
2. Molar iletkenlik
Λ (elektriksel iletkenlik molar- notu gör 4) - birbirinden santimetre mesafeye yerleştirilmiş elektrotlar arasına yerleştirilen 1 mol madde içeriğine sahip bir iletken için elektrolit direncinin karşılıklı değeri. Molar elektrik iletkenliği ile çözeltinin molar konsantrasyonu (M) ve spesifik elektrik iletkenliği (K) arasındaki ilişkiyi belirlemek için aşağıdaki ilişki türetilir:

Not 4: 1N elektrolit çözeltisinin elektriksel iletkenliği ismindeeş değer (Λ = 1000 İLE /N). Konsantrasyon (N) g-eq/l cinsinden ifade edilir. Ancak IUPAC talimatları “eşdeğer elektrik iletkenliği” teriminin kullanılmasını önermemektedir.
Hem güçlü hem de zayıf elektrolitlere göre molar elektriksel iletkenlik, konsantrasyonun azalmasıyla birlikte ilerler (yani çözeltinin doygunluğunun azalmasıyla (V = 1/M), elektriksel iletkenliği artar). Sınıra ulaşıyorΛ 0. Bu maksimuma denirsonsuz seyreltmede molar elektrik iletkenliği.
 Zayıf elektrolitler için (Şekil 2), bu değerin konsantrasyona bağımlılığı esas olarak elektrolit çözeltisinin seyreltilmesinin neden olduğu ayrışma derecesindeki artışla belirlenir. Güçlü elektrolitlerde doygunluk azaldıkça iyonların etkileşimi zayıflar. Hareketlerinin yoğunluğu artıyor, bu daçözeltinin molar elektrik iletkenliğini arttırmak.
Zayıf elektrolitler için (Şekil 2), bu değerin konsantrasyona bağımlılığı esas olarak elektrolit çözeltisinin seyreltilmesinin neden olduğu ayrışma derecesindeki artışla belirlenir. Güçlü elektrolitlerde doygunluk azaldıkça iyonların etkileşimi zayıflar. Hareketlerinin yoğunluğu artıyor, bu daçözeltinin molar elektrik iletkenliğini arttırmak.
F. Kohlrausch tarafından yapılan araştırma, sonsuz seyreltilmiş çözeltilerde (nihai seyreltme) her iyonun elektrolitlerin molar elektrik iletkenliğine nasıl katkıda bulunduğunu göstermektedir. λ0'ın (sınırlı iyonik iletkenlik) katyon ve anyon tarafından sergilenen molar iletkenliklerin toplamı olduğunu belirledi ve ayrıca formülasyonu türetti.İyon hareketinin bağımsızlığı yasası:
Sonsuz elektrolit seyreltmesinde molar elektrik iletkenliği, elektrolitik çözeltideki katyonik ve anyonik hareketliliklerin toplamına eşittir:
Λ 0 = K 0 + + K 0 - (4)
3. Bir çözeltinin elektriksel iletkenliğini belirleyen faktörler
Tuz konsantrasyonu ve sıcaklık, sulu elektrik iletkenliğini belirleyen ana faktörlerdir. Doğada suyun ana mineral bileşeni:
Katyonlar K+, Na+, Mg2+, Ca2+;
Anyonlar HCO 3 - , Cl - , SO 4 2- .
Diğer iyonlar da mevcuttur (Al 3+, Fe 3+, Mn 2+, Fe 2+, H 2 PO 4 -, NO 3 -, HPO 4 2-), ancak bunların elektriksel iletkenlik üzerindeki etkisi önemsizdir, çünkü genellikle su içeriği azdır. Elektriksel iletkenlik değerleri, mineralizasyon seviyesini değerlendirmemizi sağlar. Doğada, suyun spesifik elektriksel iletkenliği 50 ila 1000 mg/l tuzluluk oranıyla 100-2000 µS/cm'dir (yağışta -10-120 µS/cm ve 3-60 mg/l tuzluluk).
4. Elektrik iletkenliği. Hesaplamaların yapılması
Formül 3 ve 4'ü uygulamak ve iyonik elektriksel iletkenlik göstergelerini el altında bulundurmak ( İLE), elektriksel iletkenliği hesaplamak mümkündür ( İLE VeΛ ) herhangi bir çözüm için:
K = (K + + K - ) M /1000 (5)
Burada verilen Tablo 1'de seyreltik çözeltilerde (sıcaklık +18°C) yaygın olarak oluşan iyonların karakteristik iyonik ve sınırlayıcı iyonik elektrik iletkenliklerini bulabilirsiniz.
tablo 1

Örnek 1: Spesifik elektriksel iletkenliğe (K) dayalı hesaplamalar yapmak gerekir. KCl çözeltisi (potasyum klorür) 0,0005 M.
Çözüm: KCl'nin sulu çözeltilerde ayrışması K + ve Cl - iyonlarına meydana gelir. Referans kitabını veya Tablo 6'da verilen verileri kullanarak seyreltilmiş çözeltilerde 18°C'deki iyonik elektriksel iletkenlik göstergelerini buluyoruz:
K+ - iyon konsantrasyonu 0,0005 M (λ = 63,7 Ohm -1 cm2 mol -1);
Cl - - iyon konsantrasyonu 0,0005 M (λ = 64,4 Ohm -1, cm 2, mol -1).
Çeşitli iyonların bir karışımını içeren bir elektrolit çözeltisinin spesifik elektrik iletkenliğini hesaplamanız gerekiyorsa formül aşağıdaki formu alır:
k = Σ λ i Mi /1000 (6)
Matematik, n Yukarıdakiler güçlü elektrolitler için geçerlidir. Zayıf çözümler için ayrışma sabitlerinin kullanımı ve serbest iyonlarla doygunluğun belirlenmesi ile ilgili ek hesaplamaların kullanılması gerekecektir. Örneğin 0,001 M asetik asit çözeltisinin molar elektrik iletkenliği -Λ = 41 Ohm-1.cm2.mol-1 (18 °C), ancak formül (6)'nın uygulanması yaklaşık olarak 351.9 Ohm -1.cm 2.mol -1'e eşit bir değerle sonuçlanacaktır.
Örnek 2: 0,001 M asetik asit (CH3COOH) çözeltisi için spesifik elektrik iletkenliğinin (k) bulunması gerekir.
Çözüm: Zayıf sulu asetik asit çözeltilerinin ayrışması CH3COO - ve H + iyonlarına (CH3COOH ↔ H + + CH3COO -) dönüşür.
Sabit - KSN 3 COOH = [H+]. / [CH3COOH].
Monobazik asit için - [H+] = = x.
Zayıf bir asidin ayrışmış molekülleri ile doygunluk, toplam konsantrasyonla karşılaştırıldığında çok düşüktür ve bu nedenle M'ye eşit olarak alınabilir (M = 0,001 mol/l).
KSN3COOH = x2/M, KCH3COOH = 1,8. 10-5.
Koşula göre: asit doygunluğu 0,001 M (0,001 g-eşdeğer/l).
H + ve CH3 COO - iyonlarının doygunluğuna ve ayrıca elektriksel iletkenliklerine ilişkin verilere sahip olmak (λ n + 0,001 = 311 Ohm -1, cm 2. mol -1, λ снсоо- 0,001 ≈ 40,9 Ohm -1, cm 2. mol -1), spesifik elektrik iletkenliği “k” hesaplanır.
k = (311 + 40,9) . 0,001/1000 = 3,52,10 -4 Ohm -1 cm -1 (S/cm) veya 352 µS/cm.
Sayın baylar, su kalitesini belirli standartlara getirmek için “Elektriksel iletkenlik” göstergesinin düzeltilmesi gerekiyorsa lütfen firmanın uzmanlarına başvurunuz. Su Adamı. Size su arıtma için en uygun teknolojik şemayı sunacağız.
Okul günlerinden beri suyun formülünü kim biliyor? Tabii ki bu kadar. Muhtemelen kimyanın tüm seyri boyunca, onu özel bir şekilde çalışmayan pek çok kişi, yalnızca H2O formülünün ne anlama geldiğine dair bilgi sahibidir, ancak şimdi mümkün olduğunca ayrıntılı ve derinlemesine anlamaya çalışacağız. ana özellikleri nelerdir ve neden onsuz yaşam vardır Dünya gezegeninde imkansızdır.
Bir madde olarak su
Su molekülü bildiğimiz gibi bir oksijen atomu ve iki hidrojen atomundan oluşur. Formülü şu şekilde yazılmıştır: H 2 O. Bu maddenin üç durumu olabilir: katı - buz biçiminde, gaz halinde - buhar biçiminde ve sıvı - rengi, tadı veya kokusu olmayan bir madde olarak. Bu arada, gezegende doğal koşullar altında aynı anda her üç durumda da bulunabilen tek madde bu. Örneğin; Dünya'nın kutuplarında buz, okyanuslarda su, güneş ışınları altında buharlaşma ise buhardır. Bu anlamda su anormaldir.
Su aynı zamanda gezegenimizde en bol bulunan maddedir. Dünya gezegeninin yüzeyini neredeyse yüzde yetmiş oranında kaplıyor - bunlar okyanuslar, çok sayıda göllü nehir ve buzullardır. Gezegendeki suyun çoğu tuzludur. İçmeye ve tarıma uygun değildir. Tatlı su, gezegendeki toplam su miktarının yalnızca yüzde iki buçukunu oluşturuyor.
Su çok güçlü ve kaliteli bir solventtir. Bu sayede sudaki kimyasal reaksiyonlar muazzam bir hızla gerçekleşir. Aynı özellik insan vücudundaki metabolizmayı da etkiler. yetişkin insan vücudunun yüzde yetmişi sudur. Çocukta bu oran daha da yüksektir. Yaşlılıkla birlikte bu rakam yüzde yetmişten yüzde altmışa düşüyor. Bu arada suyun bu özelliği, onun insan yaşamının temeli olduğunu açıkça göstermektedir. Vücutta ne kadar çok su varsa o kadar sağlıklı, aktif ve genç olur. Bu nedenle tüm ülkelerden bilim adamları ve doktorlar yorulmadan çok fazla içki içmeniz gerektiği konusunda ısrar ediyorlar. Saf haliyle sudur ve çay, kahve veya diğer içeceklerin yerine geçmez.
Su, gezegendeki iklimi şekillendiriyor ve bu bir abartı değil. Sıcak okyanus akıntıları tüm kıtaları ısıtır. Bunun nedeni, suyun çok fazla güneş ısısını emmesi ve soğumaya başladığında onu serbest bırakmasıdır. Gezegendeki sıcaklığı bu şekilde düzenler. Pek çok bilim adamı, yeşil gezegende bu kadar çok su olmasaydı, Dünya'nın uzun zaman önce soğuyacağını ve taşa dönüşeceğini söylüyor.

Suyun özellikleri
Suyun pek çok ilginç özelliği vardır.
Örneğin su havadan sonra en hareketli maddedir. Birçoğu muhtemelen okul kursundan doğadaki su döngüsü gibi bir kavramı hatırlıyor. Örneğin: Bir akıntı doğrudan güneş ışığının etkisi altında buharlaşır ve su buharına dönüşür. Ayrıca bu buhar rüzgarla bir yere taşınır, bulutlarda toplanır, hatta kar, dolu veya yağmur şeklinde dağlara düşerek dağlara düşer. Ayrıca dere, kısmen buharlaşarak tekrar dağlardan aşağı akıyor. Ve böylece - bir daire içinde - döngü milyonlarca kez tekrarlanır.
Suyun aynı zamanda çok yüksek bir ısı kapasitesi vardır. Bu nedenle su kütleleri, özellikle de okyanuslar, sıcak bir mevsimden veya günün saatinden soğuk bir mevsime geçiş sırasında çok yavaş soğur. Tersine, hava sıcaklığı arttıkça su çok yavaş ısınır. Bu nedenle yukarıda da belirttiğimiz gibi su, gezegenimizin her yerinde hava sıcaklığını dengeler.
Cıvadan sonra su en yüksek yüzey gerilimine sahiptir. Düz bir yüzeye kazara dökülen bir damlanın bazen etkileyici bir benek haline geldiğini fark etmemek imkansızdır. Bu suyun viskozitesini gösterir. Sıcaklık dört dereceye düştüğünde başka bir özellik ortaya çıkıyor. Su bu noktaya kadar soğuduğunda hafifler. Bu nedenle buz her zaman suyun yüzeyinde yüzer ve sertleşerek nehirleri ve gölleri kaplayan bir kabuk haline gelir. Bu sayede kışın donan rezervuarlarda balıklar donmaz.
Elektriğin iletkeni olarak su
Öncelikle elektrik iletkenliğinin (su dahil) ne olduğunu öğrenmelisiniz. Elektriksel iletkenlik, bir maddenin kendi içinden elektrik akımını iletme yeteneğidir. Buna göre suyun elektriksel iletkenliği, suyun akımı iletme yeteneğidir. Bu yetenek doğrudan sıvıdaki tuzların ve diğer yabancı maddelerin miktarına bağlıdır. Örneğin, damıtılmış suyun elektriksel iletkenliği, bu suyun iyi elektriksel iletkenlik için çok gerekli olan çeşitli katkı maddelerinden arındırılması nedeniyle neredeyse en aza indirilmiştir. Mükemmel bir akım iletkeni, tuz konsantrasyonunun çok yüksek olduğu deniz suyudur. Elektriksel iletkenlik aynı zamanda suyun sıcaklığına da bağlıdır. Sıcaklık ne kadar yüksek olursa suyun elektriksel iletkenliği de o kadar yüksek olur. Bu model fizikçilerin birçok deneyi sonucunda ortaya çıkarıldı.

Su iletkenlik ölçümü
Böyle bir terim var - iletkenlik ölçümü. Bu, çözeltilerin elektriksel iletkenliğine dayalı elektrokimyasal analiz yöntemlerinden birinin adıdır. Bu yöntem, çözeltilerdeki tuz veya asitlerin konsantrasyonunu belirlemek ve ayrıca bazı endüstriyel çözeltilerin bileşimini kontrol etmek için kullanılır. Suyun amfoterik özelliği vardır. Yani, koşullara bağlı olarak hem asit hem de baz olarak davranarak hem asidik hem de bazik özellikler sergileyebilir.
Bu analiz için kullanılan cihazın adı çok benzerdir: iletkenlik ölçer. Bir kondüktometre kullanılarak, analiz edilen çözeltideki elektrolitlerin elektriksel iletkenliği ölçülür. Belki bir terimi daha açıklamaya değer - elektrolit. Bu, çözündüğünde veya eritildiğinde iyonlara ayrışan ve daha sonra elektrik akımının iletildiği bir maddedir. İyon elektrik yüklü bir parçacıktır. Aslında, suyun belirli elektriksel iletkenlik birimlerini temel alan bir kondüktometre, onun spesifik elektriksel iletkenliğini belirler. Yani başlangıç birimi olarak alınan belirli bir hacimdeki suyun elektriksel iletkenliğini belirler.
Geçen yüzyılın yetmişli yıllarının başından önce bile, elektriğin iletkenliğini belirtmek için "mo" ölçü birimi kullanılıyordu; bu, başka bir miktarın türeviydi - direncin temel birimi olan Ohm. Elektriksel iletkenlik dirençle ters orantılı bir miktardır. Artık Siemens'te ölçülüyor. Bu miktar adını Almanya'dan fizikçi Werner von Siemens'in onuruna aldı.
Siemens
Siemens (Cm veya S olarak adlandırılabilir), elektriksel iletkenliğin bir ölçüm birimi olan Ohm'un karşılığıdır. Bir cm, direnci 1 ohm olan herhangi bir iletkene eşittir. Siemens aşağıdaki formülle ifade edilir:
- 1 cm = 1: Ohm = A: B = kg −1 m −2 s³A², burada
A - amper,
V - volt.

Suyun termal iletkenliği
Şimdi bir maddenin termal enerjiyi aktarma yeteneğinden bahsedelim. Olayın özü, belirli bir cismin veya maddenin sıcaklığını belirleyen atomların ve moleküllerin kinetik enerjisinin, etkileşimleri sırasında başka bir cisme veya maddeye aktarılmasıdır. Başka bir deyişle, termal iletkenlik, cisimler, maddeler arasındaki ve ayrıca bir cisim ile bir madde arasındaki ısı alışverişidir.
Suyun ısıl iletkenliği de oldukça yüksektir. İnsanlar suyun bu özelliğini her gün farkında olmadan kullanırlar. Örneğin, bir kaba soğuk su dökmek ve içindeki içecekleri veya yiyecekleri soğutmak. Soğuk su, şişeden veya kaptan ısı alır ve karşılığında soğuk verir; bunun tersi bir reaksiyon da mümkündür.
Artık aynı olguyu gezegen ölçeğinde de kolaylıkla hayal edebiliriz. Okyanus yaz aylarında ısınır, soğuk havaların başlamasıyla birlikte yavaş yavaş soğuyarak ısısını havaya vererek kıtaları ısıtır. Kışın soğuyan okyanus, karaya göre çok yavaş ısınmaya başlıyor ve serinliğini yaz güneşinde çürüyen kıtalara bırakıyor.

Suyun yoğunluğu
Yukarıda, suyun tüm yüzeyde sertleşerek kabuk haline gelmesi nedeniyle balıkların kışın havuzda yaşadıkları anlatılmıştı. Sıfır derece sıcaklıkta suyun buza dönüşmeye başladığını biliyoruz. Suyun yoğunluğunun yoğunluğundan büyük olması nedeniyle yüzeyde yüzer ve donar.
suyun özellikleri
Ayrıca farklı koşullar altında su hem oksitleyici hem de indirgeyici bir madde olabilir. Yani elektronlarından vazgeçen su pozitif yüklü hale gelir ve oksitlenir. Veya elektron alıp negatif yüklü hale gelir, yani yenilenir. İlk durumda su oksitlenir ve ölü olarak adlandırılır. Çok güçlü bakteri yok edici özelliklere sahiptir ancak içmenize gerek yoktur. İkinci durumda su canlıdır. Canlandırır, vücudu iyileşmeye teşvik eder ve hücrelere enerji getirir. Suyun bu iki özelliği arasındaki fark "yükseltgenme-indirgeme potansiyeli" terimiyle ifade edilir.

Su neyle reaksiyona girebilir?
Su, Dünya'da bulunan hemen hemen tüm maddelerle reaksiyona girme yeteneğine sahiptir. Tek şey bu reaksiyonların gerçekleşmesi için uygun sıcaklık ve mikro iklimi sağlamanız gerektiğidir.
Örneğin oda sıcaklığında su, sodyum, potasyum, baryum gibi metallerle iyi reaksiyona girer - bunlara aktif denir. Halojenlerle - bu flor, klordur. Su ısıtıldığında demir, magnezyum, kömür ve metanla iyi reaksiyona girer.
Su, çeşitli katalizörlerin yardımıyla karboksilik asitlerin amidleri ve esterleri ile reaksiyona girer. Katalizör, bileşenleri karşılıklı bir reaksiyona doğru iterek onu hızlandıran bir maddedir.
Dünya dışında başka yerde su var mı?
Şu ana kadar güneş sistemindeki Dünya dışında hiçbir gezegende su keşfedilmedi. Evet, Jüpiter, Satürn, Neptün ve Uranüs gibi dev gezegenlerin uydularında varlığını öne sürüyorlar, ancak şu ana kadar bilim adamlarının elinde kesin veriler yok. Mars gezegeni ve Dünya'nın uydusu Ay'daki yeraltı suları hakkında henüz tam olarak doğrulanmayan başka bir hipotez daha var. Mars ile ilgili olarak genel olarak bu gezegende bir zamanlar bir okyanusun bulunduğuna dair bir takım teoriler ortaya atılmış, hatta olası modeli bilim adamları tarafından tasarlanmıştır.

Güneş sisteminin dışında, bilim adamlarına göre suyun bulunabileceği irili ufaklı birçok gezegen var. Ancak şu ana kadar bundan kesin olarak emin olmak için en ufak bir fırsat yok.
Suyun termal ve elektriksel iletkenliği pratik amaçlar için nasıl kullanılır?
Suyun ısı kapasitesi yüksek olduğundan ısıtma şebekelerinde soğutucu olarak kullanılır. Üreticiden tüketiciye ısı transferini sağlar. Birçok nükleer enerji santrali suyu mükemmel bir soğutucu olarak da kullanır.
Tıpta soğutma için buz, dezenfeksiyon için buhar kullanılır. Buz aynı zamanda halka açık ikram sisteminde de kullanılmaktadır.
Birçok nükleer reaktörde, nükleer zincir reaksiyonunun başarılı bir şekilde gerçekleşmesini sağlamak için su moderatör olarak kullanılır.
Kayaları bölmek, kırmak ve hatta kesmek için basınçlı su kullanılır. Bu, tünellerin, yer altı tesislerinin, depoların ve metroların yapımında aktif olarak kullanılmaktadır.
Çözüm
Makaleden, özellikleri ve işlevleri bakımından suyun Dünya'daki en yeri doldurulamaz ve şaşırtıcı madde olduğu anlaşılmaktadır. Dünya üzerinde bir insanın veya herhangi bir canlının hayatı suya mı bağlı? Kesinlikle evet. Bu madde insanın bilimsel faaliyetlerine katkıda bulunuyor mu? Evet. Suyun elektriksel iletkenliği, termal iletkenliği ve diğer faydalı özellikleri var mı? Cevap aynı zamanda “evet”. Başka bir şey de Dünya'da giderek daha az suyun, özellikle de temiz suyun bulunmasıdır. Ve bizim görevimiz onu (ve dolayısıyla hepimizi) yok olmaktan korumak ve korumaktır.
Spesifik elektrik iletkenliği (elektrik iletkenliği)
- suyun elektrik akımını iletme yeteneğinin niceliksel özelliği.
Bu yetenek doğrudan sudaki iyonların konsantrasyonuyla ilgilidir. İletken iyonlar çözünmüş tuzlardan ve alkaliler, klorürler, sülfürler ve karbonat bileşikleri vb. gibi inorganik malzemelerden gelir. Ne kadar çok iyon mevcutsa suyun iletkenliği de o kadar yüksek olur.
İyonlar pozitif ve negatif yükleri nedeniyle elektriği iletirler. Maddeler suda çözündüğünde pozitif yüklü (katyonik) ve negatif yüklü (anyonik) parçacıklara ayrılırlar. Çözünenler suda parçalandığında, her pozitif ve negatif yükün konsantrasyonu eşit kalır. Bu, eklenen iyonlarla suyun iletkenliğinin artmasına rağmen elektriksel olarak nötr kaldığı anlamına gelir.
Çoğu durumda, kara yüzey sularının spesifik elektrik iletkenliği, sudaki inorganik elektrolitlerin (Na katyonları) konsantrasyonunun yaklaşık bir özelliğidir.+ , K + , Ca 2+ , Mg 2+ ve Clˉ, SO 4 2-, HCO 3 - anyonlar . Diğer iyonların varlığı, ör. Fe (II), Fe (III), Mn(II), NO 3 - , HPO 4 2- bu iyonlar suda nadiren önemli miktarlarda bulunduğundan genellikle elektriksel iletkenlik değeri üzerinde çok az etkiye sahiptir. Kara yüzey sularındaki olağan konsantrasyon aralıklarındaki hidrojen ve hidroksil iyonlarının elektriksel iletkenlik üzerinde pratikte hiçbir etkisi yoktur. Çözünmüş gazların etkisi de aynı derecede küçüktür.
İletkenlik, bir çözeltiye batırılmış iki elektroda alternatif elektrik akımı (I) uygulanarak ve elde edilen voltajın (V) ölçülmesiyle ölçülebilir. Bu işlem sırasında katyonlar negatif elektroda, anyonlar ise pozitif elektroda göç eder ve çözelti bir elektrik iletkeni görevi görür. Gerilim, su direncini ölçmek için kullanılır ve bu daha sonra iletkenliğe dönüştürülür. İletkenlik, direncin tersidir ve belirli bir mesafedeki iletkenlik miktarıyla ölçülür.
Elektrik iletkenliğinin birimi 1 m başına Siemens'tir (S/m).Su için, türetilmiş değerler bir ölçü birimi olarak kullanılır - 1 m başına miliSiemens (mS/m) veya 1 cm başına microSiemens (μS/cm). Çok saf su için iletkenlik değeriyle çalışmak sakıncalıdır, bu nedenle Ohm/m (KOhm/cm veya MOhm/cm) cinsinden ölçülen direnç terimi daha sık kullanılır. Yani, örneğin, pNehirlerin iletkenliği 50 ile 1500 µS/cm arasında değişebilir.Damıtılmış suyun iletkenliği 0,5 ila 5 µS/cm aralığında, ultra saf deiyonize suyun ise 10-18 MOhm/cm aralığında iletkenliği vardır.
Akarsu ve nehirlerdeki iletkenlik öncelikle suyun aktığı alanın jeolojisine bağlıdır. Granit kayaların bulunduğu bölgelerden akan akıntılar daha düşük iletkenliğe sahip olma eğilimindedir çünkü granit, suda yıkandığında iyonlaşmayan (iyonik bileşenlere çözünmeyen) daha atıl malzemelerden oluşur. Öte yandan killi toprakların bulunduğu bölgelerden akan dereler, suya atıldığında iyonlaşan malzemelerin varlığı nedeniyle daha iletken olma eğilimindedir. Yeraltı suyu girişleri, nereden aktıklarına bağlı olarak benzer etkilere sahip olabilir. Nehirlere yapılan deşarjlar, bileşimlerine bağlı olarak iletkenliği değiştirebilir. Arızalı bir kanalizasyon sistemi, klorür, fosfat ve nitratın varlığı nedeniyle iletkenliği artıracaktır; bir petrol sızıntısı iletkenliği azaltacaktır.
Suyun iletkenliği, kalibre edilmiş bir cihaz (iletkenlik ölçer) kullanılarak doğru bir şekilde ölçülmelidir. İletkenlik elektrotların geometrik özelliklerinden doğrudan etkilenir; yani iletkenlik elektrotlar arasındaki mesafeyle ters orantılı, elektrotların alanıyla orantılıdır. Bu geometrik ilişki hücre sabiti olarak bilinir. Kontrol edilmesi ve gerekirse ayarlanması gereken sabit hücre ve direnç ölçümü.
Cihazdaki elektrotun geometrik özelliklerinin yanı sıra, ve iletkenlik de sıcaklıktan etkilenir: su ne kadar sıcaksa iletkenlik de o kadar yüksek olur. Bu nedenle elektriksel iletkenlik 25 santigrat derece (25 °C) sıcaklıktaki iletkenlik olarak rapor edilir.Çözeltinin sıcaklığının arttırılması, viskozitesinin azalmasına ve çözeltideki iyonların hareketliliğinin artmasına neden olacaktır. Sıcaklığın arttırılması, moleküllerin ayrışmasından dolayı çözeltideki iyon sayısının artmasına da neden olabilir. Bir çözeltinin iletkenliği bu faktörlere bağlı olduğundan çözeltinin sıcaklığının arttırılması iletkenliğinin artmasına neden olacaktır. Bu bağımlılığı bilmekBirçok cihaz, teorik olarak 25° nominal sıcaklıkta gözlemlenecek değeri görüntülemek için gerçek okumayı otomatik olarak düzeltir. Bu genellikle iletkenlik sensörüne yerleşik bir sıcaklık sensörü ve iletkenlik ölçere yerleşik bir yazılım algoritması kullanılarak yapılır. Ancak içinDoğrusal sıcaklık telafisi, sıcaklık değişim katsayısının ölçülen tüm sıcaklıklar için aynı değere sahip olduğunu varsayar. Bu varsayım yanlıştır; ancak birçok ölçüm için bu, raporlanan sonucun genel ölçüm belirsizliğine önemli bir katkı sağlamaz.
http://www.iwinst.org/wp-content/uploads/2012/04/Conductivity-what-is-it.pdfhttps://hmc.usp.org/sites/default/files/documents/HMC/GCs-Pdfs/c645.pdf
https://www.google.ru/urlsa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0ahUKEwjR9Kautv_WAhVFP5oKHRb4D3MQFgg7MAI&url=http%3A%2F%2Fwww.fondriest.com%2Fenvironmental-measurements%2Fparameters%2Fwater-quality%2Fconductivity - tuzluluk-tds%2F&usg=AOvVaw31-HAReIg1Tn1CDOmaAVim
Havza İzleme ve Değerlendirme için Temiz Su Ekibi Rehberlik Özeti Devlet Su Kaynakları Kontrol Kurulu FS-3.1.3.0(EC)V2e 27.04.2004
https://www.reagecon.com/pdf/technicalpapers/Effect_of_Temperature_TSP-07_Issue3.pdf
RD 52.24.495-2005 Hidrojen indeksi ve suyun spesifik elektriksel iletkenliği. Elektrometrik yöntemi kullanarak ölçüm yapma metodolojisi