Od čega je napravljen helijum? Tehnički helijum - primena u nauci i industriji
Helijum(He) je inertni gas, koji je drugi element periodnog sistema elemenata, kao i drugi element po lakoći i obilju u Univerzumu. Spada u jednostavne supstance i pod standardnim uslovima (standardna temperatura i pritisak) je jednoatomni gas.
Helijum Bezukusno je, bez boje, mirisa i ne sadrži toksine.
Među svim jednostavnim supstancama, helijum ima najnižu tačku ključanja (T = 4,216 K). Pri atmosferskom pritisku nemoguće je dobiti čvrsti helijum, čak i na temperaturama blizu apsolutne nule - da bi se pretvorio u čvrsti oblik, heliju je potreban pritisak iznad 25 atmosfera. Postoji nekoliko hemijskih jedinjenja helijuma i svi su nestabilni u standardnim uslovima.
Helij koji se pojavljuje u prirodi sastoji se od dva stabilna izotopa, He i 4He. Izotop “He” je vrlo rijedak (obilje izotopa 0,00014%) sa 99,99986% za izotop 4He. Osim prirodnih, poznato je i 6 vještačkih radioaktivnih izotopa helijuma.
Pojava gotovo svega u svemiru, helijuma, bila je primarna nukleosinteza koja se dogodila u prvim minutama nakon Velikog praska.
Trenutno, skoro sve helijum nastaje iz vodonika kao rezultat termonuklearne fuzije koja se odvija u unutrašnjosti zvijezda. Na našoj planeti helijum nastaje tokom alfa raspada teških elemenata. Taj dio helijuma koji uspije da procuri kroz Zemljinu koru izlazi kao dio prirodnog plina i može činiti do 7% njegovog sastava. Za isticanje helijum iz prirodnog plina koristi se frakciona destilacija - proces niskotemperaturnog odvajanja elemenata.
Istorija otkrića helijuma
18. avgusta 1868. očekivalo se potpuno pomračenje Sunca. Astronomi širom svijeta aktivno su se pripremali za ovaj dan. Nadali su se da će riješiti misteriju prominencija - svjetlećih izbočina vidljivih u trenutku potpune pomračenja Sunca duž rubova solarnog diska. Neki astronomi su vjerovali da su istaknute visoke lunarne planine, koje su u trenutku potpunog pomračenja Sunca bile obasjane sunčevim zracima; drugi su mislili da su istaknute planine planine na samom Suncu; treći su vidjeli vatrene oblake sunčeve atmosfere u solarnim izbočinama. Većina je vjerovala da prominencije nisu ništa drugo do optička iluzija.
Godine 1851, tokom pomračenja Sunca posmatranog u Evropi, nemački astronom Šmit ne samo da je video solarne izbočine, već je uspeo da vidi i da se njihovi obrisi vremenom menjaju. Na osnovu svojih zapažanja, Schmidt je zaključio da su istaknuti oblaci vrućeg plina izbačeni u solarnu atmosferu džinovskim erupcijama. Međutim, čak i nakon Schmidtovih zapažanja, mnogi astronomi su i dalje smatrali vatrene projekcije optičkom varkom.
Tek nakon potpunog pomračenja 18. jula 1860. godine, koje je uočeno u Španiji, kada su mnogi astronomi svojim očima vidjeli solarne izbočine, a Italijan Secchi i Francuz Dellar uspjeli ne samo da ih skiciraju, već i fotografišu, niko imao bilo kakve sumnje u postojanje istaknutosti .
Do 1860. već je izmišljen spektroskop - uređaj koji omogućava da se posmatranjem vidljivog dijela optičkog spektra odredi kvalitativni sastav tijela iz kojeg se dobiva posmatrani spektar. Međutim, na dan pomračenja Sunca, niko od astronoma nije koristio spektroskop da ispita spektar prominencija. Sjetili su se spektroskopa kada je pomračenje već bilo gotovo.
Zato je, pripremajući se za pomračenje Sunca 1868. godine, svaki astronom uvrstio spektroskop na listu instrumenata za posmatranje. Jules Jansen, poznati francuski naučnik, nije zaboravio ovu spravu kada je otišao u Indiju da posmatra prominence, gde su uslovi za posmatranje pomračenja Sunca, prema proračunima astronoma, bili najbolji.
U trenutku kada je pjenušavi disk Sunca bio potpuno prekriven Mjesecom, Jules Jansen je spektroskopom, ispitujući narandžasto-crveni plamen koji je bježao sa površine Sunca, vidio u spektru, pored tri poznate linije vodonika: crvena, zeleno-plava i plava, nova, nepoznata – jarko žuta. Nijedna od supstanci poznatih hemičarima tog vremena nije imala takvu liniju u dijelu spektra gdje ju je otkrio Jules Jansen. Isto otkriće, ali kod kuće u Engleskoj, napravio je astronom Norman Lockyer.
Pariška akademija nauka je 25. oktobra 1868. primila dva pisma. Jedan, napisan dan nakon pomračenja Sunca, došao je iz Guntura, malog grada na istočnoj obali Indije, od Julesa Jansena; drugo pismo, datirano 20. oktobra 1868, bilo je iz Engleske od Normana Lockyera.
Primljena pisma pročitana su na sastanku profesora Pariske akademije nauka. U njima su Jules Jansen i Norman Lockyer, nezavisno jedan od drugog, izvijestili o otkriću iste "solarne materije". Lockyer je predložio da se ova nova supstanca, pronađena na površini Sunca pomoću spektroskopa, nazove helijumom od grčke riječi za sunce - helios.
Ova koincidencija iznenadila je naučni skup profesora Akademija i istovremeno svedočila o objektivnoj prirodi otkrića nove hemijske supstance. U čast otkrića supstance solarnih baklji (prominence), iskovana je medalja. Na jednoj strani ove medalje nalaze se portreti Jansena i Lockyera, a na drugoj je lik starogrčkog boga sunca Apolona u kolima koje vuku četiri konja. Ispod kočije je bio natpis na francuskom: „Analiza solarnih izbočina 18. avgusta 1868.
Godine 1895. londonski hemičar Henry Myers skrenuo je pažnju Williama Ramsaya, poznatog engleskog fizičkog hemičara, na tada zaboravljeni članak geologa Hildebranda. U ovom članku Hildebrand je tvrdio da neki rijetki minerali, kada se zagrijavaju u sumpornoj kiselini, emituju plin koji ne gori i ne podržava sagorijevanje. Među ovim rijetkim mineralima bio je i kleveit, koji je u Norveškoj pronašao Nordenskiöld, poznati švedski istraživač polarnih područja.
Ramsay je odlučio istražiti prirodu plina sadržanog u kleveitu. U svim hemijskim prodavnicama u Londonu, Ramsayevi pomoćnici su uspeli da kupe samo... jedan gram kleveita, plativši ga samo 3,5 šilinga. Nakon što je iz nastale količine kleveita izdvojio nekoliko kubnih centimetara plina i očistio ga od nečistoća, Ramsay ga je ispitao pomoću spektroskopa. Rezultat je bio neočekivan: gas oslobođen iz kleveita ispostavilo se da je... helijum!
Ne vjerujući svom otkriću, Ramsay se obratio Williamu Crookesu, najvećem specijalistu za spektralnu analizu u Londonu u to vrijeme, sa zahtjevom da prouči plin izolovan iz kleveita.
Crookes je ispitao gas. Rezultat studije potvrdio je Ramsayevo otkriće. Tako je 23. marta 1895. godine na Zemlji otkrivena supstanca koja je pronađena na Suncu 27 godina ranije. Istog dana, Ramsay je objavio svoje otkriće, poslavši jednu poruku Kraljevskom društvu u Londonu, a drugu poznatom francuskom hemičaru akademiku Berthelotu. U pismu Berthelotu, Ramsay je tražio da prijavi svoje otkriće naučnom skupu profesora na Pariskoj akademiji.
15 dana nakon Ramsaya, nezavisno od njega, švedski hemičar Langlais izolovao je helijum iz kleveita i, poput Ramsaya, prijavio je svoje otkriće helijuma hemičaru Berthelotu.
Po treći put, helijum je otkriven u vazduhu, gde je, prema Ramziju, trebalo da dođe od retkih minerala (kleveit i dr.) tokom razaranja i hemijskih transformacija na Zemlji.
Helijum je takođe u malim količinama pronađen u vodi nekih mineralnih izvora. Na primjer, pronašao ga je Ramsay u ljekovitom izvoru Cauterets u planinama Pirineja, engleski fizičar John William Rayleigh pronašao ga je u vodama izvora u poznatom ljetovalištu Bath, njemački fizičar Kaiser otkrio je helijum u izvorima koji teku u planine Švarcvalda. Međutim, helijuma je najviše pronađeno u nekim mineralima. Nalazi se u samarskitu, fergusonitu, kolumbitu, monazitu i uranitu. Mineral torijanit sa ostrva Cejlon sadrži posebno velike količine helijuma. Kilogram torijanita oslobađa 10 litara helijuma kada se zagrije.
Ubrzo je otkriveno da se helijum nalazi samo u onim mineralima koji sadrže radioaktivni uranijum i torij. Alfa zraci koje emituju neki radioaktivni elementi nisu ništa drugo do jezgra atoma helija.
Iz istorije...
Njegova neobična svojstva omogućavaju široku upotrebu helija u različite svrhe. Prvi, apsolutno logičan, zasnovan na svojoj lakoći, je upotreba u balonima i vazdušnim brodovima. Štaviše, za razliku od vodonika, nije eksplozivan. Ovo svojstvo helijuma Nemci su koristili u Prvom svetskom ratu na borbenim vazdušnim brodovima. Nedostatak njegovog korištenja je da vazdušni brod napunjen helijumom neće letjeti tako visoko kao vodonik.
Tokom Prvog svetskog rata, nemačka komanda je koristila vazdušne brodove (cepeline) za bombardovanje velikih gradova, uglavnom prestonica Engleske i Francuske. Za njihovo punjenje je korišten vodonik. Stoga je borba protiv njih bila relativno jednostavna: zapaljivi projektil koji je pogodio školjku zračnog broda zapalio je vodik, koji je odmah planuo i uređaj je izgorio. Od 123 zračna broda izgrađena u Njemačkoj tokom Prvog svjetskog rata, 40 je izgorjelo od zapaljivih granata. Ali jednog dana generalštab britanske vojske bio je iznenađen porukom od posebnog značaja. Direktni pogoci zapaljivih granata na njemački cepelin nisu dali nikakve rezultate. Dirižabl se nije zapalio, već je polako iscurio sa nekim nepoznatim gasom i odleteo nazad.
Vojni stručnjaci su bili zbunjeni i, unatoč hitnoj i detaljnoj raspravi o nezapaljivosti Zeppelina od zapaljivih granata, nisu mogli pronaći potrebno objašnjenje. Zagonetku je riješio engleski hemičar Richard Threlfall. U pismu britanskom Admiralitetu, napisao je: „...Vjerujem da su Nemci izmislili neki način proizvodnje helijuma u velikim količinama, a ovaj put su napunili školjku svog cepelina ne vodonikom, kao i obično, već sa helijum..."
Vjerodostojnost Threlfallovih argumenata je, međutim, umanjena činjenicom da u Njemačkoj nije bilo značajnijih izvora helijuma. Istina, helijum se nalazi u zraku, ali ga tamo ima malo: jedan kubni metar zraka sadrži samo 5 kubnih centimetara helijuma. Rashladna mašina Linde sistema, koja nekoliko stotina kubnih metara vazduha pretvara u tečnost u jednom satu, mogla je da proizvede ne više od 3 litre helijuma za to vreme.
3 litre helijuma na sat! A za punjenje cepelina potrebno vam je 5-6 hiljada kubnih metara. m da bi se dobila tolika količina helijuma, jedna Linde mašina je morala da radi bez prestanka oko dve stotine godina dala bi potrebnu količinu helija. Izgradnja 200 postrojenja za pretvaranje zraka u tekućinu za proizvodnju helijuma ekonomski je vrlo neisplativa i praktično besmislena.
Odakle su njemački hemičari dobili helijum?
Ovo pitanje je, kako se kasnije pokazalo, riješeno relativno jednostavno. Davno prije rata, njemačke brodarske kompanije koje su prevozile robu u Indiju i Brazil dobile su instrukcije da brodove koji se vraćaju utovare ne običnim balastom, već monazitnim pijeskom, koji sadrži helijum. Tako je stvorena rezerva "helijumskih sirovina" - oko 5 hiljada tona monazitnog peska, iz kojeg se dobija helijum za cepeline. Osim toga, helijum je izvađen iz vode mineralnog izvora Nauheim, koja je dala do 70 kubnih metara. m helijuma dnevno.
Incident s vatrostalnim cepelinom bio je poticaj za nova potrage za helijumom. Hemičari, fizičari i geolozi počeli su intenzivno tragati za helijumom. Odjednom je dobio ogromnu vrijednost. Godine 1916. 1 kubni metar helijuma koštao je 200.000 rubalja u zlatu, odnosno 200 rubalja po litru. Ako uzmemo u obzir da litra helijuma teži 0,18 g, onda 1 g košta preko 1000 rubalja.
Helijum je postao predmet lova za trgovce, špekulante i berzanske mešetare. Helijum je u značajnim količinama otkriven u prirodnim gasovima koji izlaze iz utrobe zemlje u Americi, u državi Kanzas, gde je, nakon što je Amerika ušla u rat, izgrađena fabrika helijuma u blizini grada Fort Vorta. Ali rat je završio, rezerve helijuma su ostale neiskorištene, cijena helijuma je naglo pala i na kraju 1918. iznosila je oko četiri rublje po kubnom metru.
Helij dobijen s takvim poteškoćama Amerikanci su iskoristili tek 1923. za punjenje sada miroljubivog zračnog broda Shenandoah. Bio je to prvi i jedini na svijetu zračni teretno-putnički brod punjen helijumom. Međutim, ispostavilo se da je njegov "život" kratkog vijeka. Dvije godine nakon rođenja, Shenandoah je uništen u oluji. 55 hiljada kubnih metara m, gotovo cjelokupna svjetska zaliha helijuma, prikupljena tokom šest godina, raspršila se bez traga u atmosferi tokom oluje koja je trajala samo 30 minuta.
Primena helijuma






Helijum u prirodi
Uglavnom zemaljski helijum nastaje tokom radioaktivnog raspada uranijuma-238, uranijuma-235, torija i nestabilnih produkata njihovog raspada. Neuporedivo manje količine helijuma nastaju sporim raspadom samarija-147 i bizmuta. Svi ovi elementi stvaraju samo teški izotop helijuma - He 4, čiji se atomi mogu smatrati ostacima alfa čestica zakopanih u ljusci od dva uparena elektrona - u elektronskom dubletu. U ranim geološkim periodima vjerovatno je postojao i drugi prirodno radioaktivan niz elemenata koji su već nestali sa lica Zemlje, zasićujući planetu helijumom. Jedna od njih bila je sada umjetno rekreirana serija neptunija.
Po količini helijuma zatvorenog u stijeni ili mineralu može se suditi o njenoj apsolutnoj starosti. Ova mjerenja se zasnivaju na zakonima radioaktivnog raspada: na primjer, polovina uranijuma-238 pretvara se u helijum i olovo.
Helijum polako se akumulira u zemljinoj kori. Jedna tona granita koji sadrži 2 g uranijuma i 10 g torijuma proizvodi samo 0,09 mg helijuma tokom milion godina - pola kubnog centimetra. Vrlo mali broj minerala bogatih uranijumom i torijumom ima prilično visok sadržaj helijuma - nekoliko kubnih centimetara helijuma po gramu. Međutim, udio ovih minerala u prirodnoj proizvodnji helijuma je blizu nule, jer su vrlo rijetki.
Na Zemlji ima malo helijuma: 1 m 3 zraka sadrži samo 5,24 cm 3 helijuma, a svaki kilogram zemaljskog materijala sadrži 0,003 mg helijuma. Ali u smislu rasprostranjenosti u svemiru, helijum je na drugom mjestu nakon vodonika: helijum čini oko 23% kosmičke mase. Otprilike polovina ukupnog helijuma koncentrirana je u zemljinoj kori, uglavnom u njenoj granitnoj ljusci, koja je akumulirala glavne rezerve radioaktivnih elemenata. Sadržaj helijuma u zemljinoj kori je nizak - 3 x 10 -7% po masi. Helijum se akumulira u akumulacijama slobodnih gasova u podzemlju i u uljima; Takve naslage dostižu industrijske razmjere. Maksimalne koncentracije helijuma (10-13%) nađene su u akumulacijama slobodnih gasova i gasovima rudnika uranijuma i (20-25%) u gasovima koji se spontano oslobađaju iz podzemnih voda. Što je starija starost sedimentnih stijena koje sadrže plin i što je u njima veći sadržaj radioaktivnih elemenata, to je više helija u sastavu prirodnih plinova.
Ekstrakcija helijuma
Helij se proizvodi u industrijskim razmjerima iz prirodnih i naftnih plinova i ugljikovodika i dušika. Na osnovu kvaliteta sirovina, ležišta helijuma se dele na: bogata (sadržaj He > 0,5% zapremine); obične (0,10-0,50) i loše< 0,10). Значительные его концентрации известны в некоторых месторождениях природного газа Канады, США (шт. Канзас, Техас, Нью-Мексико, Юта).
Svjetske rezerve helijuma iznose 45,6 milijardi kubnih metara. Velika ležišta nalaze se u Sjedinjenim Državama (45% svjetskih resursa), a slijede Rusija (32%), Alžir (7%), Kanada (7%) i Kina (4%).
Sjedinjene Američke Države također vode u proizvodnji helijuma (140 miliona kubnih metara godišnje), a slijedi ih Alžir (16 miliona).
Rusija je na trećem mestu u svetu - 6 miliona kubnih metara godišnje. Orenburška tvornica helijuma trenutno je jedini domaći izvor proizvodnje helijuma, a proizvodnja plina opada. U tom pogledu od posebnog su značaja gasna polja u istočnom Sibiru i na Dalekom istoku sa visokim koncentracijama helijuma (do 0,6%). Jedan od najperspektivnijih je Kovykta ha zokondenzatno polje koje se nalazi na severu Irkutske oblasti. Prema stručnjacima, sadrži oko 25% svjetskog x rezerve helijuma.
|
Naziv indikatora |
Helijum (razred A) (prema TU 51-940-80) |
Helijum (razred B) (prema TU 51-940-80) |
Helijum visoke čistoće, stepen 5,5 (prema TU 0271-001-45905715-02) |
Helijum visoke čistoće, stepen 6.0 (prema TU 0271-001-45905715-02) |
|
Helijum, ništa manje |
||||
|
Azot, ne više |
||||
|
Kiseonik + argon |
||||
|
Neon, ništa više |
||||
|
Vodena para, ne više |
||||
|
Ugljovodonici, ne više |
||||
|
CO2 + CO, ne više |
||||
|
Vodonik, ne više |
Sigurnost
– Helijum nije toksičan, nije zapaljiv, nije eksplozivan
– Helijum je dozvoljeno koristiti na svim mestima sa puno ljudi: na koncertima, reklamnim događajima, stadionima, prodavnicama.
– Plin helijum je fiziološki inertan i ne predstavlja opasnost za ljude.
– Helijum nije opasan za okolinu, pa neutralizacija, reciklaža i odlaganje njegovih ostataka u boce nije potrebna.
– Helijum je mnogo lakši od vazduha i raspršuje se u gornjim slojevima Zemljine atmosfere.
|
Helijum (razred A i B prema TU 51-940-80) |
|
|
Tehnički naziv |
Helijum gas |
|
Hemijska formula |
|
|
OON broj |
|
|
Klasa opasnosti u transportu |
|
|
Fizička svojstva |
|
|
Fizičko stanje |
U normalnim uslovima - gas |
|
Gustina, kg/m³ |
U normalnim uslovima (101,3 kPa, 20 C), 1627 |
|
Tačka ključanja, C na 101,3 kPa |
|
|
Temperatura 3. tačke i njen ravnotežni pritisak C, (mPa) |
|
|
Rastvorljivost u vodi |
beznačajan |
|
Opasnost od požara i eksplozije |
otporan na vatru i eksploziju |
|
Stabilnost i reaktivnost |
|
|
Stabilnost |
Stabilan |
|
Reaktivnost |
Inertni gas |
|
Opasnost za ljude |
|
|
Toksični efekti |
Netoksičan |
|
Opasnost po životnu sredinu |
Nema štetan uticaj na životnu sredinu |
|
Objekti |
Primjenjuju se bilo koja sredstva |
Skladištenje i transport helijuma
Helijum gas se može transportovati svim vidovima transporta u skladu sa pravilima za transport robe na određenom načinu transporta. Transport se obavlja u specijalnim smeđim čeličnim cilindrima i kontejnerima za transport helijuma. Tečni helijum se transportuje u transportnim posudama kao što su STG-40, STG-10 i STG-25 zapremine 40, 10 i 25 litara.
Pravila za transport boca sa tehničkim gasovima
Prevoz opasnih materija u Ruskoj Federaciji regulisan je sledećim dokumentima:
1. „Pravila za prevoz opasnih materija u drumskom saobraćaju“ (sa izmenama i dopunama Naredbi Ministarstva saobraćaja Ruske Federacije od 11. juna 1999. br. 37, od 14. oktobra 1999. br. 77; registrovano u Ministarstvu Sudija Ruske Federacije od 18. decembra 1995. godine, registarski broj 997).
2. “Evropski sporazum o međunarodnom drumskom prevozu opasnih materija” (ADR), kojem se Rusija zvanično pridružila 28. aprila 1994. (Uredba Vlade RF br. 76 od 02.03.1994.).
3. “Pravila na putu” (Saobraćajni propisi 2006), odnosno član 23.5, koji utvrđuje da se “Prevoz... opasnih materija... obavlja u skladu sa posebnim pravilima.”
4. “Kodeks Ruske Federacije o upravnim prekršajima”, član 12.21, dio 2 predviđa odgovornost za kršenje pravila za prevoz opasnih materija u obliku “administrativne kazne za vozače u iznosu od jednog do tri puta većeg minimalnu zaradu ili lišenje prava upravljanja vozilima u trajanju od jednog do tri mjeseca za službena lica zadužena za poslove saobraćaja - od deset do dvadeset minimalne zarade."
U skladu sa klauzulom 3, tačkom 1.2, „Pravila se ne primenjuju na... prevoz ograničene količine opasnih materija na jednom vozilu čiji se prevoz može smatrati prevozom neopasnog tereta.” Takođe se pojašnjava da je „u zahtjevima za bezbjedan transport određene vrste opasnog tereta određena ograničena količina opasne robe Prilikom njenog utvrđivanja moguće je koristiti zahtjeve Evropskog sporazuma o međunarodnom prijevozu opasnog tereta. (ADR).” Dakle, pitanje maksimalne količine supstanci koje se mogu transportovati kao neopasne robe svodi se na proučavanje odeljka 1.1.3 ADR-a, kojim se utvrđuju izuzeci od evropskih pravila za transport opasnih materija u vezi sa različitim okolnostima.
Tako, na primjer, u skladu sa klauzulom 1.1.3.1 „Odredbe ADR-a ne primjenjuju se... na prijevoz opasnih tvari od strane fizičkih lica, kada je ta roba pakirana za prodaju na malo i namijenjena je za ličnu potrošnju, domaćinstvo korištenje, slobodno vrijeme ili sport, pod uslovom da su poduzete mjere za sprječavanje bilo kakvog curenja sadržaja u normalnim uvjetima prijevoza."
Međutim, grupa izuzeća koja je formalno priznata pravilima za prevoz opasnih materija su izuzeća povezana sa količinama koje se prevoze u jednoj transportnoj jedinici (tačka 1.1.3.6).
Svi gasovi su klasifikovani u drugu klasu supstanci prema ADR klasifikaciji. Nezapaljivi, netoksični gasovi (grupe A – neutralni i O – oksidirajući) pripadaju trećoj transportnoj kategoriji, sa maksimalnom količinom ograničenom na 1000 jedinica. Lako zapaljivo (grupa F) - do druge, sa maksimalnom količinom ograničenom na 333 jedinice. Pod "jedinicom" ovdje podrazumijevamo 1 litar kapaciteta posude u kojoj se nalazi komprimirani plin, odnosno 1 kg ukapljenog ili otopljenog plina. Dakle, maksimalna količina gasova koja se može prevesti u jednoj transportnoj jedinici kao neopasan teret je sledeća:
Helijum: kako se kopa i gdje se koristi
Helijum je inertan gas, bez boje i mirisa, hemijski element uključen u periodni sistem. Prvi spomen helijuma datira iz 1868. Zatim su istraživači Pierre Jules Jansen i Joseph Norman Lockyer promatrali pomračenje Sunca i izveli spektroskopiju zraka. Prilikom razdvajanja solarnog elementa na elemente različitih boja, uočili su svijetložuti element, dotad nepoznat fizičarima. Kasnije se ispostavilo da je u pitanju helijum.
Uprkos činjenici da je helijum drugi najzastupljeniji element u svemiru nakon vodonika, rijetko se nalazi na Zemlji. Tek 1895. godine naučnici iz Škotske uspjeli su izolovati ovu supstancu iz kleveita, prirodnog minerala.
Depoziti helijuma
Danas se helijum kopa u dubinama zemlje, izolujući ga od prirodnog gasa. U Rusiji ga proizvodi fabrika za preradu gasa u Orenburgu. Prirodni plin koji se koristi u elektrani sadrži samo 0,055% helijuma, što se smatra vrlo malom količinom. Gasovi bogati helijumom su gasovi u kojima je njegov sadržaj najmanje 0,5%. Ako prirodni gas sadrži 0,1 do 0,5% helijuma, naziva se generički depozit helijuma.
Ukupno na Zemlji ima više od 40 milijardi kubnih metara helijuma. Najbogatije zemlje helijumom su Kina, Rusija, SAD, Alžir i Katar. Svake godine se u svijetu iskopa oko 175 miliona kubnih metara helijuma. Ruska polja proizvode samo 5 miliona kubnih metara. Bogata nalazišta ovog gasa otkrivena su u Sibiru i na Dalekom istoku, ali danas njegova proizvodnja tamo nije uspostavljena.
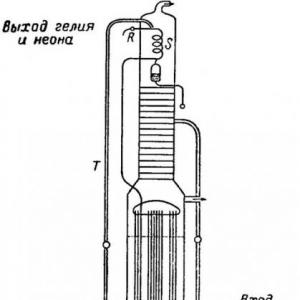
Kako dobiti helijum iz prirodnog gasa
Proces proizvodnje helijuma sastoji se od dvije faze. Prvo se hladi prirodni plin, nakon čega dolazi do kondenzacije i oslobađa se koncentrat helijuma - supstanca koja je 80% helijuma. Nakon toga, rezultirajuća tvar se pročišćava od nečistoća (vodik, argon, metan, dušik). Za čišćenje se koriste različite metode.
Gdje se koristi helijum?
Ovaj inertni plin je odličan provodnik struje i topline, stoga se široko koristi u mnogim oblastima - u raketnoj nauci, avijaciji, nuklearnoj industriji, medicini. Mnogo je lakši od vazduha, pa se koristi i u aeronautici i ronjenju.
Ovaj plin je dio mješavine za disanje - nije toksičan i može se udahnuti bez štete po zdravlje.
Nedavno su naučnici otkrili još jedno područje primjene helijuma - u nuklearnoj industriji. Helij se koristi kao provodnik topline za nuklearne reaktore. U metalurgiji se ovaj plin koristi kao zaštitna tvar pri zavarivanju.
Rezerve helijuma na Zemlji
Stručnjaci procjenjuju da će za zadovoljavanje tako velikih potreba za helijumom biti potrebno 238-312 miliona kubnih metara godišnje do 2030. godine. Do tada će se obim proizvodnje povećati na samo 213-238 miliona kubnih metara godišnje, tako da se očekuje manjak helijuma u proizvodnim područjima. Postoji samo jedan izlaz iz ove situacije - povećati količinu proizvedenog helijuma. U Rusiji se već danas grade nova preduzeća za njegovo vađenje, uglavnom u regionima Sibira.
Helijum je hemijski element sa atomskim brojem 2 u periodnom sistemu hemijskih elemenata D.I. Mendeljejev. Hemijska formula He. Helijum je inertan gas, bez boje i mirisa.
Helijum je veoma čest u Univerzumu. Nalazi se na drugom mjestu nakon vodonika. Ali na Zemlji ima malo helijuma.
Helijum ne reaguje ni sa jednim hemijskim elementom. Njegovi atomi se čak i ne povezuju jedan s drugim. Helijum ne gori.
Otkriće helijuma

Helijum je otkriven 1868. godine tokom pomračenja Sunca. Štaviše, ovo otkriće su istovremeno napravila dva astronoma - Francuz Pierre Jules Jansen i Englez Joseph Norman Lockyer. U spektru solarne korone oboje su nezavisno otkrili žutu liniju koja nije pripadala nijednom od tada poznatih elemenata. Lockyer je 1871. godine sugerirao da je novi kemijski element prisutan na Suncu. I 1895 Škotski hemičar William Ramsay prvi je izolirao plin od radioaktivnog minerala kleveita. Spektar ovog gasa sadržavao je potpuno istu žutu liniju. Novi element je dobio ime Helios - sunce.
Proizvodnja helijuma

Helijum se dobija iz prirodnih gasova koji sadrže helijum dubokim hlađenjem. Oslobađanje helijuma se odvija u dvije faze. Prva faza je proizvodnja koncentrata helijuma kondenzacijom na niskoj temperaturi. A druga faza je prečišćavanje koncentrata helijuma od metana, vodonika, dušika, neona, argona.
Sve najveće svjetske rezerve helijuma nalaze se u Alžiru, Kataru, Sjedinjenim Državama i Rusiji. Najveći proizvođač helijuma su SAD. U Rusiji se ne proizvodi mnogo helijuma, jer se njegova glavna nalazišta nalaze u nerazvijenim poljima Dalekog istoka i istočnog Sibira.
Primena helijuma

Helijum ima visoku električnu i toplotnu provodljivost. Osim toga, ima vrlo nisku tačku ključanja, minus 268,94 o C.
Opseg helijuma je veoma širok.
Mješavina plina helijuma i kisika koristi se za ublažavanje napada astme. Helijum je mnogo manje rastvorljiv u krvi od azota. Stoga se koristi u respiratornim smjesama koje se dostavljaju roniocima tokom dubokog ronjenja, kako bi se stvorila umjetna atmosfera za svemirske brodove i stanice.
Mnogi tehnološki procesi u proizvodnji ne mogu se odvijati u zračnom okruženju zbog mogućnosti da početna sirovina ili rezultirajući proizvod reagiraju s plinovima iz zraka, a tu u pomoć dolazi helijum, uz pomoć kojeg se stvaraju posebna zaštitna okruženja .
Određene faze proizvodnje nuklearnog goriva odvijaju se u okruženju koje štiti helijum. Gorivni elementi nuklearnog reaktora se takođe transportuju i skladište u kontejnerima punjenim gelom. Helij se koristi za otkrivanje potencijalnih curenja u nuklearnim reaktorima. Helij se koristi u plinskim termometrima, visokonaponskim prekidačima, u brojačima neutrona i za plinsko podmazivanje ležajeva.
Helijum se koristi kao inertni medij u elektrolučnom zavarivanju.
Zračni brodovi i baloni punjeni su helijumom.
Helijum nije toksičan. A udisanje male količine helijuma zajedno sa vazduhom je bezopasno.
DEFINICIJA
Helijum- drugi element periodnog sistema. Oznaka - nije od latinskog "helijum". Nalazi se u prvom periodu, VIA grupa. Spada u grupu inertnih (plemenitih) gasova. Nuklearni naboj je 2.
Helijum se na Zemlji uglavnom nalazi u atmosferi, ali se neke količine oslobađaju na određenim mjestima iz unutrašnjosti Zemlje zajedno s prirodnim plinovima. Vode mnogih mineralnih izvora takođe emituju helijum.
Helijum je bezbojni gas koji se teško rastvara u tečnost (tačka ključanja -268,9 o C), koji se stvrdnjava samo pod suvišnim pritiskom (dijagram strukture atoma je prikazan na sl. 1). Ima jaku sposobnost prodiranja kroz staklo i metalnu foliju. Slabo se rastvara u vodi, bolje u benzenu, etanolu i toluenu.
Rice. 1. Struktura atoma helijuma.
Atomska i molekulska masa helijuma
DEFINICIJA
Relativna molekulska težina M r je molarna masa molekula podijeljena sa 1/12 molarne mase atoma ugljika-12 (12 C). Ovo je bezdimenzionalna veličina.
DEFINICIJA
Relativna atomska masa A r je molarna masa atoma tvari podijeljena sa 1/12 molarne mase atoma ugljika-12 (12 C).
Budući da helij postoji u slobodnom stanju u obliku jednoatomskih molekula He, vrijednosti njegove atomske i molekularne mase se poklapaju. One su jednake 4,003.
Izotopi helijuma
Helijum, najzastupljeniji element u svemiru nakon vodonika, sastoji se od dva stabilna izotopa: 4 He i 3 He. Njihovi maseni brojevi su 4 i 3. Jezgro atoma helijuma 4 He sadrži dva protona i dva neutrona, a jezgro atoma 3 He sadrži isti broj protona i jedan neutron.
Spektralna analiza pokazuje njegovo prisustvo u atmosferi Sunca, zvijezda i meteorita. Akumulacija 4 He jezgara u svemiru je posljedica termonuklearne reakcije, koja služi kao izvor sunčeve i zvjezdane energije.
Joni helijuma
U normalnim uslovima, helijum je hemijski inertan, ali uz jaku ekscitaciju atoma može formirati molekularne ione He 2+. U normalnim uslovima ovi joni su nestabilni; uhvativši elektron koji nedostaje, podijelili su se na dva neutralna atoma.
Molekula i atom helija
U slobodnom stanju, helijum postoji u obliku monoatomskih molekula He.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Ugljovodonik sadrži 92,3% ugljenika (c). Izvedite molekularnu (empirijsku) formulu ugljovodonika (C x H y) ako je njegova gustina pare za helijum (He) 6,5. |
| Rješenje | Maseni udio elementa X u molekuli sastava NX izračunava se pomoću sljedeće formule: ω (X) = n × Ar (X) / M (HX) × 100%. Označimo broj atoma ugljika u molekulu sa "x", broj atoma vodika sa "y". Nađimo postotak vodonika u ugljovodoniku: ω (H) = 100% - ω (C) = 100% - 92,3% = 7,7%. Nađimo odgovarajuće relativne atomske mase elemenata ugljika i vodika (vrijednosti relativnih atomskih masa preuzete iz periodnog sistema D.I. Mendeljejeva su zaokružene na cijele brojeve). Ar(C) = 12 amu; Ar(H) = 1 amu Procentualni sadržaj elemenata dijelimo na odgovarajuće relativne atomske mase. Tako ćemo pronaći odnos između broja atoma u molekuli spoja: x:y = m(Ca)/Ar(C): m(H)/Ar(P); x:y = 92,3/12: 7,7/1; x:y:z = 7,7: 7,7 = 1:1. To znači da je najjednostavnija formula za ugljovodonik CH. M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / mol. Molarna masa organske supstance može se odrediti pomoću njene gustine helijuma: M supstanca = M(Ne) × D(Ne) ; M supstanca = 4 × 6,5 = 26 g/mol. Da bismo pronašli pravu formulu ugljikovodika, nalazimo omjer rezultirajućih molarnih masa: M supstanca / M(CH) = 26 / 13 = 2. To znači da bi indeksi atoma ugljika i vodika trebali biti 2 puta veći, tj. molekularna (empirijska) formula ugljikovodika je C 2 H 2. Ovo je acetilen. |
| Odgovori | C 2 H 2. Ovo je acetilen. |
PRIMJER 2
| Vježbajte | Boca kapaciteta 60 litara na 20 o C i 40 atm sadrži helijum. Odrediti zapreminu helijuma potrošeno na nuli ako je nakon 8 sati rada tlak u cilindru pao na 32 atm, a temperatura porasla na 22 o C. |
| Rješenje | Prvo, pretvorimo stepene u Kelvine: T 1 = 273 + 20 = 293 K; T 2 = 273 + 22 = 295 K. Prema zakonu o kombinovanom gasu: PV / T = P 0 V 0 / T 0 ; V 0 = PVT 0 / P 0 T. Za početno stanje helijuma u cilindru, smanjena zapremina je bila: V 0 početni = P 1 ×V 1 ×T 0 / P 0 ×T 1 . Za konačno stanje helijuma u cilindru, smanjena zapremina je bila: V 0 final = P 2 ×V 2 ×T 0 / P 0 ×T 2 . Izrazimo količinu potrošenog helijuma na nultom nivou: V x = V 0 početni - V 0 konačni; V x = - ; V x = (T 0 / P 0) × [(P 1 ×V 1 / T 1) - (P 2 ×V 2 / T 2)]. Pošto je kapacitet cilindra konstantan, tada je V 1 = V 2 = V, tada: V x = (T 0 ×V / P 0) × [(P 1 / T 1) - (P 2 / T 2)]; V x = (273 × 60 / 1) × [(40 / 293) - (32 / 295)] = 459 l. |
| Odgovori | 459 l. |
Ne poštuje zakone klasične mehanike. Naučnici pokušavaju da razotkriju misteriju helijuma-4. To je lagani, neradioaktivni izotop elementa. U stvari, on čini 99,9% helijuma na Zemlji.
Dakle, ako se 4. izotop ohladi na -271 stepen Celzijusa, dobiće se tečnost. Samo njegova svojstva nisu tipična za tečnost. Na primjer, primjećuje se superfluidnost.
Ako postavite helijum u posudu i postavite je okomito, tečnost će prekršiti zakone gravitacije. Nakon nekoliko minuta, sadržaj posude će iscuriti iz nje. Iz ovoga proizilazi da helijum – element radoznali, a radoznalost mora biti zadovoljena. Počnimo se upoznavati sa svojstvima materije.
Svojstva helijuma
Ne. Ovo nije čestica negacije, već oznaka 2. elementa periodnog sistema, tj. helijum. Gas u svom normalnom stanju, zgušnjava se samo na temperaturama ispod nule. Štaviše, ovaj minus bi trebao biti nekoliko stotina stepeni Celzijusa.
Istovremeno, u svojstva gasa helijuma nerastvorljivost u vodi je uključena. Odnosno, ako on sam nije, onda su njegovi molekuli u jednoj fazi, a da se ne kreću u druge. U međuvremenu, promjena faza tvari određuje formiranje otopine.
Helijum je inertan gas. Njegova inercija se očituje ne samo u nedostatku "želje" za otapanjem u vodi. Supstanca se ne žuri da uđe u druge reakcije. Razlog: - stabilna vanjska ljuska atoma.
Sadrži 2 elektrona. Teško je razbiti jak par, odnosno ukloniti jednu od čestica iz ljuske atoma. Dakle, helijum nije otkriven tokom hemijskih eksperimenata, već tokom spektroskopskog proučavanja prominencija.
To se dogodilo u drugoj polovini 19. veka. Drugi inertni gasovi, a ima ih 6, otkriveni su još kasnije. Otprilike u isto vreme, odnosno početkom 20. veka, bilo je moguće pretvoriti helijum u tečni oblik.
Helijum - jednoatomni gas bez ukusa i mirisa. Ovo je takođe izraz inercije elementa. Komunicira samo sa tri “kolege” na periodnom sistemu, -, i. Sama reakcija neće teći.
Trebate ultraljubičasto svjetlo ili strujni udar. Ali da bi helijum „pobegao“ iz epruvete ili drugog volumetrijskog tela, nije potreban nikakav napor. 2. element ima najnižu adsorpciju, odnosno sposobnost koncentracije na ravni ili u zapremini.

Store helijum gas u cilindrima. Moraju biti potpuno nepropusni. U suprotnom, adsorpcija će odigrati okrutnu šalu dobavljačima. Supstanca će prodrijeti kroz najmanje pukotine. A da su cilindri napravljeni od poroznog materijala, helijum bi izašao kroz njega.
Gustina gasa helijuma 7 puta lošiji od kiseonika. Potonji pokazatelj je 1,3 kilograma po kubnom metru. Helijum ima gustinu od samo 0,2 kilograma. Shodno tome, heroj je lak. Molarna masa helijuma jednaka 4 grama po molu.
Za poređenje, zrak u cjelini ima indikator od 29 grama. Postaje jasno zašto je popularan helijum za balone. Razlika u masama 2. elementa i zraka troši se na podizanje tereta. Zapamtite da je mol jednak 22 litre. Ispostavilo se da 22 litre helijuma može podići teret od 25 grama. Kubni metar gasa već će nositi više od kilograma.
Na kraju, napominjemo da helijum ima odličnu električnu provodljivost. Ovo se barem odnosi na gasove. Među njima, 2. više nije na drugom, već na prvom mjestu. Ali u smislu sadržaja na Zemlji, helijum nije lider. U atmosferi planete junaka članka postoje milioniti dio procenta. Pa odakle onda dolazi gas? Izvući ga iz atmosfere je nepraktično.
Ekstrakcija helijuma
Formula helijuma komponenta je ne samo atmosfere, već i prirodnog okruženja. Sadržaj 2. elementa također varira u različitim depozitima. U, na primjer, najbogatija nalazišta helijuma su na Dalekom istoku i istočnom Sibiru.
Međutim, plinska polja u ovim regijama su slabo razvijena. Sadržaj helijuma od 0,2-0,8 posto potiče njihov razvoj. Za sada se kopa samo na jednom nalazištu u zemlji. Nalazi se u Orenburgu i prepoznat je kao siromašan helijumom. Ipak, godišnje se proizvede 5.000.000 kubnih metara gasa.
Globalna proizvodnja helijuma godišnje je 175.000.000 kubnih metara. Istovremeno, rezerve gasa su 41 milijardu kubnih metara. Većina ih je skrivena u dubinama Alžira, Katara i SAD-a. takođe uključena na listu.
Helijum se dobija iz prirodnog gasa niskotemperaturnom kondenzacijom. Rezultat je koncentrat 2. elementa sa sadržajem od najmanje 80%. Još 20% dolazi od argona, neona, metana i azota. Koji gas je helijum? ometa? br. Ali nečistoće smetaju ljudima. Zbog toga se koncentrat pročišćava, pretvarajući 80% 2. elementa u 100%.

Problem je što postoji i 100% sigurnost da će se planeta suočiti s nedostatkom helijuma. Do 2030. globalna potrošnja gasa trebala bi dostići 300.000.000 kubnih metara.
Proizvodnja helijuma za 10 godina neće moći preći granicu od 240.000.000 zbog nestašice sirovina. To je neobnovljivi resurs. Drugi se oslobađa malo po malo tokom raspada radioaktivnih stijena.
Brzina prirodne proizvodnje ne može pratiti potrebe ljudi. Stoga stručnjaci predviđaju nagli skok cijena helijuma. Za sada se mala vrijednost amortizira prodajom američkog rezervnog fonda, koji je državi postalo neisplativo održavati.
Nacionalni rezervat je stvoren početkom prošlog stoljeća kako bi se punili vojni zračni brodovi i komercijalni avioni. Skladište se nalazi u Teksasu.
Primena helijuma
Helijum se može naći u rezervoarima za raketno gorivo. Tamo je 2 u blizini tečnog vodonika. Samo helijum, u isto vrijeme, može ostati u plinovitom stanju i samim tim stvoriti potreban pritisak u rezervoarima motora.
Punjenje balona je još jedan zadatak u kojem dobro dođe helijum gas. ugljični, na primjer, neće stati jer je težak. Lakši od helijuma samo jedan gas, ovo je vodonik. Osim što je eksplozivno.
Početkom prošlog veka, Hindenburg vazdušni brod je bio napunjen vodonikom i posmatrao kako se pali tokom leta. Od tada se pravi u korist inertnog, iako nešto težeg, helijuma.

Helijum je takođe popularan kao sredstvo za hlađenje. Aplikacija je povezana sa sposobnošću gasa da generiše ultra niske temperature. Helijum se kupuje za hadronske sudarače i spektrometre nuklearne magnetne rezonance. Drugi element se na isti način koristi u MRI aparatima. Tamo se helijum pumpa u superprovodnike.
Mnogi ljudi su prošli magnetnu rezonancu. Skeneri na kasama koji čitaju bar kodove također su blizu masovnog potrošača. Dakle, helijum i neon se upumpavaju u lasere za skladištenje. Odvojeno, helijum se stavlja u jonske mikroskope. Daju bolju sliku od elektronskih, moglo bi se reći, čitaju i podatke.
U sistemima za klimatizaciju, 2. je potrebno za dijagnosticiranje curenja. Super-propusnost junaka članka dobro dođe. Ako nađe negdje gdje curi, to znači da bi i druge komponente mogle „cureti“.
Govorimo o sistemima za klimatizaciju automobila. Inače, vazdušni jastuci su takođe punjeni helijumom. Prodire u kontejnere koji spašavaju život brže od drugih plinova.
Cijena helijuma
Ćao, na cijena gasa helijuma otprilike 1.300 rubalja za jedan i po kubni metar. Sadrže 10 litara 2. elementa. Postoje cilindri od 40 litara. To je skoro 6 kubnih metara helijuma. Cijena pakovanja od 40 litara je oko 4.500.

Inače, za veću nepropusnost, na plinske boce se stavljaju zaštitni poklopci. Takođe obično koštaju oko 300 rubalja za kontejner od 40 litara i 150 rubalja za cilindre od 10 litara.