Helijum je nemetal. Helijum: svojstva, karakteristike, primena
Helijum je zaista plemenit gas. Još ga nije bilo moguće natjerati na bilo kakvu reakciju. Molekul helijuma je jednoatomski.
U pogledu lakoće, ovaj gas je drugi nakon vodonika, 7,25 puta je teži od helijuma.
Helijum je skoro nerastvorljiv u vodi i drugim tečnostima. I na isti način, niti jedna supstanca se ne rastvara primjetno u tekućem heliju.
Čvrsti helijum se ne može dobiti na bilo kojoj temperaturi osim ako se ne poveća pritisak.
U istoriji otkrića, istraživanja i primene ovog elementa mogu se naći imena mnogih istaknutih fizičara i hemičara iz različitih zemalja. Za helijum su se zanimali i sa helijumom su radili: Jansen (Francuska), Lockyer, Ramsay, Crookes, Rutherford (Engleska), Palmieri (Italija), Keesom, Kamerlingh-Onnes (Holandija), Feynman, Onsager (SAD), Kapitza, Kikoin , Landau (Sovjetski Savez) i mnogi drugi istaknuti naučnici.
Jedinstveni izgled atoma helija određen je kombinacijom dvije nevjerovatne prirodne strukture - apsolutnih šampiona u kompaktnosti i snazi. U jezgri helijuma, heliju-4, obje intranuklearne ljuske su zasićene - i proton i neutron. Elektronski dublet koji uokviruje ovo jezgro je također zasićen. Ovi dizajni sadrže ključ za razumijevanje svojstava helijuma. To je izvor njegove fenomenalne hemijske inertnosti i rekordno male veličine atoma.
Uloga jezgra atoma helija - alfa čestice - je ogromna u istoriji formiranja i razvoja nuklearne fizike. Ako se sjećate, upravo je proučavanje raspršenja alfa čestica dovelo Rutherforda do otkrića atomskog jezgra. Bombardiranjem azota alfa česticama, po prvi put je postignuta međusobna konverzija elemenata - nešto o čemu su mnoge generacije alhemičara sanjale vekovima. Istina, u ovoj reakciji živa se nije pretvorila u zlato, već dušik u kisik, ali to je gotovo jednako teško učiniti. Iste alfa čestice bile su uključene u otkriće neutrona i proizvodnju prvog umjetnog izotopa. Kasnije su kurijum, berkelijum, kalifornij i mendelevijum sintetizovani pomoću alfa čestica.
Ove činjenice smo naveli samo sa jednom svrhom – da pokažemo da je element br. 2 vrlo neobičan element.
Zemaljski helijum
Helijum je neobičan element, a njegova istorija je neobična. Otkriven je u sunčevoj atmosferi 13 godina ranije nego na Zemlji. Tačnije, jarko žuta D linija otkrivena je u spektru solarne korone, a ono što se krije iza nje postalo je pouzdano poznato tek nakon što je helijum ekstrahovan iz zemaljskih minerala koji sadrže radioaktivne elemente.
Helijum na Suncu su otkrili Francuz J. Jansen, koji je svoja posmatranja izveo u Indiji 19. avgusta 1868. godine, i Englez J.H. Lockyer - 20. oktobar iste godine. Pisma oba naučnika stigla su u Pariz istog dana i pročitana su na sastanku Pariske akademije nauka 26. oktobra, u intervalu od nekoliko minuta. Akademici, zadivljeni tako čudnom slučajnošću, odlučili su da nokautiraju zlatnu medalju u čast ovog događaja.
Italijanski naučnik Palmieri je 1881. godine prijavio otkriće helijuma u vulkanskim gasovima. Međutim, nekoliko naučnika je ozbiljno shvatilo njegovu poruku, kasnije potvrđenu. Zemaljski helijum ponovo je otkrio Ramsay 1895.
U Zemljinoj kori postoji 29 izotopa, čiji radioaktivni raspad proizvodi alfa čestice - visoko aktivne, visokoenergetske jezgre atoma helija.
U osnovi, zemaljski helijum nastaje tokom radioaktivnog raspada uranijuma-238, uranijuma-235, torijuma i nestabilnih produkata njihovog raspada. Neuporedivo manje količine helijuma nastaju sporim raspadom samarija-147 i bizmuta. Svi ovi elementi stvaraju samo teški izotop helijuma - 4 He, čiji se atomi mogu smatrati ostacima alfa čestica zakopanih u omotaču od dva uparena elektrona - u elektronskom dubletu. U ranim geološkim periodima vjerovatno je postojao i drugi prirodno radioaktivan niz elemenata koji su već nestali sa lica Zemlje, zasićujući planetu helijumom. Jedna od njih bila je sada umjetno rekreirana serija neptunija.
Po količini helijuma zatvorenog u stijeni ili mineralu može se suditi o njenoj apsolutnoj starosti. Ova mjerenja su zasnovana na zakonima radioaktivnog raspada: na primjer, polovina uranijuma-238 pretvara se u helijum i olovo za 4,52 milijarde godina.
Helijum se polako akumulira u zemljinoj kori. Jedna tona granita koji sadrži 2 g uranijuma i 10 g torijuma proizvodi samo 0,09 mg helijuma tokom milion godina - pola kubnog centimetra. Vrlo mali broj minerala bogatih uranijumom i torijumom ima prilično visok sadržaj helijuma - nekoliko kubnih centimetara helijuma po gramu. Međutim, udio ovih minerala u prirodnoj proizvodnji helijuma je blizu nule, jer su vrlo rijetki.
Prirodna jedinjenja koja sadrže alfa aktivne izotope samo su primarni izvor, ali ne i sirovina za industrijsku proizvodnju helija. Istina, neki minerali guste strukture - autohtoni metali, magnetit, granat, apatit, cirkon i drugi - čvrsto zadržavaju helijum koji se nalazi u njima. Međutim, tokom vremena većina minerala prolazi kroz procese trošenja, rekristalizacije itd., a helijum ih napušta.
Mjehurići helijuma oslobođeni iz kristalnih struktura krenuli su na put preko zemljine kore. Vrlo mali dio njih se rastvara u podzemnim vodama. Za formiranje više ili manje koncentrisanih rastvora helijuma potrebni su posebni uslovi, prvenstveno visoki pritisci. Drugi dio lutajućeg helijuma bježi u atmosferu kroz pore i pukotine minerala. Preostali molekuli plina padaju u podzemne zamke, gdje se akumuliraju desetinama ili stotinama miliona godina. Zamke su slojevi rastresitih stijena, čije su praznine ispunjene plinom. Podloga za takve plinske rezervoare je obično voda i nafta, a na vrhu su prekriveni plinonepropusnim slojevima gustih stijena.
Budući da i drugi plinovi (uglavnom metan, dušik, ugljični dioksid) također putuju u zemljinoj kori, i to u mnogo većim količinama, čiste akumulacije helijuma ne postoje. Helijum je prisutan u prirodnim gasovima kao manja nečistoća. Njegov sadržaj ne prelazi hiljadite, stotinke, a rijetko i desetine procenta. Veliki (1,5...10%) sadržaj helijuma u metan-azotnim naslagama je izuzetno retka pojava.
Ispostavilo se da su prirodni plinovi praktično jedini izvor sirovina za industrijsku proizvodnju helijuma. Da bi se odvojio od drugih gasova, koristi se izuzetna isparljivost helijuma, povezana sa njegovom niskom temperaturom ukapljivanja. Nakon što se sve ostale komponente prirodnog gasa kondenzuju tokom dubokog hlađenja, gas helijum se ispumpava. Zatim se čisti od nečistoća. Čistoća fabričkog helijuma dostiže 99,995%.
Rezerve helijuma na Zemlji procjenjuju se na 5·10 14 m 3 ; sudeći po proračunima, desetine puta više ga je nastalo u zemljinoj kori tokom 2 milijarde godina. Ovaj nesklad između teorije i prakse je sasvim razumljiv. Helijum je lagan gas i, poput vodonika (iako sporije), ne izlazi iz atmosfere u svemir. Vjerovatno se tokom postojanja Zemlje helijum naše planete više puta obnavljao - stari je ispario u svemir, a umjesto njega u atmosferu je ušao svježi helijum - "izdahnut" od strane Zemlje.
U litosferi ima najmanje 200 hiljada puta više helijuma nego u atmosferi; Još više potencijalnog helijuma pohranjeno je u "materici" Zemlje - u alfa aktivnim elementima. Ali ukupan sadržaj ovog elementa u Zemlji i atmosferi je mali. Helijum je rijedak i difuzan plin. Na 1 kg zemaljskog materijala nalazi se samo 0,003 mg helijuma, a njegov sadržaj u zraku iznosi 0,00052 posto po zapremini. Tako niska koncentracija još ne dozvoljava ekonomično izdvajanje helijuma iz zraka.
Helijum u svemiru
Unutrašnjost i atmosfera naše planete siromašni su helijumom. Ali to ne znači da ga ima malo svuda u Univerzumu. Prema savremenim procjenama, 76% kosmičke mase je vodonik i 23% helijum; za sve ostale elemente ostaje samo 1%! Stoga se svjetska materija može nazvati vodonik-helijum. Ova dva elementa dominiraju zvijezdama, planetarnim maglinama i međuzvjezdanim plinom.
Rice. 1. Krivulje obilja elemenata na Zemlji (gore) iu svemiru.
“Kosmička” kriva odražava izuzetnu ulogu vodonika i helijuma u svemiru i poseban značaj helij grupe u strukturi atomskog jezgra. Najveće relativno obilje su oni elementi i oni izotopi čiji je maseni broj podijeljen na četiri: 16 O, 20 Ne, 24 Mg itd.
Vjerovatno sve planete Sunčevog sistema sadrže radiogeni (nastao tokom alfa raspada) helijum, a velike sadrže i reliktni helijum iz svemira. Helijum je u izobilju prisutan u atmosferi Jupitera: prema nekim podacima iznosi 33%, prema drugima – 17%. Ovo otkriće činilo je osnovu zapleta jedne od priča poznatog naučnika i pisca naučne fantastike A. Azimova. U središtu priče je plan (možda izvodljiv u budućnosti) za isporuku helijuma sa Jupitera, pa čak i isporuku armade kibernetičkih mašina na kriotronima do najbližeg satelita ove planete - Jupitera V (više o njima ispod). Uronjene u tečni helijum Jupiterove atmosfere (ultraniske temperature i supravodljivost neophodni su uslovi za rad kriotrona), ove mašine će pretvoriti Jupiter V u moždani centar Sunčevog sistema...
Porijeklo zvjezdanog helijuma su 1938. godine objasnili njemački fizičari Bethe i Weizsäcker. Kasnije je njihova teorija dobila eksperimentalnu potvrdu i usavršavanje uz pomoć akceleratora čestica. Njegova suština je sljedeća.
Jezgra helijuma se spajaju na zvjezdanim temperaturama iz protona u procesima fuzije koji oslobađaju 175 miliona kilovat-sati energije za svaki kilogram helijuma.
Različiti ciklusi reakcija mogu dovesti do sinteze helijuma.
U uslovima ne baš toplih zvezda, kao što je naše Sunce, proton-protonski ciklus očigledno preovlađuje. Sastoji se od tri transformacije koje se sukcesivno mijenjaju. Prvo, dva protona se kombinuju ogromnim brzinama da bi formirali deuteron – strukturu napravljenu od protona i neutrona; u ovom slučaju, pozitron i neutrino su razdvojeni. Zatim, deuteron i proton se kombinuju i formiraju lagani helijum uz emisiju gama kvanta. Konačno, dva 3 He jezgra reaguju, pretvarajući se u alfa česticu i dva protona. Alfa čestica, koja je stekla dva elektrona, tada će postati atom helija.
Isti konačni rezultat daje brži ciklus ugljik-azot, čiji značaj u solarnim uvjetima nije veliki, ali na zvijezdama toplijim od Sunca uloga ovog ciklusa raste. Sastoji se od šest koraka – reakcija. Ugljik ovdje igra ulogu katalizatora za proces fuzije protona. Energija koja se oslobađa tokom ovih transformacija je ista kao i tokom proton-protonskog ciklusa - 26,7 MeV po atomu helijuma.
Reakcija sinteze helija je osnova za energetsku aktivnost zvijezda i njihov sjaj. Shodno tome, sinteza helijuma se može smatrati praocem svih reakcija u prirodi, osnovnim uzrokom života, svjetlosti, topline i meteoroloških pojava na Zemlji.
Helijum nije uvek krajnji proizvod zvezdane fuzije. Prema teoriji profesora D.A. Frank-Kamenetsky, sekvencijalnom fuzijom jezgri helijuma, nastaju 3 Be, 12 C, 16 O, 20 Ne, 24 Mg, a hvatanje protona ovim jezgrama dovodi do stvaranja drugih jezgara. Sinteza jezgara teških elemenata do transuranskih elemenata zahtijeva izuzetne ultra visoke temperature, koje se razvijaju na nestabilnim zvijezdama "nove" i "supernove".
Poznati sovjetski hemičar A.F. Kapustinski je vodonik i helijum nazvao protoelementima - elementima primarne materije. Nije li taj primat ono što krije objašnjenje za poseban položaj vodonika i helijuma u periodnom sistemu elemenata, a posebno činjenicu da je prvi period u suštini lišen periodičnosti karakteristične za druge periode?
Najbolji...
Atom helija (aka molekula) je najjača od molekularnih struktura. Orbite njegova dva elektrona su potpuno iste i prolaze izuzetno blizu jezgra. Da bi se izložilo jezgro helijuma, potrebno je potrošiti rekordnu količinu energije - 78,61 MeV. Otuda fenomenalna hemijska pasivnost helijuma.
U proteklih 15 godina, hemičari su uspjeli dobiti više od 150 hemijskih spojeva teških plemenitih plinova (jedinjenja teških plemenitih plinova bit će razmatrana u člancima „Kripton” i „Ksenon”). Međutim, inertnost helijuma ostaje, kao i prije, izvan sumnje.
Proračuni pokazuju da čak i kada bi se pronašao način da se proizvede, recimo, helijum fluorid ili oksid, onda bi tokom formiranja apsorbirali toliko energije da bi nastale molekule "eksplodirale" ovom energijom iznutra.
Molekuli helija su nepolarni. Sile međumolekularne interakcije između njih su izuzetno male - manje nego u bilo kojoj drugoj tvari. Otuda - najniže vrijednosti kritičnih vrijednosti, najniža tačka ključanja, najniža toplota isparavanja i topljenja. Što se tiče temperature topljenja helijuma, pri normalnom pritisku ona uopšte ne postoji. Tečni helijum na temperaturi ma koliko blizu apsolutne nule ne očvršćava se osim ako, pored temperature, nije podvrgnut pritisku od 25 atmosfera ili više. Ne postoji druga ovakva supstanca u prirodi.
Ne postoji ni jedan drugi gas tako zanemarljivo rastvorljiv u tečnostima, posebno polarnim, i tako malo sklon adsorpciji kao helijum. Najbolji je provodnik struje među gasovima i drugi najbolji provodnik toplote, posle vodonika. Njegov toplotni kapacitet je veoma visok, a viskozitet nizak.
Helijum neverovatno brzo prodire kroz tanke pregrade napravljene od nekih organskih polimera, porculana, kvarca i borosilikatnog stakla. Zanimljivo je da helijum difundira kroz meko staklo 100 puta sporije nego kroz borosilikatno staklo. Helijum takođe može da prodre kroz mnoge metale. Samo željezo i metali platinske grupe, čak i kada su zagrijani, potpuno su neprobojni za njega.
Nova metoda za izdvajanje čistog helijuma iz prirodnog gasa zasniva se na principu selektivne permeabilnosti.
Naučnici pokazuju izuzetno interesovanje za tečni helijum. Prvo, to je najhladnija tekućina u kojoj se, osim toga, nijedna supstanca ne rastvara primjetno. Drugo, to je najlakša tečnost sa minimalnom površinskom napetosti.
Na temperaturi od 2,172°K dolazi do nagle promjene u svojstvima tečnog helijuma. Nastala vrsta se konvencionalno naziva helijum II. Helij II ključa potpuno drugačije od drugih tekućina; ne ključa pri ključanju, njegova površina ostaje potpuno mirna. Helijum II provodi toplotu 300 miliona puta bolje od običnog tečnog helijuma (helijum I). Viskozitet helijuma II je praktički nula, hiljadu puta je manji od viskoziteta tečnog vodonika. Dakle, helijum II ima superfluidnost - sposobnost da teče bez trenja kroz kapilare proizvoljno malog prečnika.
Drugi stabilni izotop helijuma, 3 He, prelazi u superfluidno stanje na temperaturi koja je samo stoti dio stepena udaljena od apsolutnog metka. Superfluidni helijum-4 i helijum-3 nazivaju se kvantnim tečnostima: pokazuju kvantno mehaničke efekte čak i prije nego što se stvrdnu. Ovo objašnjava veoma detaljno proučavanje tečnog helijuma. A sada ga proizvode mnogo - stotine hiljada litara godišnje. Ali čvrsti helijum jedva da je proučavan: eksperimentalne poteškoće proučavanja ovog najhladnijeg tijela su velike. Nesumnjivo će ovaj jaz biti popunjen, jer fizičari očekuju mnogo novih stvari od razumijevanja svojstava čvrstog helijuma: na kraju krajeva, i on je kvantno tijelo.
Inertan, ali veoma potreban
Krajem prošlog vijeka engleski časopis Punch objavio je crtani film u kojem je helijum prikazan kao lukavo namigujući čovjek - stanovnik Sunca. Tekst ispod slike je glasio: „Konačno sam uhvaćen na Zemlji! Ovo je trajalo dovoljno dugo! Pitam se koliko će proći dok ne shvate šta će sa mnom?”
Zaista, prošle su 34 godine od otkrića zemaljskog helijuma (prvi izvještaj o tome objavljen je 1881.) prije nego što je našao praktičnu upotrebu. Određenu ulogu ovdje su igrala izvorna fizička, tehnička, električna i, u manjoj mjeri, kemijska svojstva helijuma, koja su zahtijevala dugo proučavanje. Glavne prepreke bile su odsutnost i visoka cijena elementa br. 2.
Nemci su prvi upotrijebili helijum. Godine 1915. počeli su puniti njime svoje vazdušne brodove koji su bombardovali London. Ubrzo je lagani, ali nezapaljivi helijum postao nezamjenjivo punilo za aeronautička vozila. Pad izgradnje vazdušnih brodova koji je počeo sredinom 30-ih doveo je do određenog pada proizvodnje helijuma, ali samo na kratko. Ovaj gas je sve više privlačio pažnju hemičara, metalurga i mašinskih inženjera.
Mnogi tehnološki procesi i operacije se ne mogu izvoditi u zraku. Da bi se izbjegla interakcija rezultirajuće supstance (ili sirovine) sa vazdušnim gasovima, stvaraju se posebna zaštitna okruženja; a za ove svrhe ne postoji pogodniji gas od helijuma.
Inertan, lagan, pokretljiv i dobar provodnik toplote, helijum je idealno sredstvo za presovanje lako zapaljivih tečnosti i praha iz jedne posude u drugu; Upravo te funkcije obavlja u projektilima i vođenim projektilima. Pojedinačne faze proizvodnje nuklearnog goriva odvijaju se u okruženju zaštitnom od helijuma. Gorivi elementi nuklearnih reaktora skladište se i transportuju u kontejnerima napunjenim helijumom.
Uz pomoć specijalnih detektora curenja, čije se djelovanje zasniva na izuzetnoj difuzionoj sposobnosti helijuma, identificiraju i najmanju mogućnost curenja u nuklearnim reaktorima i drugim sistemima pod pritiskom ili vakuumom.
Posljednje godine obilježen je ponovnim usponom izgradnje dirižabl, sada na višoj naučno-tehničkoj osnovi. U nizu zemalja izgrađeni su i grade se vazdušni brodovi sa punjenjem helijuma nosivosti od 100 do 3000 tona, ekonomični su, pouzdani i pogodni za transport velikih tereta, kao što su gasovodi, rafinerije nafte, električna energija. linijski nosači itd. Punjenje od 85% helijuma i 15% vodonika je otporno na vatru i smanjuje podizanje samo za 7% u poređenju sa vodoničnim punjenjem.
Počeli su sa radom visokotemperaturni nuklearni reaktori novog tipa, u kojima helijum služi kao rashladno sredstvo.
Tečni helijum se široko koristi u naučnim istraživanjima i tehnologiji. Ultraniske temperature favorizuju dubinsko poznavanje materije i njene strukture - na višim temperaturama suptilni detalji energetskih spektra su maskirani toplotnim kretanjem atoma.
Već postoje supravodljivi solenoidi napravljeni od specijalnih legura koji stvaraju jaka magnetna polja na temperaturama tečnog helijuma (do 300 hiljada ersteda) uz zanemarljivu potrošnju energije.
Na temperaturi tekućeg helijuma, mnogi metali i legure postaju supravodnici. Superprovodljivi releji - kriotroni - se sve više koriste u dizajnu elektronskih računara. Jednostavni su, pouzdani i vrlo kompaktni. Superprovodnici, a sa njima i tečni helijum, postaju neophodni za elektroniku. Uključeni su u dizajn detektora infracrvenog zračenja, molekularnih pojačivača (mazera), optičkih kvantnih generatora (lasera) i instrumenata za mjerenje ultravisokih frekvencija.
Naravno, ovi primjeri ne iscrpljuju ulogu helijuma u modernoj tehnologiji. Ali da nije bilo ograničene prirode prirodnih resursa i ekstremne disipacije helijuma, našla bi mnogo više primjena. Poznato je, na primjer, da kada se konzerviraju u helijumu, prehrambeni proizvodi zadržavaju svoj izvorni okus i aromu. Ali “helijumska” konzervirana hrana i dalje ostaje “stvar za sebe”, jer helijuma nema dovoljno i koristi se samo u najvažnijim industrijama i gdje se bez njega ne može. Stoga je posebno uvredljivo shvatiti da sa zapaljivim prirodnim plinom mnogo veće količine helijuma prolaze kroz aparate za kemijsku sintezu, peći i peći i bježe u atmosferu nego one izvučene iz izvora koji sadrže helijum.
Sada se smatra isplativim oslobađati helijum samo u slučajevima kada njegov sadržaj u prirodnom gasu nije manji od 0,05%. Zalihe takvog gasa se konstantno smanjuju, a moguće je da će biti iscrpljene do kraja ovog veka. Međutim, problem “nedostatka helija” će vjerovatno biti riješen do tada – dijelom kroz stvaranje novih, naprednijih metoda za odvajanje plinova, izdvajanje iz njih najvrednijih, iako beznačajnih frakcija, a dijelom zahvaljujući kontroliranoj termonuklearnoj fuziji. Helijum će postati važan, iako nusproizvod, aktivnosti “vještačkog sunca”.
Izotopi helijuma
U prirodi postoje dva stabilna izotopa helijuma: helijum-3 i helijum-4. Laki izotop je milion puta manje raspoređen na Zemlji od teškog. Ovo je najrjeđi stabilni izotop koji postoji na našoj planeti. Još tri izotopa helijuma su dobivena umjetnim putem. Svi su radioaktivni. Poluživot helijuma-5 je 2,4·10 –21 sekundi, helijuma-6 je 0,83 sekunde, helijuma-8 je 0,18 sekundi. Najteži izotop, zanimljiv jer se u njegovim jezgrama nalaze tri neutrona po protonu, prvi put je proučavan u Dubni 60-ih godina. Pokušaji da se dobije helijum-10 do sada su bili neuspješni.
Poslednji čvrsti gas
Helijum je bio poslednji od svih gasova koji je preveden u tečno i čvrsto stanje. Posebne poteškoće ukapljivanja i učvršćivanja helijuma objašnjavaju se strukturom njegovog atoma i nekim karakteristikama njegovih fizičkih svojstava. Konkretno, helijum, poput vodonika, na temperaturama iznad – 250°C, kada se širi, ne hladi se, već se zagrijava. S druge strane, kritična temperatura helijuma je izuzetno niska. Zato je tek 1908. prvi put dobijen tečni helijum, a 1926. čvrsti helijum.
Helijum vazduh
Zrak u kojem je cijeli ili veći dio dušika zamijenjen helijumom danas više nije vijest. Široko se koristi na kopnu, pod zemljom i pod vodom.
Helijumski vazduh je tri puta lakši i mnogo pokretniji od običnog vazduha. Ponaša se aktivnije u plućima - brzo opskrbljuje kisik i brzo evakuira ugljični dioksid. Zato se helijumski vazduh daje pacijentima sa poremećajima disanja i nekim operacijama. Ublažava gušenje, liječi bronhijalnu astmu i bolesti larinksa.
Udisanje helijumskog vazduha praktično eliminiše azotnu emboliju (kesonsku bolest), kojoj su podložni ronioci i specijalisti drugih struka koji rade u uslovima visokog pritiska prilikom prelaska sa visokog pritiska na normalan. Uzrok ove bolesti je prilično značajan, posebno kod visokog krvnog pritiska, rastvorljivosti azota u krvi. Smanjenjem pritiska oslobađa se u obliku mjehurića plina, koji mogu začepiti krvne sudove, oštetiti nervne čvorove... Za razliku od azota, helijum je praktično nerastvorljiv u tjelesnim tekućinama, pa ne može izazvati dekompresijsku bolest. Osim toga, helijumski zrak eliminira pojavu "narkoze dušikom", koja je izvana slična alkoholnoj intoksikaciji.
Prije ili kasnije, čovječanstvo će morati naučiti živjeti i dugo raditi na morskom dnu kako bi ozbiljno iskoristilo mineralne i prehrambene resurse šelfa. A na velikim dubinama, kao što su pokazali eksperimenti sovjetskih, francuskih i američkih istraživača, helijumski zrak je još uvijek neophodan. Biolozi su dokazali da produženo udisanje helijuma zraka ne uzrokuje negativne promjene u ljudskom tijelu i ne prijeti promjenama u genetskom aparatu: atmosfera helija ne utječe na razvoj stanica i učestalost mutacija. Postoje radovi čiji autori smatraju da je helijumski vazduh optimalan vazdušni medij za letove u dugim letovima u svemir. Ali do sada se umjetni helijumski zrak još nije izdigao izvan Zemljine atmosfere.
Postoji tri glavna izvora prijema helijum:
- iz prirodnih gasova koji sadrže helijum
- od minerala
- iz ničega
Proizvodnja helijuma iz prirodnog gasa
Glavna metoda proizvodnje helijuma je metoda frakcijske kondenzacije iz prirodnih plinova koji sadrže helijum, tj. metoda dubokog hlađenja. Štaviše, koristi se njegovo karakteristično svojstvo - najniža tačka ključanja u poređenju sa poznatim supstancama. Ovo omogućava kondenzaciju svih gasova koji prate helijum, prvenstveno metana i azota. Proces se obično odvija u dvije faze:
- oslobađanje takozvanog sirovog helijuma (koncentrat koji sadrži 70-90% He)
- prečišćavanje kako bi se dobio tehnički čisti helijum.
Na slici ispod prikazan je jedan od dijagrama instalacije za ekstrakciju helijuma iz prirodnog plina.
Plin se komprimira na 25 atmosfera i pod tim pritiskom ulazi u instalaciju. Čišćenje od (CO 2) i delimično isušivanje gasa vrši se u skruberima, koji se navodnjavaju rastvorom koji sadrži 10-20% monoetanolamina, 70-80% dietilen glikola i 5-10% vode. Nakon pročišćavanja, 0,003-0,008% ugljičnog dioksida CO 2 ostaje u plinu, a tačka rose ne prelazi 5°C. Dalje sušenje se vrši u adsorberima sa silika gelom, gde se postiže temperatura tačke rose od -45°C.
Pod pritiskom od oko 20 atmosfera, čisti suvi gas ulazi u preliminarni izmenjivač toplote 1, gde se obrnutim tokovima gasa hladi na -28°C. U tom slučaju dolazi do kondenzacije teških ugljovodonika koji se izdvajaju u separatoru 2. U frižideru amonijaka 3 gas se hladi na -45°C, kondenzat se odvaja u separatoru 4. U glavnom izmenjivaču toplote 5 gas se temperatura se smanjuje na -110°C, usled čega značajan deo gasa predstavlja kondenzovani metan Smjesa para-tečnost (oko 20% tečnosti) se prigušuje do pritiska od 12 atmosfera u prvom protivtočnom kondenzatoru 6, na čijem je izlazu smeša para-gas obogaćena helijumom do 3%. Kondenzat koji nastaje u cijevima teče u odsječak za skidanje, na čijim pločama se iz tekućine uklanja helij otopljen u njemu, koji se pridružuje strujanju pare i plina.
Tečnost se gasi do 1,5 atmosfere u prstenasti deo kondenzatora, gde služi kao rashladno sredstvo. Para koja se ovde formira odvodi se preko izmenjivača toplote 5 i 1. Smeša pare i gasa koja izlazi iz kondenzatora 6 i koja sadrži do 3% He, pod pritiskom od 12 atmosfera, odlazi u drugi protivtočni kondenzator 7, koji se sastoji od dva dela. : u donjem dijelu se nalazi izmjenjivač topline na zavojnicu, u čijim cijevima isparava donja tekućina, prigušena od 12 do 1,5 atmosfere, au gornjem dijelu je pravocijevni izmjenjivač topline, u međucijevi prostor u kome dušik ključa na temperaturi od -203°C i pritisku od 0,4 atmosfere. Kao rezultat kondenzacije komponenti gasne mešavine u donjem delu aparata 7, gas je obogaćen helijumom do 30-50%, au gornjem delu - do 90-92%.
Sirovi helijum ovog sastava pod pritiskom od 11-12 atmosfera ulazi u izmjenjivače topline, gdje se zagrijava i uklanja iz instalacije. Budući da prirodni plin sadrži male nečistoće vodika, koncentracija vodonika u sirovom heliju raste na 4-5%. Vodik se uklanja katalitičkom hidrogenizacijom nakon čega slijedi sušenje plina u adsorberima sa silika gelom. Sirovi helijum se komprimira na 150-200 atmosfera pomoću membranskog kompresora 8, hladi u izmjenjivaču topline 9 i dovodi u kondenzator zavojnice s direktnim protokom 10, hlađen ključanjem dušika pod vakuumom. Kondenzat (tečnost) se sakuplja u separatoru 11 i periodično uklanja, a nekondenzovani gas koji sadrži približno 98% He odlazi u adsorber 12 sa aktivnim ugljem, hlađen tečnim azotom. Helij koji izlazi iz adsorbera sadrži nečistoće manje od 0,05% i ulazi u cilindre 13 kao proizvod.
Prirodni gasovi u SAD posebno su bogati helijumom, što određuje široku upotrebu helijuma u ovoj zemlji.
Dobivanje helijuma iz minerala
Drugi izvor helijuma je neki radioaktivnih minerala koji sadrže uranijum, torijum i samarijum:
- kleveta
- fergusonit
- samarskite
- gadolinit
- monazit
- torijanit
Posebno monazitni pijesak, čije je veliko ležište u Travancoreu (Indija): monaziti ovog ležišta sadrže oko 1 cm 3 helijuma na 1 g rude.
Da bi se helijum dobio iz monocita, potrebno je zagrijati monocit u zatvorenoj posudi na 1000°C. Helij se oslobađa zajedno s ugljičnim dioksidom (CO 2), koji se zatim apsorbira otopinom natrijevog hidroksida (NaOH). Preostali gas sadrži 96,6% He. Dalje prečišćavanje se vrši na 600°C na metalnom magnezijumu kako bi se uklonio dušik, a zatim na 580°C na metalnom kalciju da bi se uklonile preostale nečistoće. Proizvodni gas sadrži preko 99,5% He. Od 1000 tona monazitnog pijeska možete dobiti oko 80 m 3 čistog helijuma. Takve metoda za proizvodnju helijuma nije od tehničkog ili industrijskog interesa..
Dobijanje helijuma iz vazduha
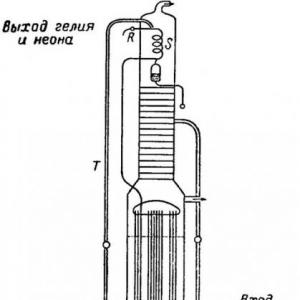
Helijum se nalazi u malim količinama u vazduhu, iz kojeg se može dobiti kao nusproizvod u proizvodnji kisika i dušika iz zraka, opisano u članku "". U industrijskim destilacionim kolonama za odvajanje zraka iznad tekućeg dušika, skuplja se preostala plinovita mješavina neona i helijuma. Slika ispod pokazuje Claudeov aparat, posebno prilagođen za odvajanje takve smjese.

Gas koji izlazi iz aparata kroz ventil D se hladi u kalemu S, koji se sipa tečnim azotom iz T radi kondenzacije zaostalog azota. Ako se ventil R lagano otvori, dobija se smjesa koja sadrži vrlo malo dušika. Kod ovog načina industrijske proizvodnje helijuma, pored težine potrebe za preradom velike količine zraka, postoji i dodatna poteškoća - potreba odvajanje helijuma od neona. Ovo odvajanje se može postići korištenjem tekućeg vodonika u kojem je neon očvrsnut, ili adsorpcijom neona na aktivni ugalj ohlađen tekućim dušikom.
Dobijanje helijuma iz vazduha je nepraktično zbog male količine - 0,00046% zapremine ili 0,00007% težine. Proračuni pokazuju da će trošak jednog kubnog metra helijuma izvađenog iz zraka biti hiljadama puta veći nego kada se vadi iz prirodnih plinova. Ovako visoka cijena, naravno, isključuje mogućnost industrijskog odvajanja helijuma iz zraka.
Na primjer: Da biste izvukli 1 kubni metar helijuma, trebate osloboditi 116 tona dušika.
Hemijski element helijum prvo je otkriven na Suncu, a tek potom na Zemlji.
Ključnu ulogu u istoriji otkrića helijuma odigrao je Norman Lockyer, osnivač jedne od vodećih svjetskih naučnih publikacija - časopisa Priroda. Pripremajući se za izdavanje časopisa, upoznao se sa londonskim naučnim establišmentom i zainteresovao se za astronomiju. To je bilo vrijeme kada su, inspirirani otkrićem Kirchhoff-Bunsena, astronomi tek počeli proučavati spektar svjetlosti koju emituju zvijezde. Sam Lockyer je uspio napraviti niz važnih otkrića – posebno, on je prvi pokazao da su sunčeve pjege hladnije od ostatka Sunčeve površine, a također je bio prvi koji je ukazao da Sunce ima vanjsku školjku, tzv. to hromosfera. Godine 1868, dok je proučavao svjetlost koju emituju atomi u prominencijama - ogromnim izbacivanjima plazme sa površine Sunca - Lockyer je primijetio niz do tada nepoznatih spektralnih linija ( cm. Spektroskopija). Pokušaji dobivanja istih linija u laboratoriji su propali, iz čega je Lockyer zaključio da je otkrio novi kemijski element. Lockyer ga je nazvao helijum, sa grčkog helios- "Sunce".
Naučnici su bili zbunjeni kako da reaguju na pojavu helijuma. Neki su sugerisali da je napravljena greška u tumačenju spektra prominencija, ali ovo gledište dobija sve manje i manje pristalica jer je sve više astronoma bilo u stanju da posmatra Lockyerove linije. Drugi su tvrdili da Sunce sadrži elemente koji ne postoje na Zemlji - što je, kao što je već spomenuto, u suprotnosti s glavnom tvrdnjom o zakonima prirode. Drugi pak (postojala je manjina) vjerovali su da će jednog dana helijum biti pronađen na Zemlji.
Krajem 1890-ih, Lord Rayleigh i Sir William Ramsay izveli su niz eksperimenata koji su doveli do otkrića argona. Ramsay je modificirao svoju postavku kako bi je koristio za proučavanje plinova koje oslobađaju minerali koji sadrže uranijum. Ramsay je otkrio nepoznate linije u spektru ovih gasova i poslao uzorke nekolicini kolega na analizu. Nakon što je primio uzorak, Lockyer je odmah prepoznao linije koje je uočio na sunčevoj svjetlosti prije više od četvrt stoljeća. Misterija helijuma je riješena: plin se nesumnjivo nalazi na Suncu, ali postoji i ovdje na Zemlji. Danas je ovaj plin najpoznatiji u svakodnevnom životu kao plin za naduvavanje zračnih brodova i balona ( cm. Grahamov zakon), a u nauci – zahvaljujući njegovoj primjeni u kriogenika, tehnologije za postizanje ultraniskih temperatura.
Koronijum i nebulijum
Pitanje da li negdje u svemiru postoje hemijski elementi koji se ne nalaze na Zemlji nije izgubilo na važnosti u 20. vijeku. Prilikom proučavanja vanjske solarne atmosfere - solarna krune, koji se sastoji od vruće, visoko razrijeđene plazme, astronomi su otkrili spektralne linije koje nisu mogli identificirati ni sa jednim od poznatih zemaljskih elemenata. Naučnici su sugerirali da ove linije pripadaju novom elementu, koji se zove koronijum. I pri proučavanju spektra nekih magline- udaljene akumulacije gasova i prašine u Galaksiji - otkrivene su još jedne misteriozne linije. Pripisivali su im se još jedan "novi" element - nebulija. Tridesetih godina prošlog stoljeća američki astrofizičar Ira Sprague Bowen (1898-1973) došao je do zaključka da linije magline zapravo pripadaju kisiku, ali su taj izgled dobile zbog ekstremnih uvjeta koji postoje na Suncu i u maglinama, a ti uvjeti se ne mogu reproducirati. u zemaljskim laboratorijama. Ispostavilo se da je koronijum visoko jonizovano gvožđe. I ove linije su dobile ime zabranjene linije.
Joseph Norman LOCKYER
Joseph Norman Lockyer, 1836-1920
engleski naučnik. Rođen u gradu Ragbi u porodici vojnog lekara. Lockyer je u nauku došao na neobičan način, započevši svoju karijeru kao službenik u Ministarstvu rata. Da bi zaradio dodatni novac, iskoristio je interes javnosti za nauku i počeo da izdaje naučnopopularni časopis. Prvi broj časopisa izašao je 1869 Priroda, a 50 godina Lockyer je ostao njegov urednik. Učestvovao je u mnogim ekspedicijama posmatrajući potpune pomračenja Sunca. Jedna od ovih ekspedicija dovela ga je do otkrića helijuma. Lockyer je također poznat kao osnivač arheoastronomije - nauke koja proučava astronomsko značenje drevnih građevina kao što je Stonehenge - i autor mnogih popularnih naučnih knjiga.
Tečnost
Helijum nalazi se pod drugim atomskim brojem u Mendeljejevom periodnom sistemu elemenata. Ovo je jedan od glavnih elemenata inertne grupe gasova. Helijum je označen latinskim slovima "He" i ima atomski broj dva. Ovaj gas je bez mirisa, boje i ukusa.
Plin helijum je jedan od najzastupljenijih elemenata u svemiru i po količini je odmah iza vodonika. Helijum je takođe jedan od najlakših elemenata. Za dobivanje helijuma koristi se metoda frakcijske destilacije (postupak niskotemperaturne separacije).
Otkriće helijuma
Tokom pomračenja Sunca u gradu Gunturu 1868. godine, francuski naučnik Pierre Jansen je bio u mogućnosti da ispita hromosferu Sunca pomoću spektroskopa. Bio je u stanju da utvrdi da ispupčenja Sunca sadrže ne samo vodonik, već i druge elemente. U to vrijeme, novi element se smatrao natrijum D. Ali Pierre Jansen je napisao pismo Francuskoj akademiji nauka, gdje je izložio svoju teoriju o otkriću novog elementa.
Nekoliko mjeseci kasnije, astronom iz Engleske, Norman Lockyer, proveo je vlastito istraživanje i, također pomoću spektroskopa, identificirao novu liniju u spektru nepoznatog elementa dužine 587,56 nm. Dok je radio zajedno sa svojim prijateljem hemičarem Edwardom Franklandom, Norman Lockyer je dao ime otkrivenom elementu - helijum, što je na starogrčkom značilo "Sunce".
U čast otkrića novog elementa, Francuska akademija odlučila je dodijeliti medalje časti obojici naučnika, Normanu Lockyeru i Pierreu Jansenu.
Italijan Luigi Palmieri je bio u stanju da identifikuje helijum tokom svojih studija vulkanskih gasova 1881. Luigi Palmieri je koristio kalcinaciju da zagrije vulkanski proizvod u Bunsenovom plameniku i pokušao je odrediti puni spektar nastalih plinova. Ali Palmieri nikada nije mogao jasno formulirati svoje istraživanje i stoga njegovim eksperimentima nije pridavana velika važnost. Ali mnogo godina kasnije, helijum i argon su zapravo otkriveni u vulkanskim gasovima.
Otkriće helijuma na Zemlji dogodilo se 1895. godine, kada je škotski hemičar William Ramsay proučavao plinove dobivene razgradnjom minerala kleveita. Koristeći spektrometar, uspio je otkriti žutu liniju u spektru plinova, što je ukazivalo na prisustvo helijuma. Za dalja istraživanja, William Ramsay je poslao uzorke naučniku Williamu Crookesu. Dodatne studije su pokazale da se žuta linija poklapa sa spektrom prethodno otkrivenog helijuma u hromosferi Sunca. Nakon toga, švedski hemičari N. Lenglet i P. Kleve uspjeli su precizno odrediti atomsku težinu helijuma ponavljajući Ramsayeve eksperimente s kleveitom. Konačnu tačku u otkriću helijuma na Zemlji 1896. godine postavili su Siegbert Friedländer, Edward Baley i Heinrich Kaiser, koji su utvrdili prisustvo helijuma u atmosferi naše planete.
Nakon toga, Ramsay je nastavio svoja istraživanja o helijumu i otkrio da helijum često prati torij i uranijum. Naučnici Royds i Rusenford su 1906. otkrili da su alfa čestice ovih radioaktivnih elemenata jezgra helijuma. Upravo zahvaljujući Ramsayevom istraživanju postavljen je početak teorije atomske strukture.
Tečni helijum je prvi put dobio prigušivanjem od strane fizičara iz Holandije, Heike Kamerlingh-Onnes. On je hladio helijum u vodiku koji je ključao u vakuumu. Do 1926. nije bilo moguće dobiti čvrsti helijum. Njemački fizičar Willem Hendrik uspio je komprimirati helij pod visokim pritiskom i odvojiti kristale.
Naučnik Kees je 1932. godine proučavao zavisnost toplotnog kapaciteta tečnog helijuma o temperaturi. Naučio je da se na temperaturi od 2,1 K (tačna vrijednost = 2,172 K.), glatki porast toplotnog kapaciteta helijuma zamjenjuje naglim padom i grafikon toplinskog kapaciteta izgleda kao grčko slovo “lambda” (?). Zbog ovog otkrića, ova temperaturna tačka je dobila naziv “?-tačka”. U ovom trenutku se dešavaju globalne promjene sa helijumom. Jedna faza tekućeg helijuma zamjenjuje drugu bez oslobađanja toplote. Helijum ispod "?-tačke" dobio je oznaku helijum-II, a iznad njega helijum-I.
Fenomen superfluidnosti helijuma prvi je otkrio sovjetski naučnik Pjotr Leonidovič Kapica, koji je proučavao svojstva tečnog helijuma-II. Bio je u stanju da dokaže da tečni helijum-II teče gotovo bez trenja.
porijeklo imena
Reč helijum ima završetak "-j" (latinski "-um" - "helijum"), što je tipično za označavanje metala u periodnom sistemu elemenata. To je zbog činjenice da je Lockyer, kada je otkrio helijum, pretpostavio da je to metal i dao mu to ime. I više ga nije bilo moguće preimenovati u "Helion" sa završetkom "-on", jer je ovo ime dodijeljeno jezgru lakog izotopa helijuma (helijum-III)
Pronalaženje helijuma
U svemiru
U Univerzumu, helijum je na drugom mjestu po obilju. Većina helijuma u svemiru nastala je nakon Velikog praska, tokom perioda primarne nukleosinteze. U ovom trenutku, helijum nastaje u svemiru zbog termonuklearne fuzije vodonika u utrobi zvijezda. Mali dio helijuma nastaje u zemljinoj kori tokom alfa raspada teških elemenata i prodire kroz zemljinu koru, vezujući se za čestice prirodnog gasa. Koncentracija helijuma u prirodnom plinu može doseći sedam posto ili više po zapremini.
U zemljinoj atmosferi
Helijum u Zemljinoj atmosferi nastaje kao rezultat raspadanja elemenata Ac, Th, U. A sadržaj helijuma u atmosferi dostiže 7,24?10?5% po masi i 5,27?10?4% po zapremini. Rezerve helijuma se procjenjuju na približno 5?1014 m?. Obično koncentracija helijuma u drugim gasovima ne prelazi dva posto, au vrlo rijetkim slučajevima postoje plinovi u kojima sadržaj helijuma dostiže 8-15%.
U zemljinoj kori
Helijum je na drugom mestu nakon argona po sadržaju u zemljinoj kori. U kopnenoj materiji, sadržaj helijuma se procjenjuje na približno 3 g/t. Najveća koncentracija helija uočena je u mineralima koji sadrže torij, samarijum, uranijum, monazit, gadolinit, fergusonit, kleveit i torijanit. Istovremeno, u torijanitu sadržaj helijuma može dostići 10,5 l/kg, u ostatku minerala se kreće od 0,8 do 3,5 l/kg.
Definicija helijuma
Za kvalitativno određivanje helijuma koristi se analiza emisionih spektra (linije 388,86 nm i 587,56 nm). Helij se kvantitativno određuje hromatografskim i masenim spektrometrijskim metodama. Koriste se i metode koje se zasnivaju na mjerenju fizičkih svojstava helijuma, kao što su gustina, toplotna provodljivost i tako dalje.
Fizička svojstva helijuma
Helijum je inertan hemijski element. Netoksičan je, bezbojan, bez ukusa i mirisa. U normalnim uslovima, helijum je jednoatomski gas sa tačkom ključanja od 4,215 K (helijum IV). Čvrsto stanje helijuma postiže se samo pri pritisku od oko 25 atmosfera ili više. Bez pritiska, helijum ne prelazi u čvrsto stanje čak ni na temperaturama blizu apsolutne nule. Većina jedinjenja helijuma je nestabilna u normalnim uslovima i zahtevaju posebne uslove za formiranje veza.
Uticaj helijuma na organizam
Najvećim dijelom inertni plinovi djeluju na tijelo, uzrokujući trovanje drogom. Izlaganje jednostavnom helijumu pri normalnom pritisku nema efekta na organizam. Kada se krvni tlak poveća, osoba može doživjeti sindrom visokog krvnog tlaka.
Svojstva u gasnoj fazi
Helijum se u normalnim uslovima ponaša kao idealan gas. U većini manifestacija, helijum je poliatomski gas sa gustinom od 0,17847 kg/m?. Toplotna provodljivost helijuma u normalnim uslovima je 0,1437 W/(mK), veća od vodonika i drugih gasova. Specifični toplotni kapacitet u normalnim uslovima je 5,23 kJ/(kg.K), au vodoniku 14,23 kJ/(kg.K).
Kada se struja propušta kroz cijev napunjenu helijumom, mogu se uočiti pražnjenja različitih boja, koja zavise od pritiska u cijevi. Ako smanjite pritisak, boje će se promijeniti od ružičaste, žute do zelene i narančaste. Ovo se objašnjava činjenicom da spektar helijuma sadrži nekoliko linija koje se kreću od ultraljubičastog do infracrvenog spektra. Glavne linije spektra helijuma leže u rasponu između 706,52 nm i 447,14 nm. Smanjenje tlaka u cijevi dovodi do povećanja dužine putanje elektrona, a energija njegovog sudara s atomima helija se povećava. Kao rezultat toga, atomi su pobuđeni i veće energije, što dovodi do pomaka u spektralnim linijama.
Helijum je slabo rastvorljiv u vodi u poređenju sa drugim gasovima. Na temperaturi od 20 °C, samo 8,8 ml helijuma se rastvara u jednom litru vode. 2,5 ml se rastvara u etanolu na 15°C i 3,2 ml na 25°C. Brzina difuzije helijuma u čvrstim materijalima je nekoliko puta veća nego kod drugih plinova. Na primjer, difuzija helijuma je 65% veća od difuzije vodonika
Helijum ima indeks prelamanja bliži jedinici od drugih gasova. Helijum na normalnoj temperaturi ima negativan Joule-Thomsonov koeficijent. Odnosno, ne zagrijava se kada se slobodno širi u volumenu. Helijum se hladi tokom slobodnog širenja samo na temperaturama ispod 40 K (ispod Joule-Thomsonove inverzijske temperature) pri normalnom pritisku. Kako temperatura opada, helijum može da pređe u tečno stanje tokom ekspanzionog hlađenja. Takvo hlađenje je moguće pomoću ekspandera.
Hemijska svojstva helijuma
Helijum je jedan od najmanje aktivnih hemijskih elemenata među inertnim gasovima. Većina jedinjenja helijuma postoji u gasnoj fazi, u obliku ekscimernih molekula, koji imaju nestabilno osnovno stanje i stabilno pobuđeno elektronsko stanje. Helijum je sposoban da formira dvoatomske molekule (He2), jedinjenja sa fluorom (HeF) i hlorom (HeCl).
Proizvodnja helijuma
Industrijski se za proizvodnju helijuma koriste nalazišta prirodnih gasova koji sadrže helijum. Duboko hlađenje se koristi za odvajanje helijuma od drugih gasova. Helijum se bolje ukapljuje od drugih gasova. Koristeći prigušivanje, helijum se pročišćava od ugljičnog dioksida i ugljikovodika u nekoliko faza. Rezultat je mješavina nekoliko plinova (helijum, vodonik i neon). Zatim se koristi CuO i temperatura od 650-800 K za odvajanje vodonika od helijuma. Helij se konačno pročišćava hlađenjem smjese u ključajućem vakuumu i adsorpcijom preostalih nečistoća. Ova metoda proizvodi čisti helijum (do 99,8% zapremine)
U Rusiji se helijum dobija iz nafte ili prirodnog gasa. Glavna ruska fabrika za proizvodnju helijuma je Gazprom Dobycha Orenburg LLC. Ova biljka izdvaja helijum iz gasa sa niskim sadržajem helijuma, što povećava njegovu konačnu cenu. Da bi se smanjila cijena helijuma, razvijeni su projekti za razvoj nalazišta u istočnom Sibiru i na Dalekom istoku. U ovoj fazi, glavni dobavljač helijuma na svjetsko tržište su Sjedinjene Američke Države, na koje otpada oko 140 miliona m? helijum godišnje. Sva najveća nalazišta helijuma nalaze se u Sjedinjenim Državama. Rusija je na trećem mjestu po proizvodnji helijuma nakon Sjedinjenih Država i Alžira.
Transport helijuma
Za transport helijuma koriste se specijalne plinske boce (GOST 949-73). Ovi cilindri moraju biti smješteni u posebne posude kako bi se izbjegla oštećenja tokom putovanja. Za transport upakovanih helijumskih boca možete koristiti bilo koje vozilo pogodno za transport gasova. Tečni helijum se transportuje u posebnim transportnim kontejnerima. Prilikom transporta tečnog helijuma, kontejneri koji sadrže helijum moraju biti u uspravnom položaju. Uz pravilan transport, helijum se može transportovati i željeznicom i specijalnim vozilima.
Primena helijuma
Helijum se široko koristi u nacionalnoj ekonomiji i industriji. U metalurgiji se helijum koristi za topljenje čistih metala. Helijum se koristi kao E939 aditiv za hranu i sredstvo za pakovanje. Zbog svojih jedinstvenih svojstava, helijum se koristi kao rashladno sredstvo. Helijum se puni u balone, koristi se u medicini kao smeša za disanje, koristi se u laserima i kao rashladno sredstvo u kotlovima i cevovodima.
Helijum
HELIJ-I; m.[iz grčkog hēlios - sunce]. Hemijski element (He), hemijski inertan gas bez mirisa, najlakši je nakon vodonika.
◁ Helijum, oh, oh. G-to jezgro.
Helijum(lat. Helijum), hemijski element VIII grupe periodnog sistema, pripada plemenitim gasovima; bez boje i mirisa, gustina 0,178 g/l. Teže je za ukapljivanje od svih poznatih gasova (na -268,93ºC); jedina supstanca koja se ne stvrdne pod normalnim pritiskom, ma koliko duboko bila ohlađena. Tečni helijum je kvantna tečnost sa superfluidnošću ispod 2,17ºK (-270,98ºC). Helijum se u malim količinama nalazi u vazduhu i zemljinoj kori, gde se neprestano stvara tokom raspada uranijuma i drugih α-radioaktivnih elemenata (α-čestice su jezgra atoma helijuma). Helijum je mnogo češći u Univerzumu, na primjer na Suncu, gdje je prvi put otkriven (otuda i naziv: od grčkog hēlios - Sunce). Helijum se dobija iz prirodnih gasova. Koriste se u kriogenoj tehnologiji, za stvaranje inertnih medija, u aeronautici (za punjenje stratosferskih balona, balona itd.).
HELIJHELIJUM (lat. Helium), He (čitaj “helijum”), hemijski element sa atomskim brojem 2, atomska masa 4,002602. Pripada grupi inertnih, odnosno plemenitih gasova (grupa VIIIA periodnog sistema), koji se nalazi u 1. periodu.
Prirodni helijum se sastoji od dva stabilna nuklida: 3 He (0,00013% zapremine) i 4 He. Gotovo potpuna dominacija helijuma-4 povezana je sa stvaranjem jezgara ovog nuklida tokom radioaktivnog raspada uranijuma, torijuma, radijuma i drugih atoma koji se dogodio tokom duge istorije Zemlje.
Radijus neutralnog atoma helijuma je 0,122 nm. Elektronska konfiguracija neutralnog nepobuđenog atoma 1s 2
. Energije sekvencijalne ionizacije neutralnog atoma jednake su 24,587 odnosno 54,416 eV (atom helija ima najveću energiju apstrakcije prvog elektrona među neutralnim atomima svih elemenata).
Jednostavna supstanca helijum je lagani monoatomski gas bez boje, ukusa ili mirisa.
Istorija otkrića
Otkriće helijuma počelo je 1868. godine, kada su francuski astronomi P. J. Jansen posmatrali pomračenje Sunca. (cm. JANSIN Pierre Jules Cesar) i Engleza D. N. Lockyera (cm. LOCKYER Joseph Norman) nezavisno otkrivena u spektru solarne korone (cm. SOLARNA KORONA)žuta linija (tzv D 3 -line), što se nije moglo pripisati nijednom od tada poznatih elemenata. Godine 1871. Lockyer je objasnio njegovo porijeklo prisustvom novog elementa na Suncu. 1895. Englez W. Ramsay (cm. RAMSAY William) izolovao gas iz prirodne radioaktivne rude kleveit, u čijem spektru je isti D 3 linija. Lockyer je novom elementu dao ime koje odražava povijest njegovog otkrića (grčki Helios - sunce). Budući da je Lockyer vjerovao da je otkriveni element metal, upotrijebio je završetak "lim" u latinskom nazivu elementa (koja odgovara ruskom završetku "ii"), koji se obično koristi u nazivu metala. Dakle, mnogo prije svog otkrića na Zemlji, helij je dobio ime koje ga po završetku razlikuje od naziva drugih inertnih plinova.
Biti u prirodi
U atmosferskom vazduhu sadržaj helijuma je veoma mali i iznosi oko 5,27·10 -4% zapremine. U zemljinoj kori iznosi 0,8·10 -6%, u morskoj vodi - 4·10 -10%. Izvor helijuma je nafta i prirodni gasovi koji sadrže helijum, u kojima sadržaj helijuma dostiže 2-3%, au retkim slučajevima 8-10% zapremine. Ali u svemiru, helijum je drugi najzastupljeniji element (posle vodonika): čini 23% kosmičke mase.
Potvrda
Tehnologija proizvodnje helijuma je vrlo složena: izolovan je iz prirodnih gasova koji sadrže helijum metodom dubokog hlađenja. Nalazišta takvih gasova postoje u Rusiji, SAD, Kanadi i Južnoj Africi. Helij se također nalazi u nekim mineralima (monazit, torijanit i drugi), a zagrijavanjem se iz 1 kg minerala može osloboditi do 10 litara helijuma.
Fizička svojstva
Helijum je lagan, nezapaljiv gas, gustina gasa helijuma u normalnim uslovima je 0,178 kg/m 3 (samo je vodonik manji). Tačka ključanja helijuma (pri normalnom pritisku) je oko 4,2 K (ili –268,93 °C, ovo je najniža tačka ključanja).
Pri normalnom pritisku, tečni helijum se ne može pretvoriti u čvrsto stanje čak ni na temperaturama blizu apsolutne nule (0K). Pri pritisku od oko 3,76 MPa, tačka topljenja helijuma je 2,0 K. Najniži pritisak pri kojem se primećuje prelazak tekućeg helijuma u čvrsto stanje je 2,5 MPa (25 at), tačka topljenja helijuma je oko 1,1 K (–272,1 °C).
0,86 ml helijuma se rastvara u 100 ml vode na 20 °C, njegova rastvorljivost u organskim rastvaračima je još manja. Laki molekuli helija dobro prolaze (difuziju) kroz različite materijale (plastiku, staklo, neke metale).
Za tečni helijum-4, ohlađen ispod –270,97 °C, uočen je niz neobičnih efekata, što daje razlog da se ova tečnost smatra posebnom, takozvanom kvantnom tečnošću. Ova tečnost se obično naziva helijum-II, za razliku od tečnog helijuma-I, tečnosti koja postoji na nešto višim temperaturama. Grafikon promjene toplotnog kapaciteta tečnog helijuma sa temperaturom podseća na grčko slovo lambda (l). Temperatura prijelaza helijuma-I u helijum-II je 2,186 K. Ova temperatura se često naziva l-tačka.
Tečni helijum-II može brzo da prodre kroz sitne rupe i kapilare bez pokazivanja viskoznosti (tzv. superfluidnost (cm. SUPERFLUIDNOST) tečni helijum-II). Pored toga, helijum-II filmovi se brzo kreću po površini čvrstih materija, uzrokujući da tečnost brzo napusti posudu u koju je stavljena. Ovo svojstvo helijuma-II naziva se superpuzanje. Superfluidnost helijuma-II otkrio je 1938. sovjetski fizičar P. L. Kapitsa (cm. Kapitsa Petr Leonidovich)(Nobelova nagrada za fiziku, 1978.). Objašnjenje za jedinstvena svojstva helijuma-II dao je drugi sovjetski fizičar L. D. Landau (cm. LANDAU Lev Davidovich) 1941-1944 (Nobelova nagrada za fiziku, 1962).
Helijum ne stvara nikakva hemijska jedinjenja. Istina, u razrijeđenom ioniziranom heliju moguće je otkriti prilično stabilne dvoatomske He 2 + ione.
Aplikacija
Helijum se koristi za stvaranje inertne i zaštitne atmosfere pri zavarivanju, rezanju i topljenju metala, pri pumpanju raketnog goriva, za punjenje vazdušnih brodova i balona, kao komponenta okruženja helijum lasera. Tečni helijum, najhladnija tečnost na Zemlji, jedinstvena je rashladna tečnost u eksperimentalnoj fizici, koja omogućava korišćenje ultra niskih temperatura u naučnim istraživanjima (na primer, u proučavanju električne supravodljivosti (cm. SUPERVODLJIVOST)). Zbog činjenice da je helijum veoma slabo rastvorljiv u krvi, koristi se kao komponenta veštačkog vazduha kojim se ronioci snabdevaju za disanje. Zamjena dušika helijumom sprječava dekompresijsku bolest (cm. KAZONSKA BOLEST)(kada udišete običan vazduh, azot se pod visokim pritiskom rastvara u krvi i zatim se oslobađa iz nje u obliku mehurića koji začepljuju male sudove).
enciklopedijski rječnik. 2009 .
Sinonimi:Pogledajte šta je "helijum" u drugim rječnicima:
- (lat. Helijum) He, hemijski element VIII grupe periodnog sistema, atomski broj 2, atomska masa 4,002602, pripada plemenitim gasovima; bez boje i mirisa, gustina 0,178 g/l. Teže se ukapljuje od svih poznatih gasova (na 268,93.C);...... Veliki enciklopedijski rječnik
- (grčki, od helyos sunca). Elementarno tijelo otkriveno u sunčevom spektru i prisutno na Zemlji u nekim rijetkim mineralima; je uključen u vazduh u zanemarljivim količinama. Rječnik stranih riječi uključenih u ruski jezik. Čudinov A.N ... Rečnik stranih reči ruskog jezika
- (simbol He), gasoviti nemetalni element, PLEMENI GAS, otkriven 1868. Prvi put dobijen iz minerala klevita (vrsta uranita) 1895. Trenutno je njegov glavni izvor prirodni gas. Takođe sadržano u ... ... Naučno-tehnički enciklopedijski rečnik
Ja, muž. , stari Eliy, I.Otch.: Gelievich, Gelievna. Derivati: Gelya (Gela); Elya.Poreklo: (od grčkog hēlios sunce.)Imendan: 27. jul Rečnik ličnih imena. Helijum Vidi Ellium. Day Angel. Referenca... Rječnik ličnih imena
HELIJ- chem. element, simbol He (lat. Helium), at. n. 2, at. m 4.002, odnosi se na inertne (plemenite) gasove; bez boje i mirisa, gustine 0,178 kg/m3. U normalnim uslovima, gas je jednoatomski gas, čiji se atom sastoji od jezgra i dva elektrona; formira se... Velika politehnička enciklopedija
- (Helijum), He, hemijski element VIII grupe periodnog sistema, atomski broj 2, atomska masa 4,002602; odnosi se na plemenite plinove; supstanca najnižeg ključanja (t.k. 268,93°C), jedina koja se ne stvrdne pri normalnom pritisku;...... Moderna enciklopedija
Chem. element osmi gr. periodni sistem, redni broj 2; inertni gas sa at. V. 4.003. Sastoji se od dva stabilna izotopa He4 i He3. Soder. Oni nisu konstantni i zavise od izvora formiranja, ali teški izotop uvijek prevladava. U… … Geološka enciklopedija
Helijum- (Helijum), He, hemijski element VIII grupe periodnog sistema, atomski broj 2, atomska masa 4,002602; odnosi se na plemenite plinove; supstanca najnižeg ključanja (tačka ključanja 268,93°C), jedina koja se ne stvrdne pri normalnom pritisku;... ... Ilustrovani enciklopedijski rječnik
Sunny rječnik ruskih sinonima. helijum imenica, broj sinonima: 4 gas (55) naziv (1104) ... Rečnik sinonima
HELIJUM, ja, muž. Hemijski element, inertni plin, bez boje i mirisa, najlakši plin nakon vodonika. | adj. helijum, oh, oh. Ozhegov rečnik objašnjenja. S.I. Ozhegov, N.Yu. Shvedova. 1949 1992 … Ozhegov's Explantatory Dictionary
- (Helijum) gas je bez boje i mirisa, hemijski neaktivan, 7,2 puta lakši od vazduha, ne gori. Nalazi se u vrlo malim količinama u atmosferi (1/2000%). Zbog svoje lakoće i nezapaljivosti koristi se uglavnom za punjenje zračnih brodova... Marine Dictionary
Knjige
- Bijeli konj, Helij Rjabov, 384 strane. Kategorija: