Helyum metal olmayan bir maddedir. Helyum: özellikleri, özellikleri, uygulaması
Helyum gerçekten soylu bir gazdır. Onu herhangi bir tepkiye zorlamak henüz mümkün olmadı. Helyum molekülü tek atomludur.
Hafiflik açısından bu gaz hidrojenden sonra ikinci sıradadır; hava helyumdan 7,25 kat daha ağırdır.
Helyum su ve diğer sıvılarda neredeyse çözünmez. Ve aynı şekilde sıvı helyumda tek bir madde bile gözle görülür şekilde çözünmez.
Basınç artırılmadıkça hiçbir sıcaklıkta katı helyum elde edilemez.
Bu elementin keşfi, araştırılması ve uygulanmasının tarihinde farklı ülkelerden birçok önde gelen fizikçi ve kimyacının ismine rastlamak mümkündür. Helyumla ilgilendiler ve helyumla çalıştılar: Jansen (Fransa), Lockyer, Ramsay, Crookes, Rutherford (İngiltere), Palmieri (İtalya), Keesom, Kamerlingh-Onnes (Hollanda), Feynman, Onsager (ABD), Kapitza, Kikoin , Landau (Sovyetler Birliği) ve diğer birçok önde gelen bilim adamı.
Helyum atomunun benzersiz görünümü, kompaktlık ve güç açısından mutlak şampiyon olan iki muhteşem doğal yapının birleşimiyle belirlenir. Helyumun çekirdeğinde, helyum-4'ün her iki intranükleer kabuğu da doymuştur - hem proton hem de nötron. Bu çekirdeği çevreleyen elektronik ikili de doymuş durumdadır. Bu tasarımlar helyumun özelliklerini anlamanın anahtarını taşıyor. Olağanüstü kimyasal eylemsizliğinin ve atomunun rekor derecede küçük boyutunun kaynağı budur.
Helyum atomunun çekirdeğinin (alfa parçacığı) nükleer fiziğin oluşumu ve gelişimi tarihindeki rolü çok büyüktür. Hatırlarsanız, Rutherford'u atom çekirdeğini keşfetmeye yönlendiren alfa parçacığı saçılımı çalışmasıydı. Azotun alfa parçacıklarıyla bombardıman edilmesiyle, elementlerin birbirine dönüşümü ilk kez gerçekleştirildi; bu, birçok nesil simyacının yüzyıllardır hayalini kurduğu bir şeydi. Doğru, bu reaksiyonda altına dönüşen cıva değil, nitrojenin oksijene dönüşmesiydi, ancak bunu yapmak neredeyse aynı derecede zor. Nötronun keşfinde ve ilk yapay izotopun üretilmesinde de aynı alfa parçacıkları rol oynamıştı. Daha sonra alfa parçacıkları kullanılarak küryum, berkelyum, kaliforniyum ve mendelevyum sentezlendi.
Bu gerçekleri tek bir amaç için listeledik: 2 numaralı elementin çok sıra dışı bir element olduğunu göstermek.
Karasal helyum
Helyum sıra dışı bir elementtir ve tarihi de sıra dışıdır. Güneş atmosferinde Dünya'dan 13 yıl önce keşfedildi. Daha doğrusu, güneş koronasının spektrumunda parlak sarı bir D çizgisi keşfedildi ve arkasında neyin gizlendiği ancak radyoaktif elementler içeren dünyevi minerallerden helyumun çıkarılmasından sonra güvenilir bir şekilde biliniyordu.
Güneş'teki helyum, 19 Ağustos 1868'de Hindistan'da gözlemlerini yapan Fransız J. Jansen ve İngiliz J.H. Lockyer - Aynı yılın 20 Ekim'i. Her iki bilim insanının mektupları aynı gün Paris'e geldi ve Paris Bilimler Akademisi'nin 26 Ekim'deki toplantısında birkaç dakika arayla okundu. Böylesine tuhaf bir tesadüf karşısında hayrete düşen akademisyenler, bu etkinliğin şerefine altın madalya vermeye karar verdi.
1881'de İtalyan bilim adamı Palmieri, volkanik gazlarda helyumun keşfedildiğini bildirdi. Ancak daha sonra doğrulanan mesajı çok az bilim insanı tarafından ciddiye alındı. Karasal helyum 1895 yılında Ramsay tarafından yeniden keşfedildi.
Yer kabuğunda, radyoaktif bozunması alfa parçacıkları (helyum atomlarının son derece aktif, yüksek enerjili çekirdekleri) üreten 29 izotop vardır.
Temel olarak karasal helyum, uranyum-238, uranyum-235, toryumun ve bunların bozunmasının kararsız ürünlerinin radyoaktif bozunması sırasında oluşur. Samaryum-147 ve bizmutun yavaş yavaş bozunması sonucu kıyaslanamaz derecede daha küçük miktarlarda helyum üretilir. Tüm bu elementler yalnızca helyumun ağır izotopunu (4 He) üretir; bu izotopun atomları, bir elektron çiftinde iki eşleştirilmiş elektrondan oluşan bir kabukta gömülü alfa parçacıklarının kalıntıları olarak düşünülebilir. Erken jeolojik dönemlerde muhtemelen Dünya yüzeyinden kaybolan ve gezegeni helyumla doyuran başka doğal radyoaktif element dizileri de vardı. Bunlardan biri artık yapay olarak yeniden yaratılan neptunyum serisiydi.
Bir kayanın ya da mineralin içindeki helyum miktarına bakılarak onun mutlak yaşı belirlenebilir. Bu ölçümler radyoaktif bozunma yasalarına dayanmaktadır: örneğin uranyum-238'in yarısı 4,52 milyar yıl içinde helyuma ve kurşuna dönüşür.
Helyum yer kabuğunda yavaş yavaş birikir. 2 gram uranyum ve 10 gram toryum içeren bir ton granit, bir milyon yılda yalnızca 0,09 mg helyum, yani yarım santimetreküp üretiyor. Çok az sayıdaki uranyum ve toryum açısından zengin mineraller oldukça yüksek helyum içeriğine (gram başına birkaç santimetreküp helyum) sahiptir. Ancak bu minerallerin çok nadir bulunması nedeniyle doğal helyum üretimindeki payı sıfıra yakındır.
Alfa aktif izotoplar içeren doğal bileşikler yalnızca birincil kaynaktır ancak endüstriyel helyum üretimi için hammadde değildir. Doğru, yoğun yapıya sahip bazı mineraller - doğal metaller, manyetit, garnet, apatit, zirkon ve diğerleri - içlerinde bulunan helyumu sıkı bir şekilde tutar. Bununla birlikte, zamanla çoğu mineral hava koşulları, yeniden kristalleşme vb. işlemlere maruz kalır ve helyum onları terk eder.
Kristal yapılardan salınan helyum kabarcıkları yer kabuğu boyunca bir yolculuğa çıkar. Bunların çok küçük bir kısmı yeraltı suyunda çözünür. Az ya da çok konsantre helyum çözeltileri oluşturmak için, başta yüksek basınçlar olmak üzere özel koşullara ihtiyaç vardır. Gezici helyumun bir kısmı da minerallerin gözenekleri ve çatlaklarından atmosfere kaçar. Geriye kalan gaz molekülleri yer altı tuzaklarına düşer ve burada onlarca, hatta yüz milyonlarca yıl boyunca birikirler. Tuzaklar, boşlukları gazla dolu olan gevşek kaya katmanlarıdır. Bu tür gaz rezervuarlarının yatağı genellikle su ve yağdır ve üstleri gaz geçirmeyen yoğun kaya katmanlarıyla kaplıdır.
Diğer gazlar (başlıca metan, nitrojen, karbondioksit) de yer kabuğunda çok daha büyük miktarlarda dolaştığından saf helyum birikimleri oluşmaz. Helyum doğal gazlarda küçük bir yabancı madde olarak bulunur. İçeriği binde birini, yüzde birini ve nadiren yüzde onda birini geçmez. Metan-nitrojen yataklarının büyük (%1,5...10) helyum içeriği son derece nadir bir olgudur.
Doğal gazların, helyumun endüstriyel üretimi için pratik olarak tek hammadde kaynağı olduğu ortaya çıktı. Onu diğer gazlardan ayırmak için helyumun düşük sıvılaşma sıcaklığıyla bağlantılı olağanüstü uçuculuğu kullanılır. Doğal gazın diğer tüm bileşenleri derin soğutma sırasında yoğunlaştıktan sonra helyum gazı dışarı pompalanır. Daha sonra yabancı maddelerden arındırılır. Fabrika helyumunun saflığı %99,995'e ulaşır.
Dünyadaki helyum rezervlerinin 5.1014 m3 olduğu tahmin edilmektedir; Hesaplamalara bakılırsa, 2 milyar yıl içinde yer kabuğunda onlarca kat daha fazlası oluştu. Teori ile pratik arasındaki bu farklılık oldukça anlaşılırdır. Helyum hafif bir gazdır ve hidrojen gibi (daha yavaş da olsa) atmosferden uzaya kaçmaz. Muhtemelen, Dünya'nın varlığı sırasında, gezegenimizin helyumu defalarca yenilendi - eskisi uzaya buharlaştı ve onun yerine, Dünya tarafından "solunan" taze helyum atmosfere girdi.
Litosferde atmosferdekinden en az 200 bin kat daha fazla helyum vardır; Daha da fazla potansiyel helyum, Dünya'nın "rahminde" alfa aktif elementlerde depolanır. Ancak bu elementin Dünya ve atmosferdeki toplam içeriği azdır. Helyum nadir ve yaygın bir gazdır. 1 kg toprak maddesi başına yalnızca 0,003 mg helyum vardır ve havadaki içeriği hacimce yüzde 0,00052'dir. Bu kadar düşük bir konsantrasyon, helyumun havadan ekonomik olarak çıkarılmasına henüz izin vermiyor.
Evrendeki Helyum
Gezegenimizin içi ve atmosferi helyum açısından fakirdir. Ancak bu, Evrenin her yerinde ondan çok az olduğu anlamına gelmez. Modern tahminlere göre kozmik kütlenin %76'sı hidrojen ve %23'ü helyumdur; diğer tüm elementler için sadece %1 kaldı! Dolayısıyla dünyanın maddesine hidrojen-helyum denilebilir. Bu iki element yıldızlara, gezegenimsi bulutsulara ve yıldızlararası gaza hakimdir.
Pirinç. 1. Dünyadaki (üstte) ve uzaydaki element bolluğu eğrileri.
“Kozmik” eğri, hidrojen ve helyumun evrendeki olağanüstü rolünü ve helyum grubunun atom çekirdeğinin yapısındaki özel önemini yansıtıyor. En büyük göreceli bolluk, kütle sayısı dörde bölünen elementler ve izotoplardır: 16 O, 20 Ne, 24 Mg, vb.
Muhtemelen, güneş sisteminin tüm gezegenleri radyojenik (alfa bozunması sırasında oluşan) helyum içerir ve büyük olanlar da uzaydan gelen kalıntı helyum içerir. Helyum, Jüpiter'in atmosferinde bol miktarda bulunur: bazı verilere göre bu oran %33, bazılarına göre ise %17'dir. Bu keşif, ünlü bilim adamı ve bilim kurgu yazarı A. Azimov'un hikayelerinden birinin olay örgüsünün temelini oluşturdu. Hikayenin merkezinde, helyumun Jüpiter'den teslimi ve hatta kriyotronlar üzerindeki sibernetik makinelerden oluşan bir armadanın bu gezegenin en yakın uydusu olan Jüpiter V'e teslim edilmesi için (muhtemelen gelecekte mümkün) bir plan var (onlar hakkında daha fazla bilgi) altında). Jüpiter'in atmosferindeki sıvı helyuma batırılan (aşırı düşük sıcaklıklar ve süper iletkenlik, kriyotronların çalışması için gerekli koşullardır) bu makineler, Jüpiter V'i güneş sisteminin beyin merkezine dönüştürecek...
Yıldız helyumunun kökeni 1938'de Alman fizikçiler Bethe ve Weizsäcker tarafından açıklandı. Daha sonra teorileri parçacık hızlandırıcıların yardımıyla deneysel olarak doğrulandı ve geliştirildi. Özü aşağıdaki gibidir.
Helyum çekirdekleri, her kilogram helyum için 175 milyon kilovatsaat enerji açığa çıkaran füzyon süreçlerinde protonlardan yıldız sıcaklıklarında birleştirilir.
Farklı reaksiyon döngüleri helyum sentezine yol açabilir.
Güneşimiz gibi çok sıcak olmayan yıldızların koşullarında proton-proton döngüsü görünüşe göre baskındır. Art arda değişen üç dönüşümden oluşur. İlk olarak, iki proton muazzam hızlarda birleşerek bir döteron oluşturur; bu, bir proton ve bir nötrondan oluşan bir yapıdır; bu durumda pozitron ve nötrino ayrılır. Daha sonra döteron ve proton birleşerek hafif helyum oluşturur ve bir gama kuantumu yayılır. Son olarak iki adet 3 He çekirdeği reaksiyona girerek bir alfa parçacığına ve iki protona dönüşür. İki elektron alan bir alfa parçacığı daha sonra bir helyum atomuna dönüşecektir.
Aynı nihai sonuç, daha hızlı bir karbon-nitrojen döngüsü tarafından da verilmektedir; bunun güneş koşulları altında önemi çok büyük değildir, ancak Güneş'ten daha sıcak yıldızlarda bu döngünün rolü artar. Altı adımdan oluşur - reaksiyonlar. Karbon burada proton füzyonu süreci için katalizör rolünü oynuyor. Bu dönüşümler sırasında açığa çıkan enerji, proton-proton döngüsü sırasındaki enerjiyle aynıdır; helyum atomu başına 26,7 MeV.
Helyum sentezi reaksiyonu, yıldızların enerjik aktivitesinin ve parıltısının temelidir. Sonuç olarak, helyumun sentezi doğadaki tüm reaksiyonların atası, Dünya'daki yaşamın, ışığın, ısının ve meteorolojik olayların temel nedeni olarak düşünülebilir.
Helyum her zaman yıldız füzyonlarının son ürünü değildir. Profesör D.A.'nın teorisine göre. Frank-Kamenetsky, helyum çekirdeklerinin sıralı füzyonu ile 3 Be, 12 C, 16 O, 20 Ne, 24 Mg oluşur ve protonların bu çekirdekler tarafından yakalanması diğer çekirdeklerin oluşumuna yol açar. Ağır elementlerin çekirdeklerinin uranyum ötesi elementlere kadar sentezi, kararsız "nova" ve "süpernova" yıldızlarda gelişen olağanüstü ultra yüksek sıcaklıklar gerektirir.
Ünlü Sovyet kimyacısı A.F. Kapustinsky, hidrojen ve helyumu önelementler olarak adlandırdı - birincil maddenin unsurları. Hidrojen ve helyumun elementlerin periyodik tablosundaki özel konumuna ilişkin açıklamayı, özellikle de ilk periyodun esasen diğer periyotların periyodiklik karakteristiğinden yoksun olduğu gerçeğini gizleyen bu öncelik değil mi?
En iyisi...
Helyum atomu (diğer adıyla molekül) moleküler yapıların en güçlüsüdür. İki elektronunun yörüngeleri tamamen aynıdır ve çekirdeğin çok yakınından geçer. Helyum çekirdeğini ortaya çıkarmak için rekor miktarda enerji harcamak gerekir - 78,61 MeV. Helyumun olağanüstü kimyasal pasifliği buradan gelir.
Geçtiğimiz 15 yılda kimyagerler ağır soy gazların 150'den fazla kimyasal bileşiğini elde etmeyi başardılar (ağır soy gazların bileşikleri “Kripton” ve “Ksenon” makalelerinde tartışılacaktır). Ancak helyumun eylemsizliği daha önce olduğu gibi şüphe götürmez.
Hesaplamalar, örneğin helyum florür veya oksit üretmenin bir yolu bulunsa bile, oluşum sırasında o kadar çok enerji emeceklerini ve sonuçta ortaya çıkan moleküllerin bu enerji tarafından içeriden "patlatılacağını" gösteriyor.
Helyum molekülleri polar değildir. Aralarındaki moleküller arası etkileşimin kuvvetleri son derece küçüktür - diğer maddelerden daha azdır. Dolayısıyla - kritik değerlerin en düşük değerleri, en düşük kaynama noktası, en düşük buharlaşma ve erime ısısı. Helyumun erime sıcaklığına gelince, normal basınçta hiç mevcut değildir. Mutlak sıfıra ne kadar yakın olursa olsun, sıvı helyum, sıcaklığa ek olarak 25 atmosfer veya daha fazla basınca maruz kalmadıkça katılaşmaz. Doğada buna benzer başka bir madde yoktur.
Ayrıca sıvılarda, özellikle de polar olanlarda bu kadar ihmal edilebilir derecede çözünebilen ve helyum kadar adsorpsiyona bu kadar az eğilimli başka bir gaz yoktur. Gazlar arasında elektriği en iyi ileten, ısıyı ise hidrojenden sonra en iyi ileten ikinci maddedir. Isı kapasitesi çok yüksek olup viskozitesi düşüktür.
Helyum, bazı organik polimerler, porselen, kuvars ve borosilikat camdan yapılmış ince bölmelerden şaşırtıcı derecede hızlı bir şekilde nüfuz eder. Helyumun yumuşak camdan borosilikat camdan 100 kat daha yavaş geçmesi ilginçtir. Helyum ayrıca birçok metale de nüfuz edebilir. Yalnızca demir ve platin grubu metaller ısıtılsa bile tamamen geçilmezdir.
Doğal gazdan saf helyumun çıkarılmasına yönelik yeni bir yöntem, seçici geçirgenlik ilkesine dayanmaktadır.
Bilim insanları sıvı helyuma olağanüstü ilgi gösteriyor. Birincisi, içinde tek bir maddenin gözle görülür şekilde çözünmediği en soğuk sıvıdır. İkincisi, minimum yüzey gerilimine sahip en hafif sıvıdır.
2.172°K sıcaklıkta sıvı helyumun özelliklerinde ani bir değişiklik meydana gelir. Ortaya çıkan türe geleneksel olarak helyum II adı verilir. Helyum II diğer sıvılardan tamamen farklı şekilde kaynar; kaynarken kaynamaz, yüzeyi tamamen sakin kalır. Helyum II, ısıyı normal sıvı helyumdan (helyum I) 300 milyon kat daha iyi iletir. Helyum II'nin viskozitesi pratik olarak sıfırdır, sıvı hidrojenin viskozitesinden bin kat daha azdır. Bu nedenle, helyum II süper akışkanlığa sahiptir - keyfi olarak küçük çaplı kılcal damarlar boyunca sürtünme olmadan akma yeteneği.
Helyumun bir başka kararlı izotopu olan 3 He, mutlak kurşundan yalnızca yüzde biri derece uzaktaki bir sıcaklıkta süper akışkan duruma geçer. Süperakışkan helyum-4 ve helyum-3'e kuantum sıvıları denir: katılaşmadan önce bile kuantum mekaniksel etkiler gösterirler. Bu, sıvı helyumun çok ayrıntılı çalışmasını açıklıyor. Ve şimdi çok fazla üretiyorlar; yılda yüzbinlerce litre. Ancak katı helyum pek incelenmemiştir: Bu en soğuk cismi incelemenin deneysel zorlukları büyüktür. Kuşkusuz bu boşluk doldurulacaktır, çünkü fizikçiler katı helyumun özelliklerinin anlaşılmasından pek çok yeni şey beklemektedir: Sonuçta o aynı zamanda bir kuantum cisimdir.
Hareketsiz ama çok gerekli
Geçen yüzyılın sonunda, İngiliz dergisi Punch, helyumun sinsice göz kırpan küçük bir adam - Güneş'in sakini - olarak tasvir edildiği bir karikatür yayınladı. Fotoğrafın altındaki yazı şöyle: “Sonunda Dünya'da yakalandım! Bu yeterince uzun sürdü! Acaba benimle ne yapacaklarını bulmaları ne kadar zaman alacak?”
Aslında, karasal helyumun keşfedilmesinden bu yana (bununla ilgili ilk rapor 1881'de yayınlandı) pratik kullanım alanı bulana kadar 34 yıl geçti. Helyumun uzun bir çalışma gerektiren orijinal fiziksel, teknik, elektriksel ve daha az ölçüde kimyasal özellikleri burada belirli bir rol oynadı. Ana engeller, dalgınlık ve 2 numaralı unsurun yüksek maliyetiydi.
Helyumu ilk kullananlar Almanlardı. 1915'te Londra'yı bombalayan hava gemilerini bununla doldurmaya başladılar. Kısa sürede hafif fakat yanıcı olmayan helyum, havacılık araçları için vazgeçilmez bir dolgu maddesi haline geldi. Zeplin yapımında 30'lu yılların ortalarında başlayan düşüş, helyum üretiminde bir miktar düşüşe yol açtı, ancak bu yalnızca kısa bir süre için. Bu gaz giderek kimyagerlerin, metalurjistlerin ve makine mühendislerinin ilgisini çekti.
Birçok teknolojik işlem ve operasyon havada gerçekleştirilemez. Ortaya çıkan maddenin (veya besleme stoğunun) hava gazlarıyla etkileşimini önlemek için özel koruyucu ortamlar oluşturulur; ve bu amaçlar için helyumdan daha uygun bir gaz yoktur.
Atıl, hafif, hareketli ve iyi bir ısı iletkeni olan helyum, oldukça yanıcı sıvıları ve tozları bir kaptan diğerine basmak için ideal bir araçtır; Füzelerde ve güdümlü füzelerde gerçekleştirdiği bu işlevlerdir. Nükleer yakıt üretmenin bireysel aşamaları helyum koruyucu bir ortamda gerçekleşir. Nükleer reaktörlerin yakıt elemanları helyumla dolu kaplarda depolanır ve taşınır.
Eylemi helyumun olağanüstü difüzyon kabiliyetine dayanan özel sızıntı dedektörleri yardımıyla, nükleer reaktörlerde ve diğer sistemlerde basınç veya vakum altında en ufak sızıntı olasılığını tespit ederler.
Son yıllarda zeplin inşasında artık daha yüksek bir bilimsel ve teknik temele dayanan yeni bir yükseliş yaşandı. Birçok ülkede 100 ila 3000 ton taşıma kapasiteli helyum dolumlu hava gemileri inşa edilmiş ve inşa edilmektedir. Gaz boru hatları, petrol rafinerileri, enerji gibi büyük boyutlu kargoların taşınması için ekonomik, güvenilir ve kullanışlıdırlar. hat destekleri vb. %85 helyum ve %15 hidrojen dolgusu yanmazdır ve hidrojen dolgusuna kıyasla kaldırma kuvvetini yalnızca %7 azaltır.
Helyumun soğutucu görevi gördüğü yeni tip yüksek sıcaklık nükleer reaktörleri faaliyete geçti.
Sıvı helyum bilimsel araştırma ve teknolojide yaygın olarak kullanılmaktadır. Ultra düşük sıcaklıklar, madde ve yapısı hakkında derinlemesine bilgi edinilmesini sağlar; daha yüksek sıcaklıklarda, enerji spektrumunun ince ayrıntıları atomların termal hareketi tarafından maskelenir.
Sıvı helyum sıcaklıklarında (300 bin oersted'e kadar) ihmal edilebilir enerji tüketimiyle güçlü manyetik alanlar oluşturan özel alaşımlardan yapılmış süper iletken solenoidler halihazırda mevcuttur.
Sıvı helyumun sıcaklığında birçok metal ve alaşım süper iletken hale gelir. Süper iletken röleler - kriyotronlar - elektronik bilgisayarların tasarımlarında giderek daha fazla kullanılmaktadır. Basit, güvenilir ve çok kompakttırlar. Süper iletkenler ve onlarla birlikte sıvı helyum elektronik için gerekli hale geliyor. Kızılötesi radyasyon dedektörlerinin, moleküler amplifikatörlerin (maserler), optik kuantum jeneratörlerinin (lazerler) ve ultra yüksek frekansları ölçen cihazların tasarımlarına dahil edilirler.
Elbette bu örnekler helyumun modern teknolojideki rolünü tam olarak kapsamıyor. Ancak doğal kaynakların sınırlı olması ve helyumun aşırı derecede yayılması olmasaydı, çok daha fazla uygulama alanı bulabilirdi. Örneğin gıda ürünlerinin helyumda konservelendiğinde orijinal tat ve aromasını koruduğu bilinmektedir. Ancak "helyum" konservesi hala "kendi başına bir şey" olarak kalıyor çünkü helyum yeterli değil ve yalnızca en önemli endüstrilerde kullanılıyor ve onsuz yapılamayacağı yerlerde kullanılıyor. Bu nedenle, yanıcı doğal gazla, helyum taşıyan kaynaklardan çıkarılanlara göre çok daha büyük miktarlarda helyumun kimyasal sentez aparatlarından, fırınlardan ve fırınlardan geçerek atmosfere kaçtığını anlamak özellikle rahatsız edicidir.
Artık helyumun yalnızca doğal gaz içeriğinin% 0,05'ten az olmadığı durumlarda salınması karlı kabul ediliyor. Bu tür gazların rezervleri sürekli azalıyor ve bu yüzyılın sonundan önce tükenmeleri mümkün. Bununla birlikte, "helyum eksikliği" sorunu muhtemelen bu zamana kadar çözülecektir - kısmen gazları ayırmak için yeni, daha gelişmiş yöntemlerin oluşturulması, onlardan önemsiz fraksiyonlar da olsa en değerli olanların çıkarılması ve kısmen kontrollü termonükleer füzyon sayesinde. Helyum, her ne kadar “yapay güneşler” faaliyetinin bir yan ürünü olsa da, önemli bir hale gelecektir.
Helyum izotopları
Doğada helyumun iki kararlı izotopu vardır: helyum-3 ve helyum-4. Hafif izotop, Dünya'da ağır izotoptan milyon kat daha az dağılmıştır. Bu, gezegenimizde bulunan en nadir kararlı izotoptur. Yapay olarak helyumun üç izotopu daha elde edildi. Hepsi radyoaktiftir. Helyum-5'in yarı ömrü 2,4·10 –21 saniye, helyum-6 0,83 saniye, helyum-8 0,18 saniyedir. Çekirdeğinde proton başına üç nötron bulunması nedeniyle ilginç olan en ağır izotop, ilk olarak 60'lı yıllarda Dubna'da incelendi. Helyum-10 elde etme girişimleri şu ana kadar başarısız oldu.
Son katı gaz
Helyum, sıvı ve katı hallere dönüştürülen tüm gazların sonuncusuydu. Helyumun sıvılaştırılması ve katılaştırılmasının belirli zorlukları, atomunun yapısı ve fiziksel özelliklerinin bazı özellikleri ile açıklanmaktadır. Özellikle helyum, tıpkı hidrojen gibi, -250°C'nin üzerindeki sıcaklıklarda genleştiğinde soğumaz, aksine ısınır. Öte yandan helyumun kritik sıcaklığı oldukça düşüktür. Bu nedenle sıvı helyum ilk kez 1908'de, katı helyum ise 1926'da elde edildi.
Helyum havası
Azotun tamamının veya çoğunun helyumla değiştirildiği hava bugün artık haber değil. Karada, yer altında ve su altında yaygın olarak kullanılmaktadır.
Helyumlu hava sıradan havaya göre üç kat daha hafif ve çok daha hareketlidir. Akciğerlerde daha aktif davranır; hızla oksijen sağlar ve karbondioksiti hızla dışarı atar. Bu nedenle solunum bozukluğu olan hastalara ve bazı operasyonlara helyum havası verilmektedir. Boğulmayı hafifletir, bronşiyal astımı ve gırtlak hastalıklarını tedavi eder.
Helyum havasını solumak, yüksek basınç koşullarında çalışan dalgıçların ve diğer mesleklerden uzmanların yüksek basınçtan normale geçiş sırasında duyarlı olduğu nitrojen embolisini (keson hastalığı) pratik olarak ortadan kaldırır. Bu hastalığın nedeni özellikle yüksek tansiyonda nitrojenin kandaki çözünürlüğü oldukça önemlidir. Basınç azaldıkça gaz kabarcıkları şeklinde salınır, bu da kan damarlarını tıkayabilir, sinir düğümlerine zarar verebilir... Helyum, nitrojenden farklı olarak vücut sıvılarında pratik olarak çözünmez, bu nedenle dekompresyon hastalığına neden olamaz. Ayrıca helyum havası, dışarıdan alkol zehirlenmesine benzeyen "nitrojen narkozu" oluşumunu da ortadan kaldırır.
Er ya da geç insanlık, rafın maden ve gıda kaynaklarından ciddi şekilde yararlanmak için deniz yatağında uzun süre yaşamayı ve çalışmayı öğrenmek zorunda kalacak. Ve Sovyet, Fransız ve Amerikalı araştırmacıların deneylerinin gösterdiği gibi, büyük derinliklerde helyum havası hala vazgeçilmezdir. Biyologlar, helyum havasının uzun süre solunmasının insan vücudunda olumsuz değişikliklere neden olmadığını ve genetik aparattaki değişiklikleri tehdit etmediğini kanıtladı: helyum atmosferi hücrelerin gelişimini ve mutasyon sıklığını etkilemez. Yazarlarının helyum havasını Evren'e uzun uçuşlar yapan uzay araçları için en uygun hava ortamı olarak değerlendirdiği çalışmalar var. Ancak şimdiye kadar yapay helyum havası henüz Dünya atmosferinin ötesine yükselmedi.
Var üç ana gelir kaynağı helyum:
- helyum içeren doğal gazlardan
- minerallerden
- hiç yoktan
Doğal gazdan helyum üretimi
Helyum üretmenin ana yöntemi, doğal helyum içeren gazlardan fraksiyonel yoğunlaşma yöntemidir, yani. derin soğutma yöntemi. Ayrıca karakteristik özelliği de kullanılır - bilinen maddelerle karşılaştırıldığında en düşük kaynama noktası. Bu, başta metan ve nitrojen olmak üzere helyuma eşlik eden tüm gazların yoğunlaşmasını mümkün kılar. İşlem genellikle iki aşamada gerçekleştirilir:
- sözde ham helyum salınımı (%70-90 He içeren konsantre)
- teknik olarak saf helyum elde etmek için saflaştırma.
Aşağıdaki şekil doğal gazdan helyumun çıkarılmasına yönelik kurulum şemalarından birini göstermektedir.
Gaz 25 atmosfere kadar sıkıştırılır ve bu basınç altında tesisata girer. (CO2) temizliği ve gazın kısmi kurutulması, %10-20 monoetanolamin, %70-80 dietilen glikol ve %5-10 su içeren bir çözelti ile sulanan yıkayıcılarda gerçekleştirilir. Yıkayıcılardan sonra gazda %0,003-0,008 karbondioksit CO2 kalır ve çiğ noktası 5°C'yi aşmaz. Daha fazla kurutma, -45°C'lik bir çiğlenme noktası sıcaklığına ulaşılan silika jelli adsorberlerde gerçekleştirilir.
Yaklaşık 20 atmosferlik bir basınç altında, temiz kuru gaz ön ısı eşanjörüne (1) girer ve burada ters gaz akışlarıyla -28°C'ye soğutulur. Bu durumda, ayırıcıda (2) ayrılan ağır hidrokarbonların yoğuşması meydana gelir. Amonyak soğutucusunda (3), gaz -45°C'ye soğutulur, yoğuşma suyu ayırıcıda (4) ayrılır. Ana ısı değiştiricide (5), gaz sıcaklık -110°C'ye düşürülür, bunun sonucunda gazın önemli bir kısmı yoğunlaşmış metan olur Buhar-sıvı karışımı (sıvının yaklaşık %20'si), çıkışında buhar-gaz karışımının helyum ile %3'e kadar zenginleştirildiği birinci karşı akışlı kondansatörde (6) 12 atmosferlik bir basınca kısılır. Tüplerde oluşan yoğuşma, içinde çözünen helyumun buhar-gaz akışını birleştiren sıvıdan uzaklaştırıldığı plakalar üzerinde sıyırma bölümüne akar.
Sıvı, soğutucu olarak görev yaptığı yoğunlaştırıcının halkasına 1,5 atmosfere kısılır. Burada oluşan buhar, ısı eşanjörleri (5 ve 1) aracılığıyla uzaklaştırılır. Kondansatörden (6) ayrılan ve% 3'e kadar He içeren buhar-gaz karışımı, 12 atmosfer basınç altında, iki parçadan oluşan ikinci karşı akışlı kondansatöre (7) gider. : alt kısımda, tüplerin içinde 12 ila 1,5 atmosfer arasında kısılan alt sıvının buharlaştığı bir bobin ısı eşanjörü vardır ve üst kısımda, tüpler arası düz borulu bir ısı eşanjörü vardır. nitrojenin -203°C sıcaklıkta ve 0,4 atmosfer basınçta kaynadığı alan. Gaz karışımının bileşenlerinin aparatın (7) alt kısmında yoğunlaşması sonucunda gaz, %30-50'ye kadar ve üst kısımda %90-92'ye kadar helyumla zenginleştirilir.
Bu bileşimin ham helyumu 11-12 atmosfer basınç altında ısı eşanjörlerine girer, burada ısıtılır ve tesisten çıkarılır. Doğal gaz küçük hidrojen safsızlıkları içerdiğinden ham helyumdaki hidrojen konsantrasyonu %4-5'e çıkar. Hidrojen, katalitik hidrojenasyonla çıkarılır, ardından silika jelli adsorberlerde gaz kurutulur. Ham helyum, bir membranlı kompresör (8) tarafından 150-200 atmosfere sıkıştırılır, bir ısı eşanjöründe (9) soğutulur ve nitrojenin vakum altında kaynatılmasıyla soğutulan doğrudan akışlı bobin kondansatörüne (10) beslenir. Yoğuşma suyu (sıvı) ayırıcıda (11) toplanır ve periyodik olarak uzaklaştırılır ve yaklaşık %98 içeren yoğunlaşmamış gaz, sıvı nitrojenle soğutulmuş aktif karbonlu adsorbere (12) gider. Adsorberden çıkan helyum %0,05'ten daha az safsızlıklar içerir ve ürün olarak silindirlere (13) girer.
ABD'deki doğal gazlar özellikle helyum açısından zengindir ve bu da bu ülkede helyumun yaygın kullanımını belirlemektedir.
Minerallerden helyum elde edilmesi
Helyumun başka bir kaynağı da bazı radyoaktif mineraller uranyum, toryum ve samaryum içeren:
- iftira
- fergusonit
- Samarskit
- gadolinit
- monazit
- torianit
Özellikle monazit kumları büyük bir kısmı Travancore'da (Hindistan) bulunan: bu yatağın monazitleri, 1 g cevher başına yaklaşık 1 cm3 helyum içerir.
Bir monositten helyum elde etmek için monositin kapalı bir kapta 1000°C'ye ısıtılması gerekir. Helyum, karbondioksit (CO2) ile birlikte salınır ve daha sonra bir sodyum hidroksit (NaOH) çözeltisi tarafından emilir. Artık gaz %96,6 He içerir. Daha fazla saflaştırma, nitrojeni uzaklaştırmak için magnezyum metali üzerinde 600°C'de ve daha sonra kalan safsızlıkları uzaklaştırmak için kalsiyum metali üzerinde 580°C'de gerçekleştirilir. Üretim gazı %99,5'in üzerinde He içerir. 1000 ton monazit kumundan yaklaşık 80 m3 saf helyum elde edilebilir. Çok helyum üretme yönteminin teknik veya endüstriyel önemi yoktur..
Helyumun havadan alınması
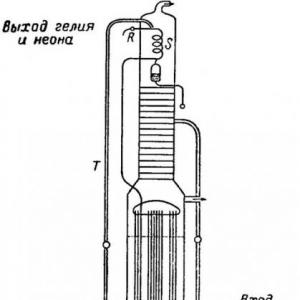
Helyum havada az miktarda bulunur"" makalesinde açıklanan havadan oksijen ve nitrojen üretiminde yan ürün olarak elde edilebildiği. Havayı sıvı nitrojenin üzerinden ayırmak için endüstriyel damıtma kolonlarında, kalan gaz halindeki neon ve helyum karışımı toplanır. Aşağıdaki resimde gösterilmektedir Claude'un aparatı böyle bir karışımı ayırmak için özel olarak uyarlanmıştır.

Cihazdan D vanasından çıkan gaz, kalan nitrojeni yoğunlaştırmak için T'den sıvı nitrojenle dökülen bobin S'de soğutulur. R vanası hafifçe açılırsa çok az nitrojen içeren bir karışım elde edilir. Helyumun endüstriyel üretiminin bu yöntemiyle, büyük miktarda havayı işleme zorunluluğunun zorluğuna ek olarak, ek bir zorluk daha vardır: ihtiyaç helyumun neondan ayrılması. Bu ayırma, neonun katılaştırıldığı sıvı hidrojen kullanılarak veya neonun sıvı nitrojenle soğutulmuş aktif karbon üzerine adsorbe edilmesiyle gerçekleştirilebilir.
Havadan helyum elde etmek pratik değildir küçük miktarı nedeniyle - hacim olarak %0,00046 veya ağırlık olarak %0,00007. Hesaplamalar, havadan çıkarılan bir metreküp helyumun maliyetinin, doğal gazlardan çıkarılmasından binlerce kat daha yüksek olacağını gösteriyor. Elbette bu kadar yüksek bir maliyet, helyumun havadan endüstriyel olarak ayrıştırılması olasılığını dışlıyor.
Örneğin: 1 metreküp helyum çıkarmak için 116 ton nitrojenin açığa çıkması gerekir.
Helyum kimyasal elementi ilk olarak Güneş'te ve ancak daha sonra Dünya'da keşfedildi.
Helyumun keşfi tarihinde önemli bir rol, dünyanın önde gelen bilimsel yayınlarından biri olan derginin kurucusu Norman Lockyer tarafından oynandı. Doğa. Derginin yayımına hazırlanırken Londra bilim kurumuyla tanıştı ve astronomiyle ilgilenmeye başladı. Bu, Kirchhoff-Bunsen keşfinden ilham alan gökbilimcilerin yıldızların yaydığı ışık spektrumunu henüz incelemeye başladıkları bir dönemdi. Lockyer'in kendisi bir takım önemli keşifler yapmayı başardı; özellikle, güneş lekelerinin güneş yüzeyinin geri kalanından daha soğuk olduğunu gösteren ilk kişi oydu ve aynı zamanda Güneş'in bir dış kabuğa sahip olduğunu belirten ilk kişi oldu. BT renk küre. 1868'de, çıkıntılardaki atomların yaydığı ışığı (Güneş'in yüzeyinden büyük plazma püskürmeleri) incelerken Lockyer, daha önce bilinmeyen bir dizi tayf çizgisini fark etti ( santimetre. Spektroskopi). Aynı çizgileri laboratuvarda elde etme girişimleri başarısızlıkla sonuçlandı ve Lockyer, yeni bir kimyasal element keşfettiği sonucuna vardı. Lockyer buna Yunancadan helyum adını verdi. Helios- "Güneş".
Bilim insanları helyumun ortaya çıkışına nasıl tepki verecekleri konusunda şaşkına dönmüştü. Bazıları, çıkıntıların tayflarının yorumlanmasında bir hata yapıldığını öne sürdü, ancak giderek daha fazla gökbilimci Lockyer çizgilerini gözlemleyebildikçe bu bakış açısının giderek daha az destekçisi oldu. Diğerleri ise Güneş'te Dünya'da olmayan elementlerin bulunduğunu savundu; bu da, daha önce de belirtildiği gibi, doğa yasalarıyla ilgili temel noktayla çelişiyor. Yine de diğerleri (bir azınlık vardı) bir gün Dünya'da helyumun bulunacağına inanıyordu.
1890'ların sonlarında Lord Rayleigh ve Sir William Ramsay, argonun keşfine yol açan bir dizi deney gerçekleştirdiler. Ramsay, kurulumunu uranyum içeren minerallerden salınan gazları incelemek için kullanacak şekilde değiştirdi. Ramsay, bu gazların spektrumunda bilinmeyen çizgiler keşfetti ve analiz için birkaç meslektaşına örnekler gönderdi. Örneği aldıktan sonra Lockyer, çeyrek asırdan fazla bir süre önce güneş ışığında gözlemlediği çizgileri hemen tanıdı. Helyumun gizemi çözüldü: Gaz şüphesiz Güneş'te bulunuyor ama aynı zamanda burada, Dünya'da da mevcut. Günümüzde bu gaz, günlük yaşamda en çok hava gemilerini ve balonları şişirmek için kullanılan bir gaz olarak bilinmektedir ( santimetre. Graham Yasası) ve bilimde - uygulanması sayesinde kriyojenik, ultra düşük sıcaklıklara ulaşma teknolojileri.
Koronyum ve nebulyum
Evrenin herhangi bir yerinde Dünya'da bulunmayan kimyasal elementlerin olup olmadığı sorusu 20. yüzyılda da geçerliliğini kaybetmedi. Dış güneş atmosferini incelerken - güneş kronlar Gökbilimciler, sıcak, yüksek oranda seyreltilmiş plazmadan oluşan, bilinen karasal elementlerin hiçbiriyle tanımlayamadıkları spektral çizgiler keşfettiler. Bilim insanları bu çizgilerin yeni bir elemente ait olduğunu ileri sürdü. koronyum. Ve bazılarının spektrumlarını incelerken Bulutsular- Galaksideki uzak gaz ve toz birikimleri - başka bir gizemli çizgi daha keşfedildi. Başka bir "yeni" unsura atfedildiler - bulutsu. 1930'lu yıllarda Amerikalı astrofizikçi Ira Sprague Bowen (1898-1973), nebulyum çizgilerinin aslında oksijene ait olduğu ancak bu görünümü Güneş'te ve nebulalarda var olan ekstrem koşullar nedeniyle kazandığı ve bu koşulların yeniden üretilemeyeceği sonucuna varmıştır. dünyevi laboratuvarlarda. Koronyumun oldukça iyonize demir olduğu ortaya çıktı. Ve bu satırlar adını aldı yasaklı çizgiler.
Joseph Norman LOKYER
Joseph Norman Lockyer, 1836-1920
İngiliz bilim adamı. Rugby kasabasında bir askeri doktorun ailesinde doğdu. Lockyer bilime alışılmadık bir şekilde geldi ve kariyerine Savaş Departmanında memur olarak başladı. Fazladan para kazanmak için halkın bilime olan ilgisinden yararlandı ve popüler bir bilim dergisi yayınlamaya başladı. Derginin ilk sayısı 1869'da yayımlandı. Doğa ve 50 yıl boyunca Lockyer onun editörü olarak kaldı. Tam güneş tutulmalarını gözlemleyen birçok geziye katıldı. Bu keşif gezilerinden biri onu helyumun keşfine götürdü. Lockyer aynı zamanda Stonehenge gibi antik yapıların astronomik anlamını inceleyen arkeoastronomi biliminin kurucusu ve birçok popüler bilim kitabının yazarı olarak da biliniyor.
Sıvı
Helyum Mendeleev'in periyodik element tablosunda ikinci atom numarasına girer. Bu, inert gaz grubunun ana unsurlarından biridir. Helyum, Latin harfleri “He” ile gösterilir ve atom numarası ikidir. Bu gaz kokusuz, renksiz ve tatsızdır.
Helyum gazı evrende en çok bulunan elementlerden biridir ve miktar olarak hidrojenin hemen arkasındadır. Helyum aynı zamanda en hafif elementlerden biridir. Helyum elde etmek için fraksiyonel damıtma yöntemi (düşük sıcaklıkta ayırma işlemi) kullanılır.
Helyumun keşfi
1868 yılında Guntur şehrinde meydana gelen güneş tutulması sırasında Fransız bilim adamı Pierre Jansen, bir spektroskop kullanarak Güneş'in kromosferini incelemeyi başardı. Güneş'in çıkıntılarının yalnızca hidrojeni değil aynı zamanda başka elementleri de içerdiğini tespit edebildi. O zamanlar yeni elementin sodyum D olduğu kabul ediliyordu. Ancak Pierre Jansen, Fransız Bilimler Akademisi'ne yeni bir elementin keşfine ilişkin teorisini özetlediği bir mektup yazdı.
Birkaç ay sonra, İngiltere'den bir gökbilimci olan Norman Lockyer kendi araştırmasını yürüttü ve ayrıca bir spektroskop kullanarak, bilinmeyen bir elementin spektrumunda 587,56 nm uzunluğunda yeni bir çizgi tespit etti. Norman Lockyer, kimyager arkadaşı Edward Frankland ile birlikte çalışırken, keşfedilen elemente eski Yunanca'da "Güneş" anlamına gelen helyum adını verdi.
Yeni elementin keşfinin onuruna, Fransız Akademisi her iki bilim adamına, Norman Lockyer ve Pierre Jansen'e onur madalyası vermeye karar verdi.
İtalyan Luigi Palmieri, 1881 yılında volkanik gazlar üzerine yaptığı çalışmalar sırasında helyumu tanımlamayı başardı. Luigi Palmieri, volkanik ürünü bir Bunsen ocağında ısıtmak için kalsinasyonu kullandı ve ortaya çıkan gazların tüm spektrumunu belirlemeye çalıştı. Ancak Palmieri hiçbir zaman araştırmasını net bir şekilde formüle edemedi ve bu nedenle deneylerine pek önem verilmedi. Ancak yıllar sonra volkanik gazlarda helyum ve argon keşfedildi.
Dünyadaki helyumun keşfi, İskoç kimyager William Ramsay'ın kleveit mineralinin ayrışmasından elde edilen gazları incelediği 1895 yılında meydana geldi. Bir spektrometre kullanarak, gazların spektrumunda helyumun varlığını gösteren sarı bir çizgiyi tespit edebildi. Daha fazla araştırma için William Ramsay, bilim adamı William Crookes'a örnekler gönderdi. Ek çalışmalar, sarı çizginin Güneş'in kromosferinde daha önce keşfedilen helyumun spektrumuyla örtüştüğünü göstermiştir. Daha sonra İsveçli kimyagerler N. Lenglet ve P. Kleve, Ramsay'ın deneylerini kleveit ile tekrarlayarak helyumun atom ağırlığını doğru bir şekilde belirlemeyi başardılar. 1896 yılında Dünya'da helyumun keşfindeki son nokta, gezegenimizin atmosferinde helyumun varlığını belirleyen Siegbert Friedländer, Edward Baley ve Heinrich Kaiser tarafından atıldı.
Daha sonra Ramsay helyum konusundaki araştırmalarına devam etti ve helyumun sıklıkla toryum ve uranyuma eşlik ettiğini keşfetti. 1906'da bilim adamı Royds ve Rusenford, bu radyoaktif elementlerin alfa parçacıklarının helyum çekirdeği olduğunu keşfettiler. Atomik yapı teorisinin başlangıcı Ramsay'ın araştırması sayesinde atıldı.
Sıvı helyum ilk kez Hollandalı fizikçi Heike Kamerlingh-Onnes tarafından kısılarak elde edildi. Helyumu vakumda kaynayan hidrojende soğuttu. 1926 yılına kadar katı helyum elde etmek mümkün değildi. Alman fizikçi Willem Hendrik, helyumu yüksek basınç altında sıkıştırıp kristalleri ayırmayı başardı.
1932'de bilim adamı Kees, sıvı helyumun ısı kapasitesinin sıcaklığa bağımlılığını inceledi. 2,1 K sıcaklıkta (kesin değer = 2,172 K.), helyumun ısı kapasitesindeki yumuşak artışın yerini keskin bir düşüşe bıraktığını ve ısı kapasitesi grafiğinin Yunanca “lambda” (?) harfine benzediğini öğrendi. Bu keşif nedeniyle bu sıcaklık noktasına “?-noktası” adı verilmiştir. İşte bu noktada helyumla birlikte küresel değişiklikler meydana geliyor. Sıvı helyumun bir fazı, herhangi bir ısı açığa çıkarmadan diğerinin yerini alır. “?-noktası”nın altındaki helyuma helyum-II, üstündeki helyum-I adı verildi.
Helyumun aşırı akışkanlığı olgusu ilk olarak sıvı helyum-II'nin özelliklerini inceleyen Sovyet bilim adamı Pyotr Leonidovich Kapitsa tarafından keşfedildi. Sıvı helyum-II'nin neredeyse hiç sürtünme olmadan aktığını kanıtlayabildi.
ismin kökeni
Helyum kelimesi, periyodik element tablosundaki metalleri belirtmek için tipik olan “-й” (Latince “-um” - “Helyum”) ile bitmektedir. Bunun nedeni Lockyer'in helyumu keşfederken onun bir metal olduğunu varsayarak ona bu adı vermesidir. Ve artık onu “-on” ile biten “Helion” olarak yeniden adlandırmak mümkün değildi, çünkü bu isim helyumun hafif izotopunun (helyum-III) çekirdeğine atanmıştı.
Helyum bulma
Boşlukta
Evrende helyum bolluk açısından ikinci sırada yer alıyor. Uzaydaki helyumun büyük kısmı Büyük Patlama'dan sonra, birincil nükleosentez döneminde oluşmuştur. Şu anda, yıldızların bağırsaklarındaki hidrojenin termonükleer füzyonu nedeniyle Evrende helyum oluşuyor. Ağır elementlerin alfa bozunumu sırasında yer kabuğunda küçük bir helyum kısmı oluşur ve yer kabuğundan sızarak doğal gaz parçacıklarına bağlanır. Doğal gazdaki helyum konsantrasyonu hacimce yüzde yediye veya daha fazlasına ulaşabilir.
Dünyanın atmosferinde
Dünya atmosferindeki helyum, Ac, Th, U elementlerinin bozunması sonucu elde edilir. Atmosferdeki helyum içeriği kütlece %7,24?10?5'e, hacimce ise %5,27?10?4'e ulaşır. Helyum rezervlerinin yaklaşık 5?1014 m² olduğu tahmin edilmektedir. Tipik olarak diğer gazlardaki helyum konsantrasyonu yüzde ikiyi geçmez ve çok nadir durumlarda helyum içeriğinin% 8-15'e ulaştığı gazlar vardır.
Yer kabuğunda
Helyum, yer kabuğundaki içerik açısından argondan sonra ikinci sırada yer almaktadır. Karasal maddedeki helyum içeriğinin yaklaşık 3 g/t olduğu tahmin edilmektedir. En yüksek helyum konsantrasyonu toryum, samaryum, uranyum, monazit, gadolinit, fergusonit, kleveit ve torianit içeren minerallerde görülür. Aynı zamanda torianitte helyum içeriği 10,5 l/kg'a ulaşabilir, mineralin geri kalanında ise 0,8 ila 3,5 l/kg arasında değişir.
helium'un tanımı
Helyumun niteliksel olarak belirlenmesi için emisyon spektrumlarının analizi kullanılır (388,86 nm ve 587,56 nm çizgileri). Helyum, kromatografik ve kütle spektrometrik yöntemlerle kantitatif olarak belirlenir. Helyumun yoğunluk, termal iletkenlik vb. gibi fiziksel özelliklerinin ölçülmesine dayanan yöntemler de kullanılır.
Helyumun fiziksel özellikleri
Helyum inert bir kimyasal elementtir. Toksik değildir, renksizdir, tatsız ve kokusuzdur. Normal koşullar altında helyum, kaynama noktası 4.215 K (helyum IV) olan tek atomlu bir gazdır. Helyumun katı durumuna yalnızca yaklaşık 25 atmosfer veya daha yüksek bir basınçta ulaşılır. Basınç olmadan helyum, mutlak sıfıra yakın sıcaklıklarda bile katı duruma geçmez. Çoğu helyum bileşiği normal koşullar altında kararsızdır ve bağ oluşturmak için özel koşullar gerektirir.
Helyumun vücut üzerindeki etkileri
Çoğunlukla inert gazlar vücudu etkileyerek ilaç zehirlenmesine neden olur. Normal basınçta basit helyuma maruz kalmanın vücut üzerinde hiçbir etkisi yoktur. Kan basıncı arttığında kişi yüksek tansiyon sendromu yaşayabilir.
Gaz fazındaki özellikler
Helyum normal koşullar altında ideal bir gaz gibi davranır. Çoğu durumda helyum, yoğunluğu 0,17847 kg/m² olan çok atomlu bir gazdır. Helyumun normal koşullar altında termal iletkenliği 0,1437 W/(mK) olup, hidrojen ve diğer gazlarınkinden daha yüksektir. Normal koşullar altında özgül ısı kapasitesi 5,23 kJ/(kg.K), hidrojende ise 14,23 kJ/(kg.K)'dir.
Helyumla dolu bir tüpten akım geçtiğinde tüpteki basınca bağlı olarak farklı renklerde deşarjlar gözlemlenebilir. Basıncı azaltırsanız renkler pembe, sarıdan yeşil ve turuncuya dönecektir. Bu, helyum spektrumunun ultraviyoleden kızılötesi spektruma kadar değişen birkaç çizgiyi içermesiyle açıklanmaktadır. Helyum spektrumunun ana çizgileri 706,52 nm ile 447,14 nm arasında yer alır. Tüpteki basınçtaki azalma elektronun yol uzunluğunun artmasına neden olur ve helyum atomlarıyla çarpışmasından kaynaklanan enerji artar. Bunun sonucunda atomlar uyarılır ve daha fazla enerjiye sahip olur, bu da spektral çizgilerde bir kaymaya yol açar.
Helyum, diğer gazlara göre suda çok az çözünür. 20°C sıcaklıkta bir litre suda yalnızca 8,8 ml helyum çözünür. 2,5 ml 15°C'de etanolde ve 3,2 ml 25°C'de çözünür. Helyumun katı maddelerdeki yayılma hızı diğer gazlarınkinden birkaç kat daha yüksektir. Örneğin helyumun difüzyonu hidrojeninkinden %65 daha fazladır.
Helyumun kırılma indisi diğer gazlara göre birliğe daha yakındır. Normal sıcaklıkta helyumun Joule-Thomson katsayısı negatiftir. Yani hacim olarak serbestçe genişlediğinde ısınmaz. Helyum, normal basınçta yalnızca 40 K'nin altındaki sıcaklıklarda (Joule-Thomson ters çevirme sıcaklığının altında) serbest genleşme sırasında soğur. Sıcaklık düştükçe helyum genleşme soğuması sırasında sıvı duruma geçebilir. Bu tür bir soğutma, bir genişletici kullanılarak mümkündür.
Helyumun kimyasal özellikleri
Helyum, inert gazlar arasında en az aktif kimyasal elementlerden biridir. Çoğu helyum bileşiği, kararsız bir temel duruma ve kararlı bir uyarılmış elektronik duruma sahip olan eksimer molekülleri formunda gaz fazında bulunur. Helyum diatomik moleküller (He2), flor (HeF) ve klor (HeCl) içeren bileşikler oluşturma yeteneğine sahiptir.
Helyum üretimi
Endüstriyel olarak helyum üretmek için helyum içeren doğal gaz yatakları kullanılır. Helyumu diğer gazlardan ayırmak için derin soğutma kullanılır. Helyum diğer gazlara göre daha iyi sıvılaşır. Kısma kullanılarak helyum birkaç aşamada karbondioksit ve hidrokarbonlardan arındırılır. Sonuç, çeşitli gazların (helyum, hidrojen ve neon) bir karışımıdır. Daha sonra hidrojeni helyumdan ayırmak için CuO ve 650-800 K sıcaklık kullanılır. Helyum son olarak karışımın kaynayan N2 vakumunda soğutulması ve kalan safsızlıkların emilmesiyle saflaştırılır. Bu yöntem saf helyum üretir (hacimce %99,8'e kadar)
Rusya'da helyum gazı petrolden veya doğalgazdan elde ediliyor. Ana Rus helyum üretim tesisi Gazprom Dobycha Orenburg LLC'dir. Bu tesis, helyum içeriğini düşük helyum içeren gazdan çıkarıyor ve bu da nihai maliyetini artırıyor. Helyum maliyetini azaltmak için Doğu Sibirya ve Uzak Doğu'daki yatakların geliştirilmesine yönelik projeler geliştirildi. Bu aşamada dünya pazarının ana helyum tedarikçisi, yaklaşık 140 milyon m2'lik helyumla ABD'dir. yıllık helyum. En büyük helyum yataklarının tümü Amerika Birleşik Devletleri'nde bulunmaktadır. Rusya helyum üretiminde ABD ve Cezayir'den sonra üçüncü sırada yer alıyor.
Helyum taşımacılığı
Helyumun taşınması için özel gaz tüpleri kullanılır (GOST 949-73). Yolculuk sırasında zarar görmemesi için bu silindirlerin özel kaplara yerleştirilmesi gerekir. Paketlenmiş helyum tüplerini taşımak için gaz taşımaya uygun herhangi bir aracı kullanabilirsiniz. Sıvı helyum özel taşıma kaplarında taşınır. Sıvı helyum taşırken helyum içeren kaplar dik konumda olmalıdır. Uygun taşıma ile helyum hem demiryolu hem de özel araçlarla taşınabilir.
Helyum uygulaması
Helyum ulusal ekonomide ve endüstride yaygın olarak kullanılmaktadır. Metalurjide saf metallerin eritilmesinde helyum kullanılır. Helyum, E939 gıda katkı maddesi ve paketleme maddesi olarak kullanılır. Eşsiz özellikleri nedeniyle helyum soğutucu olarak kullanılır. Helyum, tıpta solunum karışımı olarak, lazerlerde ve kazanlarda ve boru hatlarında soğutucu olarak kullanılan balonlara doldurulur.
Helyum
HELYUM-BEN; M.[Yunancadan helios - güneş]. Kokusuz, kimyasal olarak inert bir gaz olan kimyasal element (He), hidrojenden sonra en hafif olanıdır.
◁ Helyum, ah, ah. G-th çekirdeği.
HelyumPeriyodik tablonun VIII grubunun kimyasal bir elementi olan (lat. Helyum) soy gazlara aittir; renksiz ve kokusuz, yoğunluk 0,178 g/l. Sıvılaştırılması bilinen tüm gazlardan (-268,93°C'de) daha zordur; Ne kadar derin soğutulursa soğutulsun normal basınç altında sertleşmeyen tek maddedir. Sıvı helyum, süperakışkanlığı 2,17°K'nin (-270,98°C) altında olan bir kuantum sıvısıdır. Helyum havada ve yer kabuğunda küçük miktarlarda bulunur; burada uranyumun ve diğer a-radyoaktif elementlerin (α-parçacıkları helyum atomlarının çekirdeğidir) bozunması sırasında sürekli olarak oluşur. Helyum Evren'de çok daha yaygındır, örneğin ilk keşfedildiği Güneş'te (bu nedenle adı: Yunanca helios - Güneş'ten gelir). Helyum doğal gazlardan elde edilir. Kriyojenik teknolojide, inert ortam oluşturmak için, havacılıkta (stratosferik balonları, balonları vb. doldurmak için) kullanılırlar.
HELYUMHELYUM (enlem. Helyum), He ("helyum" olarak okunur), atom numarası 2, atom kütlesi 4.002602 olan kimyasal element. 1. periyotta bulunan inert veya soy gazlar grubuna (periyodik sistemin grup VIIIA'sına) aittir.
Doğal helyum iki kararlı nüklidden oluşur: 3 He (hacimce %0,00013) ve 4 He. Helyum-4'ün neredeyse tamamen baskın olması, Dünya'nın uzun tarihi boyunca meydana gelen uranyum, toryum, radyum ve diğer atomların radyoaktif bozunması sırasında bu çekirdeğin çekirdeklerinin oluşumu ile ilişkilidir.
Nötr bir helyum atomunun yarıçapı 0,122 nm'dir. Nötr uyarılmamış bir atomun elektronik konfigürasyonu 1s 2
. Nötr bir atomun sıralı iyonlaşma enerjileri sırasıyla 24.587 ve 54.416 eV'ye eşittir (helyum atomu, tüm elementlerin nötr atomları arasında ilk elektronun en yüksek soyutlanma enerjisine sahiptir).
Basit madde helyum, rengi, tadı veya kokusu olmayan hafif tek atomlu bir gazdır.
Keşif tarihi
Helyumun keşfi 1868'de Fransız gökbilimci P. J. Jansen'in güneş tutulmasını gözlemlemesiyle başladı. (santimetre. JANSIN Pierre Jules Cesar) ve İngiliz D. N. Lockyer (santimetre. LOCKYER Joseph Norman) Güneş koronasının spektrumunda bağımsız olarak keşfedildi (santimetre. GÜNEŞ KORONA) sarı çizgi (adlandırılır) D 3 -line), o zamanlar bilinen hiçbir elemente atfedilemeyen. 1871'de Lockyer, kökenini Güneş'te yeni bir elementin varlığıyla açıkladı. 1895'te İngiliz W. Ramsay (santimetre. RAMSAYWilliam) spektrumunda aynı olan doğal radyoaktif cevher kleveitinden bir gaz izole etti. D 3 satır. Lockyer, yeni elemente keşif tarihini yansıtan bir isim verdi (Yunanca Helios - güneş). Lockyer, keşfedilen elementin bir metal olduğuna inandığından, elementin Latince adında genellikle metallerin adında kullanılan “lim” son ekini (Rusça “ii” ekine karşılık gelir) kullanmıştır. Böylece helyum, Dünya'daki keşfinden çok önce, sonu itibariyle onu diğer inert gazların adlarından ayıran bir isim almıştır.
Doğada olmak
Atmosfer havasındaki helyum içeriği çok küçüktür ve hacimce yaklaşık %5,27.10-4 kadardır. Yerkabuğunda %0,8·10-6, deniz suyunda ise %4·10-10'dur. Helyumun kaynağı, helyum içeriğinin hacimce% 2-3'e ve nadir durumlarda% 8-10'a ulaştığı petrol ve helyum içeren doğal gazlardır. Ancak uzayda helyum hidrojenden sonra en çok bulunan ikinci elementtir: kozmik kütlenin %23'ünü oluşturur.
Fiş
Helyum üretme teknolojisi çok karmaşıktır: derin soğutma yöntemi kullanılarak doğal helyum içeren gazlardan izole edilir. Bu tür gazların Rusya, ABD, Kanada ve Güney Afrika'da yatakları var. Helyum ayrıca bazı minerallerde (monazit, torianit ve diğerleri) bulunur ve ısıtıldığında 1 kg mineralden 10 litreye kadar helyum açığa çıkabilir.
Fiziki ozellikleri
Helyum hafif, yanıcı olmayan bir gazdır, normal şartlarda helyum gazının yoğunluğu 0,178 kg/m3'tür (sadece hidrojen gazı daha azdır). Helyumun kaynama noktası (normal basınçta) yaklaşık 4,2 K'dir (veya –268,93 °C, bu en düşük kaynama noktasıdır).
Normal basınçta sıvı helyum, mutlak sıfıra (0K) yakın sıcaklıklarda bile katıya dönüştürülemez. Yaklaşık 3,76 MPa basınçta helyumun erime noktası 2,0 K'dir. Sıvı helyumun katı duruma geçişinin gözlemlendiği en düşük basınç 2,5 MPa'dır (25 at), helyumun erime noktası yaklaşık 1,1 K'dir (–272,1 °C).
0,86 ml helyum 20 °C'de 100 ml suda çözünür; organik çözücülerdeki çözünürlüğü daha da azdır. Hafif helyum molekülleri çeşitli malzemelerden (plastik, cam, bazı metaller) iyi bir şekilde geçer (yayılır).
–270,97 °C'nin altına soğutulan sıvı helyum-4 için, bu sıvının kuantum sıvısı olarak adlandırılan özel bir sıvı olarak değerlendirilmesine neden olan bir takım olağandışı etkiler gözlemlenir. Biraz daha yüksek sıcaklıklarda bulunan sıvı helyum-I'in aksine, bu sıvıya genellikle helyum-II adı verilir. Sıvı helyumun ısı kapasitesinin sıcaklıkla değişiminin grafiği Yunan harfi lambda (l)'ye benzemektedir. Helyum-I'in helyum-II'ye geçiş sıcaklığı 2,186 K'dir. Bu sıcaklığa genellikle l noktası denir.
Sıvı helyum-II, viskozite (süper akışkanlık olarak adlandırılan) sergilemeden küçük deliklerden ve kılcal damarlardan hızlı bir şekilde nüfuz edebilir. (santimetre. SÜPER AKIŞKANLIK) sıvı helyum-II). Ayrıca helyum-II filmleri katıların yüzeyinde hızla hareket ederek sıvının yerleştirildiği kaptan hızla ayrılmasına neden olur. Helyum-II'nin bu özelliğine süpersürüngen denir. Helyum-II'nin süperakışkanlığı 1938'de Sovyet fizikçi P. L. Kapitsa tarafından keşfedildi. (santimetre. Kapitsa Petr Leonidovich)(Nobel Fizik Ödülü, 1978). Helyum-II'nin benzersiz özelliklerine ilişkin bir açıklama başka bir Sovyet fizikçi L. D. Landau tarafından yapıldı. (santimetre. LANDAU Lev Davidovich) 1941-1944'te (Nobel Fizik Ödülü, 1962).
Helyum herhangi bir kimyasal bileşik oluşturmaz. Doğru, seyreltilmiş iyonize helyumda oldukça kararlı diatomik He2 + iyonlarını tespit etmek mümkündür.
Başvuru
Helyum, metalleri kaynak yaparken, keserken ve eritirken, roket yakıtı pompalarken, hava gemilerini ve balonları doldururken, helyum lazerleri ortamının bir bileşeni olarak inert ve koruyucu bir atmosfer oluşturmak için kullanılır. Dünyadaki en soğuk sıvı olan sıvı helyum, deneysel fizikte benzersiz bir soğutucudur ve bilimsel araştırmalarda (örneğin, elektriksel süperiletkenlik çalışmalarında) ultra düşük sıcaklıkların kullanılmasına olanak tanır. (santimetre. SÜPERİLETKENLİK)). Helyumun kanda çok az çözünmesi nedeniyle dalgıçlara nefes almaları için sağlanan yapay havanın bir bileşeni olarak kullanılır. Azotun helyumla değiştirilmesi dekompresyon hastalığını önler (santimetre. CAİZON HASTALIĞI)(Sıradan havayı soluduğunuzda, nitrojen kanda yüksek basınç altında çözünür ve daha sonra küçük damarları tıkayan kabarcıklar şeklinde serbest bırakılır).
ansiklopedik sözlük. 2009 .
Eş anlamlı:Diğer sözlüklerde “Helyum” un ne olduğunu görün:
- (enlem. Helyum) Periyodik tablonun VIII. grubunun kimyasal elementi, atom numarası 2, atom kütlesi 4.002602, soy gazlara aittir; renksiz ve kokusuz, yoğunluk 0,178 g/l. Sıvılaştırılması bilinen tüm gazlardan (268,93.C'de) daha zordur;... ... Büyük Ansiklopedik Sözlük
- (Yunanca, helyos sun'dan). Güneş spektrumunda keşfedilen ve yeryüzünde bazı nadir minerallerde bulunan bir element gövdesi; İhmal edilebilir miktarlarda havaya karışır. Rus dilinde yer alan yabancı kelimeler sözlüğü. Chudinov A.N. Rus dilinin yabancı kelimeler sözlüğü
- (sembol He), gaz halindeki metalik olmayan bir element olan SOY GAZ, 1868'de keşfedildi. İlk olarak 1895'te klevita (bir tür uranit) mineralinden elde edildi. Şu anda ana kaynağı doğal gazdır. Ayrıca... ... Bilimsel ve teknik ansiklopedik sözlük
Ben, kocam. , eskimiş Eliy, I.Otch.: Gelievich, Gelievna.Türevler: Gelya (Gela); Elya.Kökeni: (Yunanca hēlios sun'dan gelir.) İsim günü: 27 Temmuz Kişisel isimler sözlüğü. Helyum Bkz. Ellium. Gün Meleği. Referans... Kişisel isimler sözlüğü
HELYUM- kimya. element, sembol He (enlem. Helyum), at. N. 2, adresinde. m.4.002, inert (asil) gazları ifade eder; renksiz ve kokusuzdur, yoğunluğu 0,178 kg/m3'tür. Sıradan koşullar altında gaz, atomu bir çekirdek ve iki elektrondan oluşan tek atomlu bir gazdır; oluşturulmuş... Büyük Politeknik Ansiklopedisi
- (Helyum), He, periyodik tablonun VIII. grubunun kimyasal elementi, atom numarası 2, atom kütlesi 4.002602; soy gazlara aittir; en düşük kaynama noktasına sahip madde (kn. 268,93°C), normal basınçta sertleşmeyen tek madde;... ... Modern ansiklopedi
Kimya sekizinci element gr. periyodik tablo, seri numarası 2; at ile inert gaz. V. 4.003. İki kararlı izotop He4 ve He3'ten oluşur. Soder. Sabit değildirler ve oluşum kaynağına bağlıdırlar ancak ağır izotop her zaman baskındır. İÇİNDE… … Jeolojik ansiklopedi
Helyum- (Helyum), He, periyodik tablonun VIII. grubunun kimyasal elementi, atom numarası 2, atom kütlesi 4.002602; soy gazlara aittir; en düşük kaynama noktasına sahip madde (kaynama noktası 268,93°C), normal basınçta sertleşmeyen tek madde;... ... Resimli Ansiklopedik Sözlük
Sunny Rusça eş anlamlılar sözlüğü. Helyum ismi, eşanlamlı sayısı: 4 gaz (55) ismi (1104)... Eş anlamlılar sözlüğü
HELIUM, ben, kocam. Kimyasal bir element, inert bir gaz, renksiz ve kokusuz, hidrojenden sonra en hafif gaz. | sıfat helyum, ah, ah. Ozhegov'un açıklayıcı sözlüğü. Sİ. Ozhegov, N.Yu. Shvedova. 1949 1992… Ozhegov'un Açıklayıcı Sözlüğü
- (Helyum) gazı renksiz ve kokusuzdur, kimyasal olarak aktif değildir, havadan 7,2 kat daha hafiftir, yanmaz. Atmosferde çok küçük miktarlarda (%1/2000) bulunur. Hafifliği ve yanıcı olmaması nedeniyle esas olarak hava gemilerinin doldurulmasında kullanılır ... Deniz Sözlüğü
Kitabın
- Beyaz At, Heliy Ryabov, 384 sayfa Heliy Ryabov, Born of a Revolution, State Border, One of Us, Theft, Favorite vb. televizyon dizilerinden okuyuculara tanıdık geliyor. The Tale of.. kitaplarının yazarıdır. Kategori: