sintetizirana iz mokraćne kiseline. Funkcije mokraćne kiseline. Poremećaji metabolizma purina
Kod ljudi i drugih sisara, purinski nukleotidi se sintetiziraju kako bi zadovoljili potrebe tijela za monomernim prekursorima nukleinskih kiselina, kao i za spojeve koji obavljaju druge funkcije opisane u Pogl. 34. Kod nekih kičmenjaka (ptice, vodozemci, gmizavci) sinteza purinskih nukleotida ima dodatnu funkciju – dio je mehanizma kojim se višak dušika izlučuje u obliku mokraćne kiseline; takvi organizmi se nazivaju urikotelični. Organizmi u kojima je krajnji produkt metabolizma dušika urea (kao i kod ljudi) nazivaju se ureotelni. Budući da urikotelni organizmi uklanjaju "višak" dušika u obliku mokraćne kiseline, sinteza purinskih nukleotida u njima je intenzivnija nego u ureotelnih. Istovremeno, de novo putevi za sintezu purinskih nukleotida su zajednički za obje grupe organizama.
Informacija o porijeklu svakog od atoma u molekuli purinske baze dobijena je u procesu istraživanja radioizotopa na pticama, pacovima i ljudima (slika 35.2). Na sl. 35.3 je dijagram puta za biosintezu purinskih nukleotida. Prva faza (reakcija 1) je formiranje 5-fosforibozil-1-pirofosfata (FRPP). Ova reakcija nije jedinstvena za biosintezu purinskih nukleotida. FRPP takođe služi kao prekursor u sintezi pirimidin nukleotida (vidi sliku 35.15), neophodan je za sintezu NAD i NADP, dva koenzima koji uključuju nikotinsku kiselinu.
Rice. 35.2. Poreklo atoma dušika i ugljika purinskog prstena.
U reakciji 2 (slika 35.3), kataliziranoj fosforibozil pirofosfat amidotransferazom, iz FRPP i glutamina nastaju glutamat i 5-fosforibosilamin. Iako su mogući i drugi mehanizmi sinteze 5-fosforibozilamina, reakcija koju katalizira amidotransferaza ima najvažniji fiziološki značaj u tkivima sisara.
Zatim, 5-fosforibosilamin reaguje sa glicinom (reakcija 5); u ovom slučaju nastaje glicinamidribozil fosfat (glicinamidoribotid, GAR). Amidna grupa glutamina služi kao izvor atoma dušika na poziciji 9 molekule purina (N-9), a glicin je izvor atoma ugljika na pozicijama 4 i 5 (C-4 i C-5) u purinski prsten. Ovu reakciju katalizira glicinamid kinošišegas. U reakciji 4, atom dušika molekule glicinamid-ribozil fosfata je formiliran.Kao rezultat ove reakcije, katalizirane glicinamid-ribozil fosfat formil transferazom, ulazni fragment od jednog ugljika će zauzeti poziciju C-8 u nastanku purina baza. Reakcija 5 ponovo uključuje glutamin, donatora amidne grupe. Amidacija se događa na C-4 atomu formilglicinamid-ribozil fosfata i katalizira je formilglicinamidin-ribozilfosfat tetetaza. Vezani atom dušika će zauzeti poziciju 3 u molekulu purina.
Kao rezultat zatvaranja imidazolnog prstena kataliziranog aminoimidazol ribozil foefat sintetazom, nastaje aminoimidazol ribozil fosfat (reakcija 6). Zatim, sinteza prolazi kroz fazu formiranja aminoimidazolkarboksilat-ribozil fosfata (reakcija 7). Kao rezultat reakcije nastaje karbonilna grupa čiji je izvor molekul koji nastaje tijekom disanja.
Atom dušika na poziciji 1 dolazi iz a-amino grupe aspartata (reakcija 8), čiji ostatak formira sukcinil fragment u amiribozil fosfatu (AISKAR) molekulu.
U reakciji 9, AISCAR sukcinil grupa se uklanja kao fumarat. Preostali aminoimidazolkarboksilamid-ribozil fosfat se formilira (reakcija 10) pomoću α-formiltetrahidrofolata da bi se formirao amidoimidazolkarboksilamid-ribozilfosfat; reakciju katalizira odgovarajuća formil transferaza. Novovezani atom ugljika, kao i atom C-8, dolazi iz skupa jednougljičnih fragmenata uz učešće tetrahidrofolata i zauzima poziciju 2 u molekulu purina.
Do zatvaranja prstena (reakcija 11) dolazi uz pomoć IMP-ciklohidrolaze, što rezultira stvaranjem prve purin nukleotid-inozične kiseline (inozin monofoefat; IMP).
(vidi skeniranje)
Rice. 35.3. Put de novo biosinteze purina iz riboza-5-fosfata i ATP-a (pogledajte tekst za objašnjenja). ili RO.
Važnost metabolizma folata
Tokom biosinteze purinskih nukleotida (slika 35.3), atomi ugljika na pozicijama 8 i 2 dolaze iz i -formiltetrahidrofolata, respektivno. Potonji nastaje iz tetrahidrofolata, koji je pak proizvod dehidrogenacije ovisno o tome. Ako služi kao izvor jednougljičnih fragmenata za mnoge akceptore, onda daje jednougljičnu grupu (bilo direktno ili samo kroz fazu formiranja Iz navedenih informacija proizilazi da inhibicija procesa formiranja razmatranih folata takođe ima inhibitorni efekat na de novo sintezu purina.
Formiranje AMP i GMP od IMP-a
Kao što je prikazano na sl. 35.4 adenin (reakcije 12 i 13) i gvanin nukleotidi (reakcije 14 i 15) nastaju aminacijom, odnosno oksidacijom i aminacijom zajedničkog prekursora, inozin monofoefata (IMP). Aminacija HMR-a se odvija kroz formiranje intermedijera u kojem se aspartat dodaje inozičkoj kiselini kako bi se formirao adenilosukcinat. Ova reakcija liči na reakciju 8 biosinteze purina (slika 35.3), u kojoj a-azot asparaginske kiseline daje atom purinskog prstena. Formiranje adenilosukcinata katalizira adenilosukcinat sintaza i događa se uz učešće GTP. Uklanjanje preostalog dijela asparaginske kiseline u obliku fumarata dovodi do stvaranja adenilne kiseline (adenozin monofosfat; AMP). Odvajanje fumarata od adenilosukcinata katalizira enzim adenilosukcinaza. Isti enzim katalizira cijepanje fumarata od aminoimifosfata (reakcija 9).
Takođe, u dva koraka, iz IMP se formira gvanzin monofosfat (GMP). U prvoj reakciji na tom putu (reakcija 14) uz učešće NAD-a, IMP se oksidira u ksantin monofosfat (XMP). Zatim se XMP aminira sa amidnom grupom glutamina (reakcija 15). Ovaj proces zahtijeva ATP, što pomalo podsjeća na zahtjev za GTP u konverziji IMP-a u AMP.

Rice. 35.4. Konverzija IMP-a u AMP i GMP (objašnjenje u tekstu).
Inhibitori biosinteze purina
Nekoliko analoga glutamina antimetabolita ima snažan inhibitorni učinak na biosintezu purina. Azaserin (O-diazo-acetil-b-serin) djeluje kao antagonist glutamina, posebno u reakciji 5. Diazonorleucin blokira reakciju 2, a α-merkaptonurin, zajedno sa drugim efektima, inhibira reakcije 13 i 14 sinteze AMP i GMP, respektivno. Mikofenolna kiselina inhibira reakciju 14.
Formiranje di- i trifosfata purinskih nukleozida
Konverzija AMP i GMP u odgovarajuće di- i trifosfate vrši se u dvije faze (slika 35.5). Reakcije fosforilacije - prijenos fosfatnih grupa iz ATP-a - provode se nukleozid monofosfat kinazom i nukleozid difosfat kinazom.
Sinteza purinskih deoksiribonukleotida
Sinteza purinskih i pirimidinskih deoksiribonukleotida odvija se direktnom redukcijom ostatka 2-ugljika riboze odgovarajućeg ribonukleotida, a ne de novo sintezom iz 2"-deoksianaloga FRPP. Do redukcije 2-ugljičnog atoma riboze dolazi samo nakon pretvorbe purinskih i pirimidinskih nukleotida u odgovarajuće nukleozid difosfate.U nekim bakterijama, kobalamin (vitamin B12) je uključen u ovaj proces redukcije.Kod životinja se proces oporavka događa čak i u odsustvu vitamina B12.Smanjenje ribonukleozida od difosfata u deoksiribonukleozid difosfate katalizira ribonukleotid reduktaza i zahtijeva učešće tioredoksina (proteinski kofaktor), tioredoksinreduktaze (enzim flavoprogeina) i NADPH (kofaktor). transformaciju tioredoksina katalizira tioredoksin reduktaza. kleozid difosfat redukovan tioredoksinom katalizira ribonukleozid reduktaza (Sl. 35.6).

Rice. 35.5. Reakcije fosforilacije nukleozid monofosfata i nukleozid difosfata.

Rice. 35.6. Redukcija ribonukleozid difosfata u 2-deoksiribonukleozid difosfat.
Ovaj složeni enzimski sistem funkcioniše u ćelijama samo tokom perioda aktivne sinteze i deobe DNK.
Tkivna specifičnost biosinteze purina
Nisu sva ljudska tkiva podvrgnuta de novo sintezi purinskih nukleotida. Eritrociti i polimorfonuklearni leukociti nisu u stanju da sintetiziraju α-fosforibosilamin, pa su im potrebni egzogeni purini da bi formirali purinske nukleotide. Periferni limfociti su u stanju da sintetiziraju male količine purina de novo. Utvrđeno je da ćelije mozga sisara sadrže vrlo male količine FRPP amidotransferaze, te se na osnovu toga zaključilo da sinteza purinskih nukleotida u mozgu ovisi o unosu egzogenih purina. Pokazalo se da je glavno mjesto za sintezu purinskih nukleotida u tijelu sisara jetra. Iz njega slobodne baze ili nukleozidi ulaze u druga tkiva koja nisu sposobna za de novo sintezu purina.
Putevi regeneracije purinskih nukleotida
Regeneraciju purinskih nukleotida osiguravaju dva glavna mehanizma. U kvantitativnom smislu, mehanizam fosforibozilacije slobodnog purinske baze enzimi koji koriste FRPP kao donora fosforiboze. Sekunda opšti mehanizam je fosforilacija purinskih nukleozida na α-hidroksilnoj grupi.
1. Fosforibozilacija purinskih baza
U ljudskim tkivima fosforibozilacija

Rice. 35.7. Fosforibozilacija adenina katalizirana adenin fosforibozil transferazom.
Purinske baze provode dva enzima. Prva, adenin fosforiboziltransferaza, prenosi fosforibozu sa FRPP na adenin. U tom slučaju nastaje AMP (slika 35.7). Druga - hipokeantin-guanin-fosforiboziltransferaza - katalizira fosforibozilaciju ksantina i gvanina sa stvaranjem IMP i GMP, respektivno (slika 35.8). Proces koji uključuje drugi enzim, kao što će biti prikazano u nastavku, odvija se aktivnije od sinteze AMP iz adenina.
2. Fosforilacija purinskih ribonukleozida
Pretvorbu purinskih ribonukleozida u purinske ribonukleotide kod ljudi katalizira enzim adenozin kinaza (slika 35.9). Adenozin kinaza, osim toga, fosforilira 2-deoksiadenozin, također pokazuje određenu aktivnost prema guanozinu, inozinu i njihovim 2-deoksi derivatima. Deoksicitidin kinaza, pored fosforilacije α-deoksicitidina, katalizuje fosforilaciju α-deoksiadenozina i β-deoksiguanozina u formiranje dAMP i dGMP.
Osim toga, u ljudskim tkivima funkcioniše ciklus (slika 35.10), u kojem se, prvo, IMP, GMP i njihovi deoksiribonukleotidni analozi, pod dejstvom

Rice. 35.8. Fosforibozilacija hipoksantina i gvanina u IMP i GMP, respektivno. Obje reakcije katalizira hipoksantin-guanin-fosforiboziltransferaza.

Rice. 35.9. Fosforilacija adenozina u AMP adenozin kinazom.
purin-5-nukleotidaza se pretvara u odgovarajuće nukleozide (inozin, deoksinozin, gvanozin i deoksiguanozin), a zatim, kao rezultat reakcije katalizirane purin nukleozid fosforilazom, hipoksantinom ili gvaninom i produktima fosforolize ili fosforoze-2- nastaju deoksiriboza-1-fosfat. Dalje, uz učešće FRPP, ciklus se završava fosforibozilacijom formiranih baza u IMP ili GMP. Funkcija ovog ciklusa je nepoznata, ali nema sumnje da je potrošnja FRPP u ljudskom tijelu u ovom ciklusu veća nego u de novo sintezi purinskih nukleotida.
Sporedni put ovog ciklusa uključuje konverziju IMP u AMP (reakcije 12 i 13, slika 35.4) i naknadnu reakciju stvaranja adenozina iz AMP. Čini se da ovu reakciju katalizira ista purinska 5-nukleotidaza koja hidrolizira IMP u inozin. Rezultirajući adenozin se zatim ili fosforilira u AMP pomoću adenozin kinaze ili se pretvara u inozin pomoću adenozin deaminaze. U kvantitativnom smislu, ova "inozinska petlja" je manje značajna od gore opisanog ciklusa, ali je reakcija deaminacije adenozina veoma važna za funkcionisanje imunog sistema.
Regulacija biosinteze purina
Energija hidrolize šest makroergijskih fosfodiestarskih veza ATP-a troši se na sintezu molekula IMP, dok kao prekursori djeluju glicin, glutamin, meteniltetrahidrofolat i aspartat. Efikasna regulacija de novo biosinteze purina je važna za očuvanje energije i nutritivnih resursa. najvažniji

Rice. 35.10. Ciklusi reciklaže purina, uključujući interkonverzije AMP, IMP i, u manjoj mjeri, GMP; formiranje odgovarajućih ribonukleozida i njihova transformacija u purinske ribonukleotide. Deoksiadenozin, deoksiinozin i deoksiguanozin se pretvaraju istim putevima; deoksiadenozin i deoksiguanozin se mogu direktno fosforilirati u dAMP i dGMP, respektivno.
intracelularna koncentracija FRPP igra ulogu u ovom procesu. Određuje se omjerom brzina njegove sinteze, iskorištenja i razgradnje. Brzina sinteze FRPP ovisi o 1) prisutnosti supstrata sinteze, posebno riboze-5-fosfata, i 2) katalitičke aktivnosti FRPP sintaze, koja je zauzvrat povezana s unutarćelijskom koncentracijom fosfata, kao i sa koncentracijom purinskih i pirimidin ribonukleotida koji djeluju kao alosterični regulatori (slika 35.11). Stopa iskorištenja FRPP-a u velikoj mjeri ovisi o intenzitetu ciklusa reciklaže purinske baze, tokom kojeg se ksantin i gvanin fosforiboziliraju u odgovarajuće ribonukleotide. U manjoj mjeri, stopa iskorištenja FRPP ovisi o intenzitetu de novo sinteze purina. Ovaj zaključak se zasniva na sljedećem zapažanju: u eritrocitima i kultiviranim fibroblastima muškaraca s nasljednim poremećajem aktivnosti hipoksantin-guanin-fosforiboziltransferaze, nivo FRPP se povećava nekoliko puta.

Rice. 35.11. Regulacija brzine de novo sinteze purina. Pune linije označavaju put hemijskih transformacija. Isprekidane linije predstavljaju inhibiciju povratnih informacija krajnjim proizvodima.

Rice. 35.12. Regulacija transformacije IMP u nukleotide adenozina i gvanozina. Pune linije označavaju put hemijskih transformacija. Isprekidane linije predstavljaju regulaciju pozitivne i negativne povratne sprege.
Pokazalo se da je FRPP amidotransferaza, prvi od enzima uključenih u de novo sintezu purinskih nukleotida, in vitro inhibirana purinskim nukleotidima (posebno adenozin monofosfatom i gvanozin monofosfatom) prema principu povratne sprege. Ovi inhibitori se takmiče sa supstratom, FRPP, koji, kako se ispostavilo, zauzima centralno mesto u regulaciji de novo sinteze purina. Mnogi indirektni podaci ukazuju da je uloga amidotransferaze u ovom procesu manje značajna od uloge FRPP sintetaze.
Formiranje GMP ili AMP iz IMP regulirano je pomoću dva mehanizma (slika 35.12). AMP reguliše aktivnost adenilosukcinat sintetaze utičući na sopstvenu sintezu po principu povratne sprege. GMP reguliše sopstvenu sintezu, delujući na istom principu za α-dehidrogenazu. Uz to, stvaranje adenilosukcinata iz IMP-a na putu do AMP-a stimulira GTP. Formiranje GMP-a iz ksantozin monofosfata zahtijeva prisustvo ATP-a. Dakle, postoji značajna unakrsna regulacija divergentnih puteva metabolizma IMP. Takva regulacija inhibira biosintezu jednog od purinskih nukleotida u odsustvu drugog. Hipoksantin-guanin-fosforiboziltransferaza, koja katalizuje stvaranje IMP i GMP iz ksantina, odnosno gvanina, veoma je osetljiva na inhibitorni efekat ovih nukleotida.
Redukcija ribonukleozid difosfata u deoksiribonukleozid difosfate podliježe složenoj regulaciji. Ovaj proces (slika 35.13) obezbeđuje uravnoteženo formiranje deoksiribonukleotida za sintezu DNK.

Rice. 35.13. Regulacija redukcije purinskih i pirimidin ribonukleotida na odgovarajuće α-deoksiribonukleotide. Pune linije označavaju put hemijskih transformacija, isprekidane linije označavaju pozitivnu i negativnu povratnu regulaciju.
Katabolizam purina
Krajnji proizvod katabolizma purina kod ljudi je mokraćna kiselina. Prilikom pregleda pacijenata sa nasljednim oblikom insuficijencije enzimskih sistema katabolizma purina, utvrđeno je da se 99% mokraćne kiseline formira iz supstrata nukleozid fosforilaze, koja funkcionira u ciklusu reciklaže purina. Purinski produkti reakcije nukleozid fosforilaze - hipoksantin i gvanin - pretvaraju se u mokraćnu kiselinu; međuproizvod je ksantin, koji nastaje u reakcijama koje kataliziraju guanaza i ksantinokeidaza (vidi sliku 35.1) u jetri, tanko crijevo i bubrezi.
Ksantin oksidaza je važna meta za farmakološku intervenciju kod hiperurikemije i gihta. Kod nižih primata i drugih sisara (ali ne i kod ljudi), mokraćna kiselina se hidrolizira urikazom u alantoin (slika 35.14) - spoj koji je visoko rastvorljiv u vodi. Pticama i kopnenim gmizavcima nedostaje urikaza; izlučuju mokraćnu kiselinu i gvanin kao krajnje produkte metabolizma dušika (proteina) i purina.
Ovi organizmi su razvili urikotelni sistem koji im omogućava da zadrže vodu povezanu sa mokraćnom kiselinom kada se potonja izluči kao talog. Da je urea krajnji proizvod njihovog metabolizma dušika, bilo bi nemoguće zadržati vodu hidratacije, jer topljivost uree u vodi dostiže 10 mol/l (koncentracija mnogo veća od one koja se može postići koncentriranjem uree u bubrezima ).
Metabolizam mokraćne kiseline kod ljudi (giht)
Metabolizam mokraćne kiseline kod ljudi proučavan je korištenjem izotopski označene mokraćne kiseline i njenih prekursora glicina i formata. [-Mokraćna kiselina ubrizgavana je intravenozno zdravim ljudima i pacijentima sa gihtom, kod kojih se u organizmu akumuliraju značajne količine mokraćne kiseline i njene natrijumove soli. Ukupna količina mokraćne kiseline u vodenoj fazi organizma izračunata je iz razblaženja ubrizganog izotopa. Ovaj parametar se naziva "puna rastvorljivih urata". Prosječna vrijednost ovog pokazatelja za 25 ispitanih zdravih odraslih muškaraca iznosila je 1200 mg (raspon 866-1578 mg), a kod tri zdrave žene kretao se od 541 do 687 mg. Kod pacijenata sa gihtom, bazen rastvorljivih urata bio je značajno veći i varirao je od 2000 do 4000 mg za pacijente bez gihtnih čvorova, odnosno bez naslaga natrijum urata u mekim tkivima. Kod teškog gihta, praćenog formiranjem čvorova, bazen rastvorljivih urata dostigao je vrednost od 31.000 mg. Brzina obnavljanja kod zdravih ljudi je 600 mg na 24 sata.18-20% mokraćne kiseline uklonjene iz tijela se razlaže na i

Rice. 35.14. Formiranje alantoina iz mokraćne kiseline.
amonijaka i izlučuje se kroz crijeva. Dio urata se izlučuje žučom i razgrađuje se crijevnom mikroflorom. Treba napomenuti da razgradnja mokraćne kiseline kod ljudi nije povezana s vitalnom aktivnošću crijevnih bakterija.
Važnost urata za ljudsko tijelo nije ograničena na njihovu ulogu kao krajnjeg proizvoda u metabolizmu purina. Urati mogu funkcionirati kao antioksidansi tako što prolaze kroz neenzimsku konverziju u alantoin. Pretpostavlja se da endogeni antioksidans - urat - zamjenjuje askorbat kod primata, čija se sposobnost sinteze gubi kod ovih sisara. Dakle, sasvim je moguće da je u toku evolucije gubitak urikaze pružio određene selektivne prednosti za one organizme koji su izgubili sposobnost redukcije gulonolaktona u askorbat.
Natrijum urat se lako filtrira u glomerulu sisara, u velikoj meri se reapsorbuje i delimično izlučuje u proksimalnom tubulu, zatim se izlučuje u Henleovoj petlji i verovatno ponovo reapsorbuje u distalnom tubulu. Po danu zdrava osoba Oslobađa se 400-600 mg mokraćne kiseline. Veliki broj farmakoloških lijekova i prirodnih spojeva utiče na reapsorpciju natrijum urata u bubrežnim tubulima i njegovo izlučivanje. Aspirin u visokim dozama inhibira i izlučivanje i reapsorpciju mokraćne kiseline u bubrezima.
Stranica 1
Sintezu mokraćne kiseline (sa zanemarljivim prinosima) prvi je izvršio češki hemičar I.
Postoji nekoliko sinteza mokraćne kiseline, što potvrđuje njenu strukturu.
Postoji nekoliko načina za sintezu mokraćne kiseline. Od njih, Traube metoda je najšire korištena i korištena za sintezu različitih spojeva purinske grupe.
Zajedno sa svojim učenikom Rosenom sintetizirao je mokraćnu kiselinu.
Kasnije je Traube poboljšao svoju metodu za sintezu mokraćne kiseline, dobijajući 4-amino - 2 6-dioksipirimidin u jednoj fazi kondenzacijom uree sa etil cijan esterom sirćetna kiselina.
Pretpostavlja se da rakovi imaju put za sintezu mokraćne kiseline, ali ova pretpostavka se zasniva na jednostavnoj analogiji sa insektima; Ne postoje direktni podaci o važnoj ulozi ovog puta u izlučivanju dušika.
Sva ova jedinjenja nastaju kao intermedijeri u sintezi mokraćne kiseline (str.
Reakcija je uglavnom od istorijskog interesa, jer je to jedna od prvih metoda za sintezu mokraćne kiseline.
Inicijalna invazija insekata u kopnena staništa vjerovatno se dogodila istovremeno sa razvojem u njima aktivnog sistema za sintezu mokraćne kiseline kao krajnjeg produkta metabolizma dušika. Odavde se aktivnom sekrecijom izlučuje u lumen Malpigijevih tubula. Malpigijev tubul, stražnje crijevo i sistem rektuma služe kao organ za izlučivanje vode, jona i mokraćne kiseline. Kod kopnenih insekata, mokraćna kiselina čini preko 80% izlučenog dušika.
Sembritsky je, nakon što je dobio 1 3-dietiluričnu kiselinu iz 1 3-dietilbarbiturne kiseline kroz intermedijer 1 3-dietiluramil, pokazao da je metoda koju je Fischer predložio za sintezu mokraćne kiseline opće prirode.
Mokraćna kiselina predstavlja za određenu grupu životinja isti važan produkt izlučivanja kao urea ili amonijak za druge. Ali nema pouzdanih podataka o mehanizmu sinteze mokraćne kiseline, a jednako tako i o materijalu od kojeg je nastala, iako o tome postoji niz hipoteza.
Mokraćnu kiselinu najčešće susrećemo kod ptica i urikotelnih gmizavaca, jer je njihov glavni metabolički produkt dušika mokraćna kiselina, a ne urea. Kod većine ptica formiranje mokraćne kiseline događa se u jetri: hepatektomija ih dovodi do činjenice da se zaustavlja sinteza mokraćne kiseline, a povećava se sadržaj amonijevog dušika u krvi. Eksperimenti sa izotopima potvrdili su da je kod ptica i gmizavaca, kako se i očekivalo, prekursor mokraćne kiseline amonijak. Urea ne igra ulogu prekursora mokraćne kiseline i može se koristiti samo kao izvor amonijaka. Dok jetra peradi sadrži sve enzime potrebne za stvaranje mokraćne kiseline, jetra golubova nema ksantin oksidazu. Stoga se kod golubova hipoksantin stvara u jetri, a njegova oksidacija u mokraćnu kiselinu se događa u bubrezima, gdje je prisutna ksantin oksidaza.
Iako se u ovom trenutku dušik zapravo izlučuje samo u obliku mokraćne kiseline, stopa njegove sinteze (prema podacima o ugradnji 14C-glicina u purine) pada na otprilike jednu četvrtinu odgovarajuće vrijednosti za aktivne životinje. Ovo smanjenje sinteze mokraćne kiseline odražava ukupno smanjenje brzine metabolizma tokom perioda hibernacije. Značajan dio mokraćne kiseline formirane u ovom trenutku akumulira se u ćelijama većine tkiva i, očigledno, ovdje sudjeluje u održavanju osmotske ravnoteže. Dakle, količina mokraćne kiseline koja se stvarno izlučuje je znatno smanjena. Ovo je vrlo važna promjena, jer se tokom hibernacije osmolarnost krvi povećava kao rezultat velikog gubitka vode i nakupljanja uree u krvi kako bi se smanjila elastičnost vodene pare u krvi. Mokraćna kiselina se slično koristi u morskim mekušcima za osmoregulaciju u prisustvu prekomjernog saliniteta u okolnoj vodi.
| Oslobađanje amino dušika kao mokraćne kiseline kod ptica, zmija i guštera. Atomi dušika mokraćne kiseline (prikazani crvenom bojom potiču od oc-amino grupa aminokiselina. Uključeni su u molekulu mokraćne kiseline na vrlo složen način. Mokraćna kiselina se naziva kiselina jer postoji u tautomernim oblicima koji mogu ionizirati i formiraju urate. Na i K urati su samo malo bolje rastvorljivi u vodi od same mokraćne kiseline.|Ostrvo San Lorenzo, uz obalu Perua, jedno je od onih ostrva na kojima ima Guano je dragoceno đubrivo, jedna tona od toga košta više od 100 dolara. U drugoj polovini prošlog veka čitave flote jedrenjaka prevozile su guano širom sveta, trgujući sa mnogim zemljama. |
Mnogi ne znaju šta je mokraćna kiselina. Ova komponenta nije samo urin, već i protok krvi. To je marker metabolizma purina. Njegova koncentracija u krvi pomaže stručnjacima u dijagnosticiranju brojnih bolesti, uključujući giht. Na osnovu indikatora nivoa ovog elementa u krvi, moguće je kontrolisati odgovor organizma na tretman.
Šta je ovaj element?
U ljudskom tijelu su stalno metabolički procesi. Rezultat razmene mogu biti soli, kiseline, alkalije i mnoga druga hemijska jedinjenja. Da biste ih se riješili, potrebno ih je dostaviti u odgovarajući dio tijela. Ovaj zadatak se izvodi uz pomoć krvotoka. Izlučuju se iz organizma u obliku urina i gastrointestinalnog trakta. Time se objašnjava prisustvo mokraćne kiseline u krvi.
Da vidimo šta je to detaljnije. Mokraćna kiselina je krajnji proizvod razgradnje purinskih baza. Ovi elementi ulaze u organizam sa hranom. Purini su uključeni u sintezu nukleinskih kiselina (DNK i RNA), energetskih molekula ATP-a i koenzima.
Vrijedi napomenuti da purini nisu jedini izvor stvaranja mokraćne kiseline. Može biti rezultat razgradnje tjelesnih ćelija zbog bolesti ili starosti. Izvor za stvaranje mokraćne kiseline može biti sinteza u bilo kojoj ćeliji ljudskog tijela.
Do razgradnje purina dolazi u jetri i crijevima. Stanice sluznice luče poseban enzim - ksantin oksidazu, s kojim purini reagiraju. Krajnji rezultat ove "transformacije" je kiselina.
Sadrži soli natrijuma i kalcija. Učešće prve komponente je 90%. Osim soli, ovo uključuje vodonik, kisik, dušik i ugljik.
Ako je mokraćna kiselina viša od normalne, to ukazuje na kršenje metaboličkog procesa. Kao rezultat takvog neuspjeha, soli se talože u tkivima ljudi, a kao rezultat toga nastaju ozbiljne bolesti.

Funkcije
Unatoč činjenici da višak mokraćne kiseline može uzrokovati značajnu štetu tijelu, još uvijek je nemoguće bez nje. Ona nastupa zaštitne funkcije i ima korisna svojstva.
Na primjer, u procesu metabolizma proteina djeluje kao katalizator. Njegov utjecaj se proteže i na hormone odgovorne za moždanu aktivnost - adrenalin i norepinefrin. To znači da njegovo prisustvo u krvi pomaže u stimulaciji mozga. Njegovo djelovanje je slično kofeinu. Ljudi koji imaju visok nivo mokraćne kiseline u krvi od rođenja su aktivniji i proaktivniji.
Ima kisela i antioksidativna svojstva koja pomažu u zacjeljivanju rana i borbi protiv upala.
Obavlja zaštitne funkcije. Ona se bori protiv slobodnih radikala. Kao rezultat toga, smanjuje se rizik od pojave i razvoja benignih i kancerogenih tumora.
Isporuka analiza
 Slična analiza propisuje se za utvrđivanje zdravstvenog stanja pacijenta, kao i za dijagnosticiranje bolesti koja može uzrokovati povećanje razine mokraćne kiseline u krvi. Da biste dobili prave rezultate, prvo se morate pripremiti za darivanje krvi.
Slična analiza propisuje se za utvrđivanje zdravstvenog stanja pacijenta, kao i za dijagnosticiranje bolesti koja može uzrokovati povećanje razine mokraćne kiseline u krvi. Da biste dobili prave rezultate, prvo se morate pripremiti za darivanje krvi.
8 sati prije posjete laboratoriji ne možete jesti, biomaterijal se uzima na prazan želudac. Začinjenu, slanu i paprenu hranu treba isključiti sa jelovnika. Ovu dijetu treba slijediti dan prije davanja krvi. U istom periodu morate prestati da pijete alkoholna pića.
Mokraćna kiselina iznad normalne može biti posljedica stresa, emocionalnog prenaprezanja ili fizička aktivnost pre analize.
Lijekovi s diuretičkim djelovanjem, vitamin C, kofein, inzulin, beta-blokatori i ibuprofen također mogu iskriviti rezultate. Ako je nemoguće odbiti takve lijekove, trebate upozoriti liječnika prije poduzimanja testa.
Laboratorija će uzeti deoksigenirana krv. Rezultati studije se pripremaju u roku od jednog dana.
Indikatori norme
Ako su rezultati biohemijske analize pokazali brojke koje odgovaraju podacima datim u donjoj tabeli, onda je sve normalno.
| Starosna kategorija (godine) | Norme mokraćne kiseline (µmol/l) | |
| Djeca mlađa od 12 godina | 120-330 | |
| Do 60 | Muškarci | 250-400 |
| Žene | 200-300 | |
| Od 60 | Muškarci | 250-480 |
| Žene | 210-430 | |
| From90 | Muškarci | 210-490 |
| Žene | 130-460 | |
Kao što se vidi iz tabele, nivo raste sa godinama. Najveća digitalna vrijednost kod starijih muškaraca je stopa mokraćne kiseline u krvi, jer je potreba za proteinima u muškom tijelu veća. To znači da konzumiraju više hrane bogate purinom i kao rezultat toga, povećanu mokraćnu kiselinu u krvi.
Šta može uzrokovati odstupanja od norme?
Nivo mokraćne kiseline u krvi zavisi od ravnoteže 2 procesa:
- Sinteza proteina;
- Intenzitet izlučivanja krajnjih produkata metabolizma.
Kada dođe do kvara, što može izazvati povećanje procenta ove kiseline u krvi. Koncentracija mokraćne kiseline u krvnoj plazmi iznad normalnog raspona naziva se hiperurikemija, a koncentracija ispod norme hipourikemija. Koncentracije mokraćne kiseline u urinu iznad i ispod normalne poznate su kao hiperurikozurija i hipourikozurija. Nivo mokraćne kiseline u pljuvački može biti povezan sa nivoom mokraćne kiseline u krvi.
Uzroci hiperurikemije:
- Uzimanje diuretika (diuretika);
- Smanjenje intenziteta izlučivanja putem bubrega;
- Toksikoza;
- Alkoholizam;
- otkazivanja bubrega;
- Pothranjenost ili produženo gladovanje.
Precijenjeni sadržaj može se pojaviti i kod bolesti kao što su AIDS, dijabetes, rak, itd.
Treba napomenuti da čak i neznatno povišen nivo ova supstanca može izazvati stvaranje čvrstih naslaga u organima i tkivima.
Povećana stopa
Sada ćemo saznati zašto je mokraćna kiselina u krvi povišena: uzroci, simptomi i posljedice.
U medicini se hiperurikemija dijeli na dvije vrste: primarnu i sekundarnu.
Primarna hiperurikemija
Ova vrsta je kongenitalna ili idiopatska. Ova patologija se javlja sa učestalošću od 1%. Ovi pacijenti imaju defekt u fermentaciji, što utiče na preradu purina. Na kraju visokog sadržaja mokraćne kiseline u krvi.
Do pojave sekundarne hiperurikemije može doći zbog pothranjenosti. Konzumiranje velikih količina hrane koja sadrži purine može značajno povećati izlučivanje mokraćne kiseline u urinu.
Hiperurikemija ovog tipa može biti povezana sa sljedećim stanjima:
Giht je bolno stanje uzrokovano igličastim kristalima mokraćne kiseline koji se talože u zglobovima, kapilarima, koži i drugim tkivima. Giht se može javiti ako nivo mokraćne kiseline u serumu dosegne 360 µmol/l, ali postoje slučajevi kada vrijednost mokraćne kiseline u serumu dostigne 560 µmol/l, ali ne uzrokuje giht.
IN ljudsko tijelo Purini se metaboliziraju u mokraćnu kiselinu, koja se zatim izlučuje urinom. Redovna konzumacija određenih vrsta hrane bogate purinom – mesa, posebno goveđe jetre i svinjetine (jetra, srce, jezik, bubrezi) i određenih vrsta morskih plodova, uključujući inćune, haringe, sardine, dagnje, kapice, pastrmke, vahnju, skušu i tuna. Postoje i namirnice koje su manje opasne za jelo: ćureće, pileće i zečje meso. Umjerena konzumacija povrća bogatog purinom nije povezana s povećanim rizikom od gihta.
Lesch-Nigan sindrom
Ovaj izuzetno rijedak nasljedni poremećaj je također povezan s visokim nivoom mokraćne kiseline u serumu. Ovaj sindrom karakterizira spastičnost, nevoljni pokreti i kognitivna retardacija, kao i manifestacije gihta.
Hiperurikemija može povećati faktore rizika za kardiovaskularne bolesti
Kamenje u bubrezima
Nivoi zasićenja mokraćne kiseline u krvi mogu dovesti do jednog oblika bubrežnih kamenaca kada se urati kristaliziraju u bubrezima. Ovi kamenci mokraćne kiseline su radioluminiscentni i stoga se ne pojavljuju na rendgenskim snimcima. trbušne duplje. Kristali octene kiseline također mogu doprinijeti stvaranju kamenca kalcijum oksalata djelujući kao "kristali sjemena"
Kelly-Sigmiller sindrom;
Povećana aktivnost u sintezi fosforibozil pirofosfat sintetaze (metabolički neuspjeh).
Pacijenti sa ovom bolešću svake godine rade biohemijsku analizu za povećanje mokraćne kiseline.
Sekundarna hiperurikemija
Ova pojava može biti znak takvih bolesti:
- AIDS;
- Fanconi sindrom;
- kancerozni tumori;
- Dijabetes melitus (hiperurikemija može biti posljedica insulinske rezistencije kod dijabetesa, a ne njegov prethodnik);
- Opekline visokog stepena;
- sindrom hipereozinofilije.
Postoje i drugi razlozi za povećanje mokraćne kiseline - neuspjeh u radu bubrega. Ne mogu ukloniti višak kiselina iz tijela. Kao rezultat, mogu se pojaviti kamenci u bubregu.
Visok nivo mokraćne kiseline primećuje se kod sledećih bolesti:
- Upala pluća;
- tuberkuloza;
- Trovanje metil alkoholom;
- Ekcem;
- trbušni tifus;
- Psorijaza;
- Erysipelas;
- Leukemija.
Asimptomatska hiperurikemija
Postoje slučajevi kada pacijent nema simptome bolesti, a pokazatelji su povišeni. Ovo stanje se naziva asimptomatska hiperurikemija. Javlja se kod akutnog gihtnog artritisa. Indikatori za ovu bolest su nestabilni. U početku se čini da je sadržaj kiseline normalan, ali nakon nekog vremena brojke se mogu povećati za 2 puta. Istovremeno, ove razlike u dobrobiti pacijenata se ne odražavaju. Ovaj tok bolesti moguć je kod 10% pacijenata.
Simptomi hiperurikemije
Kod hiperurikemije, simptomi su različiti starosne grupe drugačije.
Kod vrlo male djece bolest se manifestira u obliku kožnih osipa: dijateze, dermatitisa, alergija ili psorijaze. Značajka takvih manifestacija je otpornost na standardne metode terapije.
Kod starije djece simptomi su nešto drugačiji. Mogu imati bolove u stomaku, nekoherentan govor i enurezu.
Tok bolesti kod odraslih praćen je bolovima u zglobovima. Stopala i zglobovi prstiju prvi ulaze u zahvaćeno područje. Tada se bolest širi na zglobove koljena i lakta. U uznapredovalim slučajevima koža na zahvaćenom području postaje crvena i postaje vruća. Tokom vremena, pacijenti počinju da bole stomak i donji deo leđa tokom mokrenja. Ako se ne preduzmu pravovremene mjere, tada će plovila patiti i nervni sistem. Osobu će mučiti nesanica i glavobolja. Sve to može dovesti do srčanog udara, angine pektoris i hipertenzije.
Tretman
Neki stručnjaci propisuju lijekove kako bi osigurali da je mokraćna kiselina u krvi normalna. Ali određena prehrambena dijeta do kraja života je više efikasan metod tretman.
Ako je pacijentu dijagnosticirana hiperurikemija, liječenje uključuje pridržavanje dijete. Ishrana pacijenta dodatno uključuje:
sok od šargarepe;
Sok od breze;
Laneno sjeme;
sok od celera;
juha od zobene kaše;
Sok od brusnice;
Infuzija šipka.
Ove biljne infuzije a sokovi doprinose brzom rastvaranju i ispiranju taloga soli iz organizma.
Masna, mesna čorba, pržena, soljena, dimljena i kisela hrana su isključeni. Meso se može jesti samo kuvano ili pečeno. Ograničenje unosa mesa - 3 puta sedmično.
pod posebnom zabranom alkoholna pića. U izuzetnim slučajevima, dozvoljeno je samo 30 g votke.
Dajte prednost alkalnoj mineralnoj vodi.
Unos soli treba svesti na minimum. U idealnom slučaju, najbolje je to potpuno izbjeći.
Potrebno je pratiti učestalost obroka. Post može samo pogoršati stanje pacijenta i povećati nivo mokraćne kiseline. Stoga bi broj obroka dnevno trebao biti 5-6 puta. Dane posta najbolje je potrošiti na fermentisane mliječne proizvode i voće.
Neke vrste proizvoda treba isključiti iz jelovnika:
- Sorrel;
- Salata;
- Rajčice;
- Grejp;
- Čokolada;
- jaja;
- kava;
- Torte;
- Repa;
- Patlidžan.
Jabuke, krompir, šljive, kruške, kajsije doprinose snižavanju nivoa mokraćne kiseline. Takođe treba pratiti ravnotežu vode - piti 2,5 litara tečnosti dnevno.
Fizioterapija se također može koristiti za liječenje visokog nivoa kiseline u krvi. Tako će plazmafereza pomoći očistiti krv od viška soli. ne treba zanemariti i terapeutska gimnastika. Brojne jednostavne vježbe (ljuljanje nogama, „biciklizam“, hodanje u mjestu, itd.) pomoći će u stabilizaciji metabolizma. Masaža također potiče razgradnju soli mokraćne kiseline.
Od lijekovi propisuju se kompleksi s protuupalnim, diuretičkim i analgetskim svojstvima. Postoje 3 vrste lijekova za hiperurikemiju:
- Akcija, koja je usmjerena na uklanjanje viška mokraćne kiseline: "Probenecid"; "Acetilsalicilna kiselina"; "Soda bikarbona";
- Doprinosi smanjenju proizvodnje kiseline. Prepisuju se pacijentima koji su imali urolitijazu i onima kojima je dijagnosticirana bubrežna insuficijencija;
- Pomaže u prenošenju mokraćne kiseline iz tkiva u krv i doprinosi njenom izlučivanju: "Zinkhoven".
Tijek liječenja uključuje dijagnozu i eliminaciju prateće bolesti i faktore koji su ih izazvali. Tako se eliminišu uzroci koji su izazvali povećanje nivoa mokraćne kiseline u krvi. Ako, onda to negativno utječe na ljudsko stanje. Na tkivima i organima se taloži naslaga soli. Liječenje takvog odstupanja je raznovrsno: dijeta, fizioterapija, lijekovi i etnonauka. Sve ove tehnike u kombinaciji mogu pomoći u normalizaciji nivoa kiseline.
Najčešći poremećaj metabolizma purina je povećana proizvodnja mokraćne kiseline sa razvojem hiperurikemije. Karakteristika je da je rastvorljivost soli mokraćne kiseline (urata) u krvnoj plazmi niska i kada se prekorači prag rastvorljivosti u plazmi (oko 0,7 mmol/l), one kristališu u perifernim zonama sa niske temperature.
U zavisnosti od trajanja i težine hiperurikemija manifestuje se:
- Pojava tofusa (gr. tophus- porozni kamen, tuf) - taloženje kristala urata u koži i potkožnim slojevima, u mali zglobovi noge i ruke, tetive, hrskavice, kosti i mišići.
- Nefropatija kao rezultat kristalizacije mokraćne kiseline sa oštećenjem bubrežnih tubula i bolest urolitijaze.
- Giht je bolest malih zglobova.
Za dijagnosticiranje poremećaja koristi se određivanje koncentracije mokraćne kiseline u krvi i urinu.
Poremećaji metabolizma purina
Giht
Kada hiperurikemija postane kronična, govore o razvoju gihta (grč. poclos- noga, agra- uhvatiti, doslovno - "noga u zamci").
Mokraćna kiselina se nalazi u krvi u obliku njenih soli. natrijum urati. Zbog niske rastvorljivosti, urati se mogu taložiti u područjima s niskim temperaturama, na primjer, u malim zglobovima stopala i prstiju. Urati koji se nakupljaju u međućelijskoj supstanci fagocitiraju se neko vrijeme, ali fagociti nisu u stanju da unište purinski prsten. Kao rezultat, to dovodi do smrti samih fagocita, oslobađanja lizosomskih enzima, aktivacije oksidacije slobodnih radikala i razvoja akutne upalne reakcije - razvija se gihtni artritis. U 50-75% slučajeva prvi simptom bolesti je nesnosna noćna bol u nožnim prstima.
Dugo se giht smatrao "gurmanskom bolešću", ali se onda pažnja istraživača preusmjerila na nasljednu promjenu aktivnosti enzima metabolizma purina:
- povećanje aktivnosti FRDF-sintetaze- dovodi do prekomjerne sinteze purina,
- smanjenje aktivnosti - zbog toga se FRDF ne koristi za recikliranje purinskih baza, već sudjeluje u prvoj reakciji njihove sinteze. Kao rezultat, povećava se količina uništenih purina, a istovremeno se povećava i njihovo stvaranje.
Oba enzimska poremećaja su recesivna i vezana za X hromozom. Giht pogađa 0,3-1,7% odrasle populacije svijeta, omjer oboljelih muškaraca i žena je 20:1.
Osnove liječenja
Dijeta – smanjenje unosa prekursora mokraćne kiseline hranom i smanjenje njenog stvaranja u organizmu. Zbog toga se iz prehrane isključuju namirnice koje sadrže puno purinskih baza - pivo, kafa, čaj, čokolada, mesne prerađevine, jetra, crno vino. Prednost se daje vegetarijanskoj prehrani cisto najmanje 2 litre vode dnevno.
TO lijekovi Liječenje gihta uključuje alopurinol, koji je po strukturi sličan hipoksantinu. Ksantin oksidaza oksidira alopurinol u aloksantin, dok ovaj drugi ostaje čvrsto vezan za enzim i inhibira njegovu aktivnost. Dešava se, figurativno rečeno, samoubilačka kataliza. Kao posljedica toga, ksantin se ne pretvara u mokraćnu kiselinu, a budući da su hipoksantin i ksantin rastvorljiviji u vodi, lakše se izlučuju urinom.
Urolitijaza bolest
Urolitijaza je formacija kristali soli(kamenje) različite prirode u urinarnog trakta. direktno obrazovanje kamenje mokraćne kiselinečini oko 15% svih slučajeva ove bolesti. Kamenje mokraćne kiseline u urinarnom traktu se taloži u oko pola bolestan giht.
Najčešće su takvi kamenci prisutni u distalnim tubulima i sabirnim kanalima. Uzrok taloženja kristali mokraćne kiseline je hiperurikemija i povećano izlučivanje natrijum urata u urinu. Glavni provocirajući faktor kristalizacije je povećana kiselost urina. Kada pH urina padne ispod 5,75, urati prelaze u manje rastvorljiv oblik (keto oblik) i kristališu u bubrežnim tubulima.
Zakiseljavanje urina javlja iz raznih razloga. To može biti višak zaliha mesnih proizvoda koji sadrže veliki broj nukleinske kiseline, amino kiseline i neorganski kiseline, što takvu hranu čini "kiselom" i snižava pH urina. Također, kiselost urina se povećava kod acidoze različitog porijekla.
Osnove liječenja
Kao i kod gihta, liječenje se svodi na dijeta bez purina i upotreba alopurinola. Osim toga, preporučuje se biljnu ishranu, što dovodi do alkalizacije urina, što povećava udio rastvorljivih u vodi u primarnom urinu soli mokraćne kiseline- urati. U isto vrijeme, već postojeći kristali mokraćne kiseline (kao i oksalati) mogu se otopiti kada se urin alkalizira.
Tretman lijekovima obavezno mora biti popraćeno dijeta bez purina With puno čiste vode, inače pojava kristala ksantina u tkivima i ksantinsko kamenje u bubrezima.
Lesch-Nyhan sindrom
Bolest L e sha-n I hana je kompletna kongenitalno odsustvo aktivnost hipoksantin-guanin-fosforibozil-transferaze, enzim odgovoran za recikliranje purinskih baza. Osobina je recesivna i vezana za X hromozom. Prvi put su ga 1964. godine u Sjedinjenim Državama opisali student medicine Michael Lesh i pedijatar William Nyhan.
Djeca se rađaju klinički normalna, tek do 4-6 mjeseci otkrivaju se razvojne abnormalnosti, odnosno zaostajanje fizički razvoj(sa otežanim držanjem glave), razdražljivost, povraćanje, periodična groznica. Oslobađanje mokraćne kiseline može se otkriti još ranije po narandžastoj boji pelena. Do kraja prve godine života simptomi se povećavaju, razvijaju se kršenje koordinacije pokreta, koreoatetoza, kortikalna paraliza, grč mišića nogu. Većina karakteristika bolest se manifestuje u 2-3. godini života - autoagresija ili samopovređivanje - neodoljiva želja djece da grizu usne, jezik, zglobove prstiju na rukama i nogama.
1. Snažan je stimulans centralnog nervnog sistema, inhibira fosfodiesterazu, koja posreduje u delovanju hormona adrenalina i norepinefrina. Mokraćna kiselina produžava (produžava) djelovanje ovih hormona na CNS.
2. Ima antioksidativna svojstva – u stanju je da stupi u interakciju sa slobodnim radikalima.
Nivo mokraćne kiseline u tijelu kontrolira se na genetskom nivou. Osobe sa visokim nivoom mokraćne kiseline karakteriše povećana vitalnost.
Međutim, povišene razine mokraćne kiseline u krvi ( hiperurikemija) nije bezbedno. Sama mokraćna kiselina, a posebno njene uratne soli (natrijumove soli mokraćne kiseline) su slabo rastvorljive u vodi. Čak i uz blagi porast koncentracije, počinju se taložiti i kristalizirati, formirajući kamenje. Tijelo percipira kristale kao strano tijelo. U zglobovima ih makrofagi fagocitiraju, same ćelije se uništavaju, a iz njih se oslobađaju hidrolitički enzimi. To dovodi do upalne reakcije, praćene jakim bolovima u zglobovima. Takva bolest se zove giht. Još jedna bolest u kojoj se kristali urata talože u bubrežnoj zdjelici ili u bešike, poznat kao bolest urolitijaze.
Za liječenje gihta i urolitijaza primijeniti:
inhibitori enzima ksantin oksidaze. Na primjer, alopurinol, purinska supstanca, je kompetitivni inhibitor enzima. Djelovanje ovog lijeka dovodi do povećanja koncentracije hipoksantina. Hipoksantin i njegove soli su rastvorljiviji u vodi i lakše se izlučuju iz organizma.
dijetalna hrana koja isključuje namirnice bogate nukleinskim kiselinama, purinima i njihovim analozima: riblja ikra, džigerica, meso, kafa i čaj.
litijeve soli, jer su rastvorljivije u vodi od natrijum urata.
Sinteza nukleinskih kiselina Sinteza mononukleotida
De novo sinteza mononukleotida zahtijeva vrlo jednostavne supstance: CO 2 i riboza-5-fosfat (proizvod 1. koraka GMP puta). Sinteza se odvija trošenjem ATP-a. Osim toga, potrebne su neesencijalne aminokiseline koje se sintetiziraju u tijelu, pa čak i uz potpuno gladovanje, sinteza nukleinskih kiselina ne trpi.
ULOGA AMINOKISELINA U SINTEZI MONONUKLEOTIDA
Asparagin. To je donator amidne grupe.
Asparaginska kiselina.
a) Donator je amino grupe
Glycine
a) Aktivan je donor C 1.
b) Učestvuje u sintezi čitavog molekula.
Serene. Donator je aktivnog C 1 .
TRANSFER JEDNOG UGLJIČNIH FRAGMENTA
U ljudskom tijelu postoje enzimi koji mogu izdvojiti C 1 grupu iz određenih aminokiselina. Takvi enzimi su složeni proteini. Sadrži derivat vitamina kao koenzim IN WITH – folna kiselina. U zelenim listovima ima puno folne kiseline, osim toga, ovaj vitamin sintetizira crijevna mikroflora. U ćelijama organizma folna kiselina (FA) se dva puta redukuje (dodaje joj se vodik) uz učešće enzima NADP . H 2 -zavisna reduktaza, i pretvara se u tetrahidrofolnu kiselinu (THFA).
Aktivni C1 se ekstrahuje iz glicina ili serina.
U katalitičkom centru enzima koji sadrži THPA, postoje dvije –NH grupe koje su uključene u vezivanje aktivnog C 1 . Šematski, proces se može predstaviti na sljedeći način:

NADH 2 koji nastaje u obrnutoj reakciji može se koristiti za redukciju piruvata u laktat (glikolitička oksidoredukcija). Reakciju katalizira enzim glicin sintetaza. Nakon toga se metilen-THPA odvaja od proteinskog dijela enzima i tada su moguće dvije varijante njegovih transformacija:
Metilen-THFA može postati neproteinski dio enzima za sintezu mononukleotida.
Metilenska grupa se može modificirati na:
Ove grupe su povezane samo sa jednim od atoma dušika THPA, ali također mogu postati supstrati za sintezu mononukleotida.
Stoga se bilo koja od grupa povezanih s THPA naziva aktivnim C 1 .
Za sintezu bilo kojeg od nukleotida potreban je aktivni oblik riboz fosfata - fosforibozil pirofosfat(FRPP), nastao u sljedećoj reakciji:

Fosforibozil pirofosfat kinaza (FRPP kinaza) je ključni enzim za sintezu svih mononukleotida. Ovaj enzim se inhibira prema principu negativne povratne sprege viškom AMP i GMP. Kod genetskog defekta FRPP kinaze dolazi do gubitka osjetljivosti enzima na djelovanje njegovih inhibitora. Kao rezultat toga, povećava se proizvodnja purinskih mononukleotida, a samim tim i brzina njihovog uništenja, što dovodi do povećanja koncentracije mokraćne kiseline - gihta.
Nakon formiranja FRPP, reakcije sinteze purinskih i pirimidin mononukleotida su različite.
GLAVNE RAZLIKE U SINTEZI PURINSKIH I PIRIMIDINSKIH MONONUKLEOTIDA:
Synthesis Feature purin nukleotida je da se ciklična struktura purinske dušične baze postepeno dovršava na aktivnom obliku riboz fosfata, kao na matriksu. Tokom ciklizacije dobija se gotov purinski mononukleotid.
Prilikom sinteze pirimidin mononukleotida, prvo se formira ciklična struktura pirimidinske azotne baze, koja se u gotovom obliku prenosi na ribozu - na mjesto pirofosfata.
SINTEZA PURINSKIH MONONUKLEOTIDA (AMP i GMF)
WITH  Postoji 10 opštih i 2 specifične faze. Kao rezultat općih reakcija nastaje purinski mononukleotid, koji je uobičajeni prekursor budućih AMP i GMP - inozin monofosfat (IMP). IMP sadrži hipoksantin kao azotnu bazu.
Postoji 10 opštih i 2 specifične faze. Kao rezultat općih reakcija nastaje purinski mononukleotid, koji je uobičajeni prekursor budućih AMP i GMP - inozin monofosfat (IMP). IMP sadrži hipoksantin kao azotnu bazu.
Purinski prsten je izgrađen od CO 2 , asparaginske kiseline, glutamina, glicina i serina. Ove tvari su ili u potpunosti uključene u purinsku strukturu, ili se u njenu konstrukciju prenose odvojenim grupama.
Asparaginska kiselina daje amino grupu i pretvara se u fumarnu kiselinu.
Glicin: 1) je u potpunosti uključen u strukturu purinske azotne baze; 2) je izvor jednougljičnog radikala.
Serin: takođe donor radikala sa jednim ugljenikom.
FRPP + glutamin -------> glutamat + FF + fosforibosilamin
Enzim koji katalizuje ovu reakciju naziva se fosforibozil amidotransferaza. To je ključni enzim u sintezi svih purinskih mononukleotida. Regulisano po principu negativne povratne sprege. Alosterični inhibitori ovog enzima su AMP i GMF.
U drugoj fazi, fosforibosilamin stupa u interakciju s glicinom.
Treća faza je ugradnja atoma ugljika čiji je donor glicin ili serin.
Tada je šestočlani fragment purinskog prstena završen:
4. faza - karboksilacija uz pomoć aktivnog oblika CO 2 uz učešće vitamina H - biotina.
5. faza - aminacija uz učešće amino grupe iz aspartata.
6. faza - aminacija zbog amino grupe glutamina.
Sedma, završna faza je uključivanje jednougljičnog fragmenta (uz učešće THPA) i formira se gotov MMF.
 Zatim se odvijaju specifične reakcije, kao rezultat kojih se IMP pretvara ili u AMP ili u GMP. Takvom transformacijom u molekulu se pojavljuje amino grupa, au slučaju transformacije u AMP umjesto OH grupe. Kada se formira AMP, asparaginska kiselina je izvor dušika, a glutamin je neophodan za stvaranje GMP.
Zatim se odvijaju specifične reakcije, kao rezultat kojih se IMP pretvara ili u AMP ili u GMP. Takvom transformacijom u molekulu se pojavljuje amino grupa, au slučaju transformacije u AMP umjesto OH grupe. Kada se formira AMP, asparaginska kiselina je izvor dušika, a glutamin je neophodan za stvaranje GMP.
U nekim tkivima postoji alternativni način sinteze - reciklaža(ponovna upotreba) purinskih azotnih baza, koje su nastale pri razgradnji nukleotida.
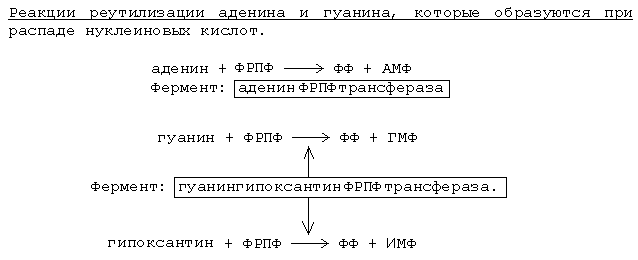
Enzimi koji kataliziraju reakcije ponovne upotrebe najaktivniji su u stanicama koje se brzo dijele (embrionalna tkiva, crvena koštana srž, stanice raka), kao i u tkivima mozga. Dijagram pokazuje da enzim gvanin hipoksantin FRPPtransferaza ima širu specifičnost supstrata od adenin FRPPtransferaza- osim gvanina, može nositi i hipoksantin - nastaje IMP. Kod ljudi postoji genetski defekt ovog enzima - "Lesch-Nyhanova bolest". Takve bolesnike karakteriziraju izražene morfološke promjene u mozgu i koštanoj srži, mentalna i fizička retardacija, agresivnost, autoagresija. U eksperimentu na životinjama, sindrom autoagresije je modeliran hranjenjem kofeina (purina) u velikim dozama, koji inhibira proces ponovnog korištenja gvanina.